不同叶稻瘟抗性水稻品种对根际真菌的影响
2021-08-02马继琼孙一丁杨奕许明辉
马继琼 孙一丁 杨奕 许明辉
摘要:为了解水稻稻瘟病抗性与土壤根际真菌之间的关系,利用ITS高通量测序技术对7个不同抗稻瘟病水稻品种土壤根际真菌ITS1序列进行分析。结果表明,共检测到根际真菌ITS1有效片段486 250个,以97%的相似度聚为1 178分类操作单位(operational taxonomic unit,简称OTU);物种查询显示,归为12个门(含1个未分类的真菌群),35个纲(含8个未分类的菌群),82个目(含12个未分类的菌群),146个科(含34个未分类的菌群),248个属(含63个分类地位未定或未分类的菌群)和362个种(含63个未分类种)。7个土样真菌门类相似,子囊菌门(Ascomycota)是最大的优势菌门,相对丰度为67.04%。抗和感稻瘟病品种群土样在稻绿核菌属(Ustilaginoidea)和稻绿核菌(Ustilaginoidea sp.)上存在显著性差异(P<0.05),其相对丰度平均数分别为5.09%、7.31%,即在稻瘟病病菌侵染条件下抗稻瘟病品种对稻曲病病原菌稻绿核菌具有抑制作用。结果可为探寻水稻抗稻瘟病机制提供土壤微生物的线索。
关键词:稻瘟病;根际真菌;ITS1序列;测序
中图分类号:S182;S435.111.4+1 文献标志码: A
文章编号:1002-1302(2021)12-0075-05
收稿日期:2020-09-23
基金项目:国家自然科学基金地区科学基金(编号:31860369)。
作者简介:马继琼(1969—),女,云南永平人,硕士,副研究员,主要从事作物种质资源研究,E-mail:mjq_503@163.com;共同第一作者:孙一丁(1979—),男,云南个旧人,博士,副研究员,主要从事作物种质资源研究,E-mai:3182335606@qq.com。
通信作者:许明辉,博士,研究员,主要从事种质资源与遗传育种研究。E-mail:ynxuminghui@163.com。
土壤微生物是土壤中最活跃的部分,在促进土壤物质、能量转化和地球生物化学循环方面发挥着重要作用[1]。稻田是世界上最大的人工湿地,大量研究表明,稻田土壤微生物的多样性受到土质[2]、耕作方式[3]、施肥[4-7]、农药[8-9]等环境因素的显著影响,作物不同的基因型[10-13]甚至同一基因型不同的发育阶段均会影响土壤微生物的多样性[14]。在稻田土壤生态系统中,水稻根系分泌物是影响根际微生物种类及丰度的重要因素。水稻根系分泌物包括有机酸、维生素、酶、植物生长调节剂和氨基酸,为植物根际微生物的生长和繁殖提供了良好的生长环境和充足的养分,分泌物组成或某些成分数量的变化可能会改变根际微生物的种类和数量[11-12]。随着微生物的生长,根际微生物又会对水稻的磷和氮利用效率、化感作用和稻米品质产生影响[10,15]。真菌是土壤微生物的重要组成部分,参与植物残体的分解,推动土壤养分的循环[16],对环境污染物有指示作用[17],同时也受到植物的影响[18]。因此,植物土壤根际真菌的多样性是研究植物与土壤微生物之间关系的重要内容之一。
微生物多样性的研究方法可大致分为2类:一种是传统的培养分离方法,其主要通过不同的培养基来分离微生物。另一种是分子鉴定方法,利用磷脂脂肪酸、RNA或DNA等指示剂分子的特征来分析微生物的生态多样性[19]。目前环境中能培养的微生物仅占总微生物的1%~10%[20-21],传统的培养方法仅反映在此条件下存活的这部分微生物的具体信息,因此传统的培养方法用于反映土壤微生物的多样性具有一定的局限。分子鉴定方法克服了传统分离方法的局限性,在分子水平上揭示了土壤微生物種类和遗传多样性。 ITS基因存在于所有真菌的基因组中,分布于18S、5.8S、80S间,包含ITS1和ITS2区,中度保守,已被广泛应用于土壤微生物的遗传多样性分析[22-25]。
稻瘟病由稻瘟病原菌引起,在水稻全生育期中均可发病,该病遍布于全世界稻区,是稻作生产中最具破坏性的病害之一。在稻田生态系统中,环境条件的变化可能会影响微生物群落的多样性,微生物群落的生长也会在一定程度上改变环境并影响水稻。水稻对叶稻瘟的抗性是包括叶面附生微生物在内的许多因素相互作用的结果[26]。但水稻抗病性与土壤微生物之间的关系鲜有报道。分析不同抗性水稻品种根际微生物群落的结构和丰度,可能会发现一些抗性机制的线索。本研究利用ITS高通量测序技术分析7种不同抗稻瘟病水稻品种根际土壤微生物群落的结构和丰度。
1 材料与方法
1.1 水稻品种和稻瘟病的自然诱发
田间试验于2019年4—10月在云南省昆明市宜良县进行,试验田为肥力均匀的水田,前茬作物为大白菜。根据多年的鉴定,选择7个对叶瘟具有不同抗性的水稻品种(表1)在同一田块种植,以确保每个品种的试验条件相同。试验小区面积为20 m2(4 m×5 m),每个小区种植1个品种。通过重施氮肥(525 kg/hm2 尿素)、密集种植行距(20 cm×10 cm),不使用任何杀菌剂,并在小区四周种植易感品种蒙古稻进行叶瘟的自然诱发。到孕穗期叶瘟病症充分显现后,按标准进行调查分级(GB/T 15790—2009稻瘟病测报调查规范)品种抗性划分标准)。
1.2 土壤样品采集
在水稻种植之前,从试验田的5个点(梅花状)采集混合土壤样品,并在云南省农业科学院质量标准与测试技术研究所对土壤的基本特性进行测试。土壤较为肥沃,基本特征如下:pH值为7.35,有机质含量为23.31 g/kg,碱性氮含量为85.31 mg/kg,速效磷含量为89.13 mg/kg,速效钾含量为46.21 mg/kg。
水稻移栽后一直在土壤淹水条件下种植,为便于取土壤样品,在水稻孕穗期(8月12日)采集土壤样品时放干水。在每个品种试验小区中,带土取5个水稻植株,用刀削去四周土壤,保留植株根系周围5 cm土壤,在离表层约10 cm处取土样,将5个水稻植株土样均匀混合。后将样品置入液氮中保存,送至上海美吉生物医药科技有限公司进行土壤DNA提取,并进行测序和数据分析。
1.3 DNA提取和PCR扩增
使用E.Z.N.A. soil DNA Kit (Omega Bio-tek,Norcross,GA,美国) 土壤DNA提取试剂盒,按照说明书对7个土壤样品微生物群落基因组DNA进行提取。在1%琼脂糖凝胶上检查DNA质量,并用Nano Drop 2000紫外可见分光光度计测定DNA的浓度和纯度。使用引物ITS1-F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2-R(5′-TGCGTTCTTCATCGATGC-3′)[27]在ABI Gene Amp9700 PCR仪上扩增真菌rDNA 的ITS1序列。具体扩增程序如下:95 ℃变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸 45 s,扩增程序包括34个循环;最后于72 ℃延伸10 min,并于4 ℃保存。 PCR混合物包含4 μL 5×Trans Start Fast Pfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL正向引物(5 μmol/L),0.8 μL反向引物(5 μmol/L),0.4 μL Trans Start Fast Pfu DNA聚合酶,模板1 μL DNA(10 ng/μL),最后添加ddH2O至总体积40 μL。该反应体系重复3次。
1.4 Illumina Miseq测序
将来自相同样本的PCR产物混合,经2%琼脂糖凝胶电泳后纯化回收。回收产物经Quantus Fluorometer (Promega,美国) 定量检测合格后,使用NEXTFLEXRapid DNA-Seq Kit进行建库:(1)接头链接;(2)利用磁珠吸附筛选,去除接头自连片段;(3)对文库模板利用PCR扩增进行富集;(4)利用磁珠进行PCR产物回收,得到文库。然后在Miseq PE300(Illumina,美国)平台进行测序(上海美吉生物医药科技有限公司)。
1.5 测序数据的处理
将原始的ITS1测序读段通过Trimmomatic进行质量过滤并通过FLASH合并,并遵循以下标准:(1)在50 bp滑动窗口中,任何平均质量得分小于20的位点均截短了300 bp读段,并且短于50 bp截短的读段将被丢弃,包含歧义字符的读段也将被丢弃;(2)根据重叠序列,针对长于10 bp的重叠序列进行组装,无法组装的读物将被丢弃;(3)根据条形码和引物区分样品,并调节序列方向,精确的条形码匹配,引物匹配中的2个核苷酸错配,使用UPARSE(7.1版,http://drive5.com/uparse/)对具有97%相似性截止值的操作分类单位(OTU)进行聚类,鉴定并去除了嵌合序列。利用RDP分类器(http://rdp.cme.msu.edu/)在数据库UNITE(version 8.0)中依次对单个OTU代表序列进行查询分类,置信度阈值为0.7。使用DPS软件进行显著性测试。
2 结果与分析
2.1 7个水稻品种叶瘟抗性
孕穗期对7个水稻品种进行叶瘟抗性调查,由表1可知,诱发品种蒙古稻表现高感(HS),说明稻瘟病诱发成功,其他6个品种具有高抗(HR)到高感(HS)不同的抗性,抗性鉴定结果与以往结果一致,说明这几个品种抗性稳定。根据叶瘟抗性可将7个品种分为抗感2群,其中岫粳12号(HR)、济稻8号(HR)、楚粳42号(MR)为抗性群,松辽5号(MS)、藤系144号(HS)、蒙古稻(HS)、南29(HS)为易感群。
2.2 7个土壤样品的多样性指数
7个样品测序覆盖度均超过 99.95%,表明测序深度足够,满足后续分析。通过过滤和连接等步骤,从7个土壤样品中获得了486 250(个)有效片段,以97%的相似度聚为1 178分类操作单位OTU,平均长度为219 bp。其中有很大一部分OUT丰度小,仅在部分样品中出现,每个样本只能检测到其中一部分OUT,范围为312~567个(表1:Sob指数)。样品间Shannon指数数值相似,Simpson(1-D)指数非常低(表1),表明样品间多样性并不存在较大的差异,根际真菌群落是多样的。
物种注释显示,在7个土壤样品中检测到12个门(包含1个未分类的真菌群),35个纲(包含8个未分类的菌群),82个目(包含12个未分类的菌群),146个科(包含34个未分类的菌群),248个属(包含63个分类地位未定或未分类的菌群)和362个种(包含63个分类地位种)。可见,本试验中稻田土壤真菌多样性较为丰富。
2.3 真菌群落的结构和丰度差异
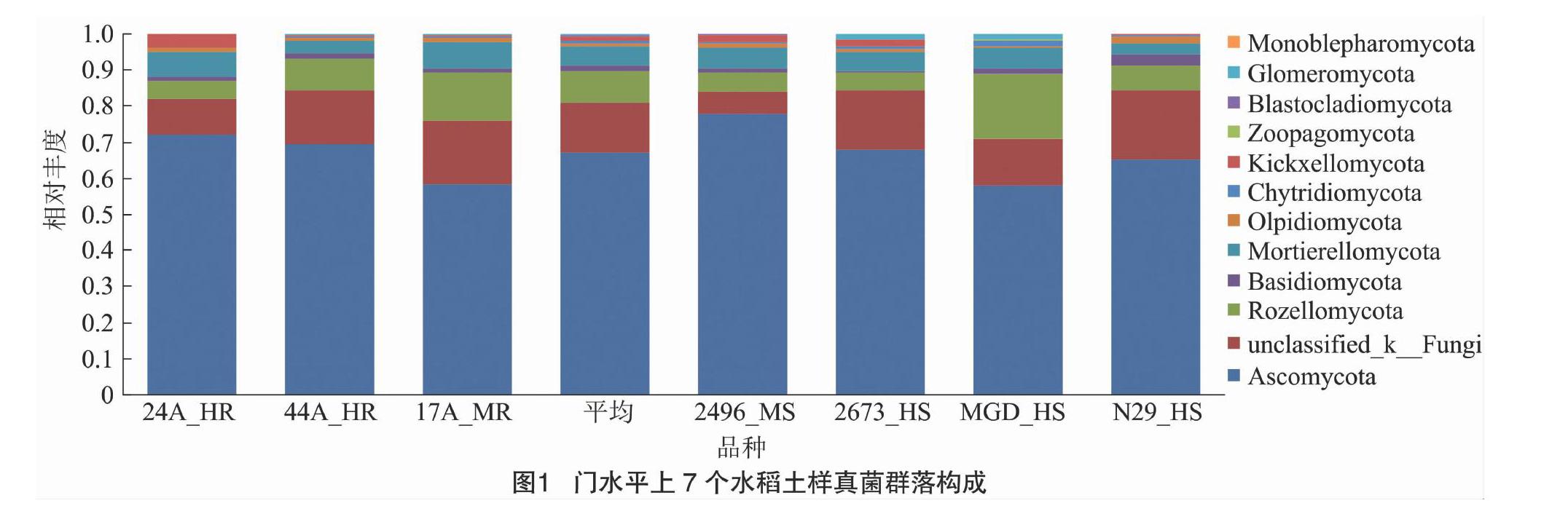
门水平上,各样品真菌群落结构组成较相似(图1)。子囊菌门(Ascomycota)是最大的优势菌门,平均相对丰度为67.04%,其他门相对丰度依次为罗兹菌门(Rozellomycota) 8.78%、被孢霉门(Mortierellomycota)5.41%、担子菌门(Basidiomycota)1.45%、梳霉门(Kickxellomycota)1.16%、油壶菌门(Olpidiomycota)0.96%、壶菌门(Chytridiomycota)0.64%、球囊菌门(Glomeromycota)0.52%、捕虫霉门(Zoopagomycota)0.09%、芽枝霉门(Blastocladiomycota)0.07%、单毛壶菌门 (Monoblepharomycota)0.01%。其中,球囊菌门、芽枝霉门、单毛壶菌门并未在所有样品中检测到,仅在3~5个样品中出现。未分类的真菌(p__unclassified_k__Fungi)丰度为13.88%,占比较大。
纲水平上,其中相对丰度大于1%的有粪壳菌纲(Sordariomycetes)56.21%、 未分类的真菌菌群(unclassified_k__Fungi)13.86%、未分类的隐真菌门菌群(unclassified_p__Rozellomycota)7.51%、被孢霉纲(Mortierellomycetes)5.39%、散囊菌纲(Eurotiomycetes) 3.97%、 座囊菌纲(Dothideomycetes)2.71%、 锤舌菌纲 (Leotiomycetes) 2.16%、分类地位未定罗兹菌群(Rozellomycotina_cls_Incertae_sedis)1.27%、Harpellomycetes 1.16%、未分类的子囊菌群体(unclassified_p__Ascomycota)1.04%;在相對丰度小于1%的纲或菌群中有17个相对丰度极低,范围在0.000 775%~0.500 000%之间,仅在部分样品中(1~6个)出现。经平均数显著性测验,抗感稻瘟病品种群间在门、纲、目、科水平上相对丰度均没有显著性差异。
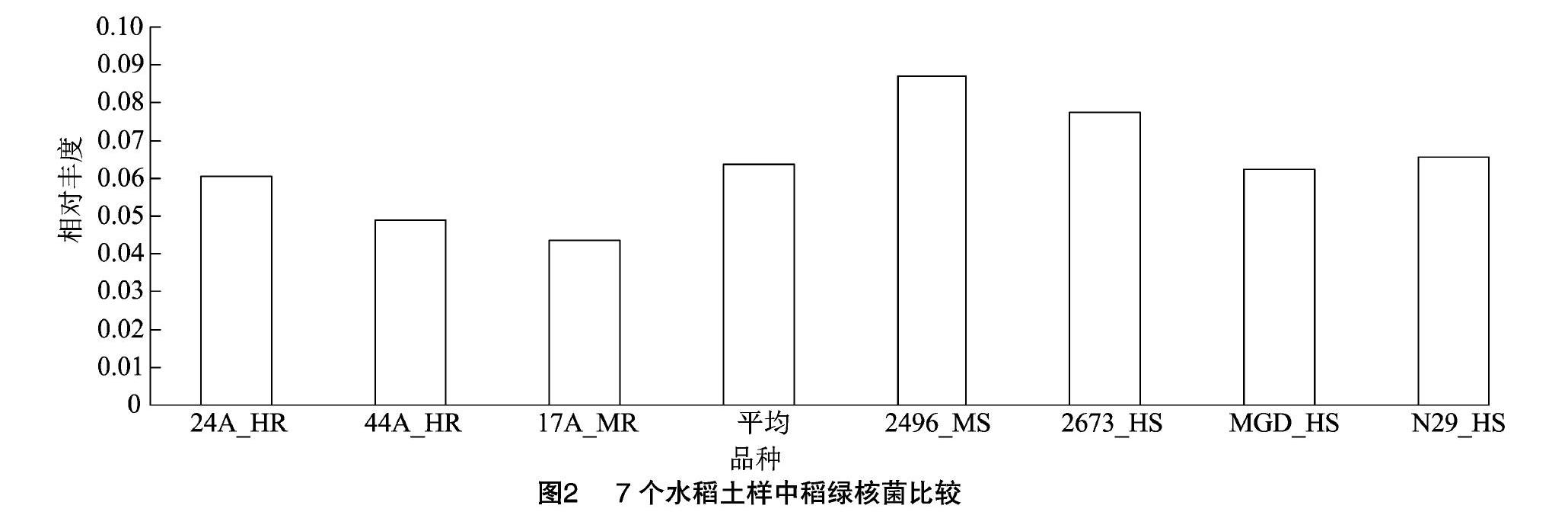
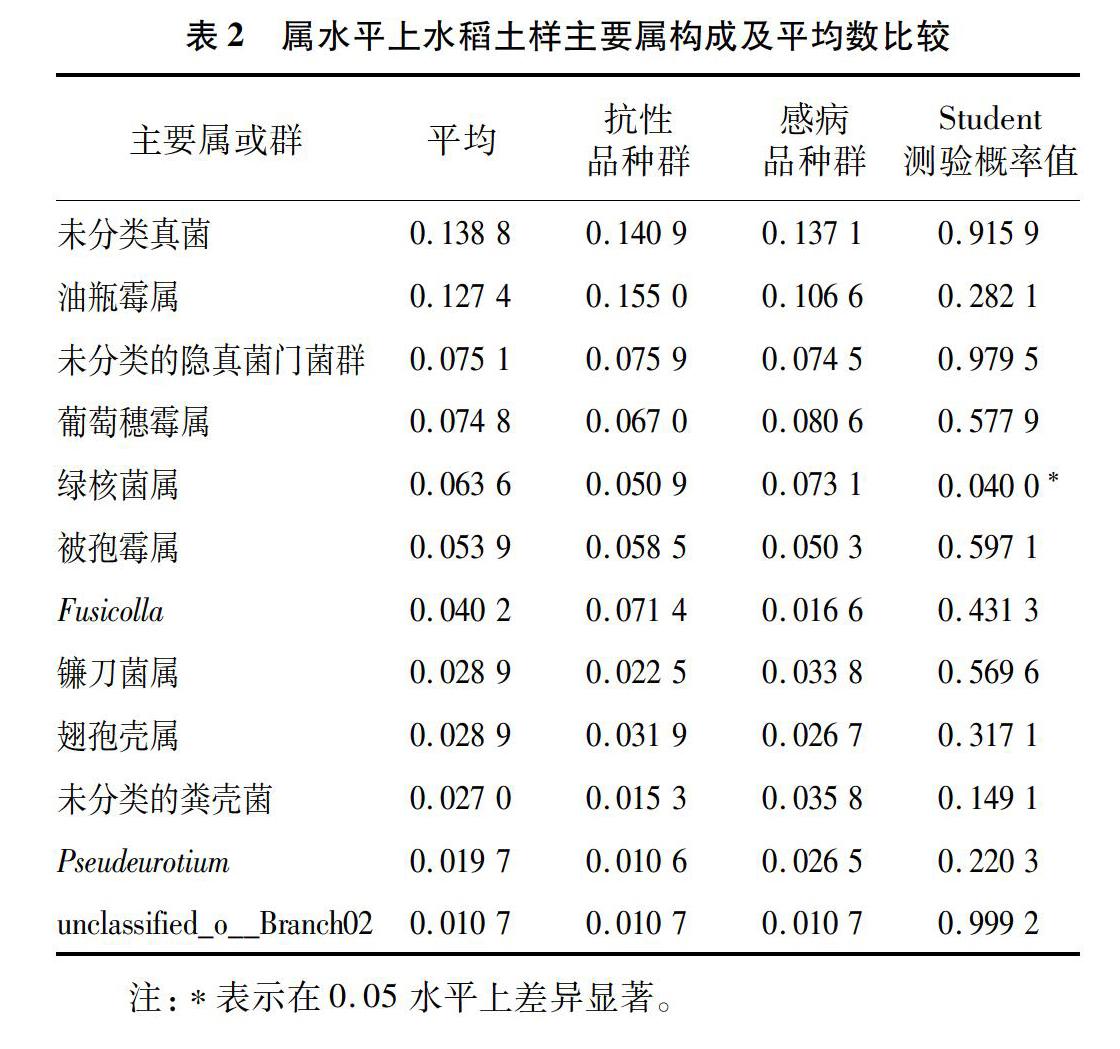
属水平上,相对丰度大于1%的共有12个属(其中含有3个未分类菌群)(表2)。在相对丰度小于1%的236个属(含分类地位未定或未分类菌群)中有185个相对丰度极低,仅在部分样品中(1~6个)出现。经显著性测验,抗稻瘟病和感稻瘟病品种群间在稻绿核菌属(Ustilaginoidea)上存在显著性差异(P<0.05),其相对丰度平均数分别为5.09%、7.31%。进一步分析表明,7个样品检测到362个种(包含95个分类地位未定或未分类菌种),抗稻瘟病和感稻瘟病品种群间仅在稻绿核菌上存在显著性差异(图2)(P<0.05)。
3 讨论与结论
已有的研究表明,我国不同生态区水稻土壤真菌不仅在门类上存在差异,各菌门比例(丰度)上也存在差异,土壤功能肯定也存在差异。重庆[22]、湖南[23]、江苏[24]等地稻田土壤真菌门类相对简单,仅含有3~5门的菌群;子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)是共有的,其中子囊菌门是最大的菌门,一般占比在42.59%以上;而乌鲁木齐市水稻根际土壤共检测出11 个门的真菌,种类较为丰富,子囊菌门也是最大的菌门,但却没有上述3个地区中共有的接合菌门[25]。本研究田块7个土壤样品检测到11门和1个未分类的真菌群,门类相对上述地区较为丰富,子囊菌门也是优势门,其中隐真菌门(Rozellomycota)、被孢霉门(Mortierellomycota)、梳霉门(Kickxellomycota)、油壶菌门(Olpidiomycota)、球囊菌门(Glomeromycota)、捕虫霉门(Zoopagomycota)、芽枝霉门(Blastocladiomycota)、单毛壶菌门(Monoblepharomycota)是江苏、湖南、重庆等地水稻土没有的,而梳霉门、捕虫霉门、芽枝霉门是乌鲁木齐市也没有的,但該田块却没检测到接合菌门菌群,也未检测到乌鲁木齐市有的轮形动物门(Rotifera)。造成这种水稻土壤菌门差异的原因有很多,其中生态区不同和土质不同可能是最大的影响因素,而轮作、施肥等措施一般仅改变菌门的丰度比例[22-25]。值得一提的是,真菌检测方法可能是造成这种差异的原因之一;上述研究均基于ITS1的研究,检测方法基本相同,但分类查询的真菌ITS数据库版本不同也可能造成检测结果的差异。本研究用真菌ITS1序列进行真菌种类和丰度分析,可将大多数真菌进行分类,但在各水平上仍有一定比例未分类的菌群,说明本试验田块真菌种类较为丰富,可能存在一些未知的菌群,但也反映出ITS1序列的局限。本研究中,稻绿核菌属只检测到一个OUT,且比例高达真菌总量的6.36%,查询结果为Ustilaginoidea sp.,序列与稻曲病病原菌稻绿核菌(U. virens)和稻白色绿核菌(U. albicans)相应序列均100%相同,而这是2个不同的种[28],无法将2个种分开。可见,需要其他序列如ITS2加入或其他方法补充才能进行更为精确的分类研究。
该稻田多年以来均是由笔者进行水稻资源鉴定,每年稻曲病均有不同程度的发生,稻曲病病菌落入土中越冬,所以土壤中检测到稻曲病病菌不足为奇,证明稻曲病病原菌主要来源于土壤中。有趣的是抗感稻瘟病品种群之间存在显著性差异,抗稻瘟病品种具有抑制稻绿核菌的作用。参试品种均种植在同一田地上,所有环境条件均相同,只是水稻基因型不同,即对叶瘟的抗性不同。所以笔者推测水稻品种对稻瘟病和稻曲病存在某些共同的抗菌机制,品种在受到稻瘟病病菌侵袭的情况下,其根系可能分泌某些特殊成分,选择性地抑制了稻曲病菌,并改变了它们的丰度。作为回报,稻曲病病菌可能对水稻品种对叶瘟的抗性具有促进或抑制作用。这是一个值得进一步研究的课题。试验中未能检测到主要真菌性病害的纹枯病菌(Thanatephorus cucumeris)、稻瘟病菌(Pyricutaria orazae)、恶苗病菌(Fusarium moniliforme),说明这3种主要病害的病原物不存在土壤来源。
参考文献:
[1]袁颖红,樊后保,李辉信,等. 模拟氮沉降对杉木人工林土壤微生物的影响[J]. 林业科学,2012,48(9):8-14.
[2]卜洪震,王丽宏,肖小平,等. 双季稻区稻田不同土壤类型的微生物群落多样性分析[J]. 作物学报,2010,36(5):826-832.
[3]郭梨锦,曹凑贵,张枝盛,等. 耕作方式和秸秆还田对稻田表层土壤微生物群落的短期影响[J]. 农业环境科学学报,2013,32(8):1577-1584.
[4]蔡元锋,吴宇澄,王书伟,等. 典型淹水稻田土壤微生物群落的基因转录活性及其主要生理代谢过程[J]. 微生物学报,2014,54(9):1033-1044.
[5]袁红朝,吴 昊,葛体达,等. 长期施肥对稻田土壤细菌、古菌多样性和群落结构的影响[J]. 应用生态学报,2015,26(6):1807-1813.
[6]唐海明,肖小平,李微艳,等. 长期施肥对双季稻田根际土壤微生物群落功能多样性的影响[J]. 生态环境学报,2016,25(3):402-408.
[7]李美霖,陈宇眺,洪晓富,等. 不同氮肥管理方式对稻田土壤微生物群落结构的影响[J]. 浙江农业学报,2020,32(2):308-316.
[8]张仕颖,夏运生,肖 炜,等. 除草剂丁草胺对高产水稻土微生物群落功能多样性的影响[J]. 生态环境学报,2013,22(5):815-819.
[9]张雯雯,徐 军,董丰收,等. 苄嘧磺隆对水稻田土壤微生物群落功能多样性的影响[J]. 农业环境科学学报,2014,33(9):1749-1754.
[10]李永夫,罗安程,魏兴华,等. 水稻利用难溶性磷酸盐的基因型差异及其与根系分泌物活化特性的关系[J]. 中国水稻科学,2006,20(5):493-498.
[11]陈宏宇,李晓鸣,王敬国. 抗病性不同大豆品种根面及根际微生物区系的变化Ⅰ.非连作大豆(正茬)根面及根际微生物区系的变化[J]. 植物营养与肥料学报,2005,11(6):804-809,815.
[12]陈宏宇,李晓鸣,王敬国. 抗病性不同大豆品种根面及根际微生物区系的变化Ⅱ.连作大豆(重茬)根面及根际微生物区系的变化[J]. 植物营养与肥料学报,2006,12(1):104-108.
[13]赵 佳,聂园军,黄 静,等. 转基因作物影响土壤微生物群落多样性的研究[J]. 山西农业科学,2017,45(10):1702-1705.
[14]宋亚娜,林智敏.红壤稻田不同生育期土壤氨氧化微生物群落结构和硝化势的变化[J]. 土壤学报,2010,47(5):987-994.
[15]劉立军,常二华,熊溢伟,等. 水稻根系分泌物有机酸、多胺与稻米蒸煮品质及蛋白质组分的关系[J]. 扬州大学学报(农业与生命科学版),2014,35(3):48-53.
[16]盛玉钰,丛 静,卢 慧,等. 神农架国家公园林线过渡带土壤真菌多样性[J]. 生态学报,2018,38(15):5322-5330.
[17]Shahbaz M,Akhtar M J,Ahmed W. Integrated effect of different N-fertilizer rates and bioslurry application on growth and N-use efficiency of okra (Hibiscus esculentus L.)[J]. Turkish Journal of Agriculture and Forestry,2014,38:311-319.
[18]Rodríguez-Blanco A,Sicardi M,Frioni L. Plant genotype and Nitrogen fertilization effects on abundance and diversity of diazotrophic bacteria associated with maize (Zea mays L.)[J]. Biology and Fertility of Soils,2015,51(3):391-402.
[19]周 桔,雷 霆. 土壤微生物多样性影响因素及研究方法的现状与展望[J]. 生物多样性,2007,15(3):306-311.
[20]Amann R I,Ludwig W,Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews,1995,59(1):143-169.
[21]Wilson M C,Piel J. Metagenomic approaches for exploiting uncultivated bacteria as a resource for novel biosynthetic enzymology[J]. Chemistry & Biology,2013,20(5):636-647.
[22]张 慧,马连杰,杭晓宁,等. 不同轮作模式下稻田土壤细菌和真菌多样性变化[J]. 江苏农业学报,2018,34(4):804-810.
[23]陈力力,刘 金,李梦丹,等. 水稻-油菜双序列复种免耕、翻耕土壤真菌多样性[J]. 激光生物学报,2018,27(1):60-68,59.
[24]周 阳,黄 旭,赵海燕, 等. 麦秸秆和沼液配施对水稻苗期生
长和土壤微生物的调控[J]. 土壤学报,2020,57(2):479-489.
[25]刘师豆,韩耀光,朱新萍,等. 棉秆炭调控对碱性镉污染水稻根际土壤真菌群落结构和功能的影响[J]. 环境科学,2020,41(8):3846-3854.
[26]Costa D M D,Pinto M T C,Geethanjalee H D N. Suppression of rice pathogens by phyllosphere associated microflora of different rice varieties in Sri Lanka[J]. Tropical Science,2006,46(2):97-104.
[27]Miao C P,Mi Q L,Qiao X G,et al. Rhizospheric fungi of Panax notoginseng:diversity and antagonism to host phytopathogens[J]. Journal of Ginseng Research,2016,40(2):127-134.
[28]王 疏,白金铠. 绿核菌属(Ustilaginoidea)——新种[J]. 菌物系统,1997,16(4):257-258.
