眉县猕猴桃果品氯吡脲残留量测定
2021-08-02李海亮李浩浩魏倩倩
李海亮,李浩浩,魏倩倩
(眉县食品安全检验检测中心,陕西 眉县 722301)
眉县是我国猕猴桃主产区之一,也是“国家地理标志产品”“国家生态原产地保护产品”县。近年来,随着栽植面积和市场对优质产品需求量的大幅增加,猕猴桃生产与销售面临产品质量控制难,产品销售市场竞争激烈,产业链需全程科学、规范、高效管理等问题[1]。
氯吡脲(Forchlorfenuron)是一种人工合成的细胞分裂素,具有促进细胞分裂、分化和增大,促进花芽发育,防止落花落果,提高果实坐果率和促进果实膨大等功效,是目前使用最广泛的植物生长调节剂之一。近年来一些猕猴桃果实生理和品质研究表明,氯吡脲对猕猴桃果品的口感和品质有一定影响,引起了人们关注。目前氯吡脲检测国家标准主要2个,一是GB/T 20770-2008《粮谷中486种农药及相关化学品残留量的测定 液相色谱——串联质谱法》,规定了检测486种农药及相关化学品的方法,为规避杂质对多种检测目标物的干扰,前处理过程较为复杂;二是GB 23200.110-2018《植物源性食品中氯吡脲残留量的测定 液相色谱——质谱联用法》,针对植物源性产品专门检测氯吡脲,提取液要经过无水硫酸镁和PSA净化,前处理过程也较为复杂,对此有人对西瓜[4]、蔬菜[5-6]氯吡脲检测的样品净化方法作了有益尝试并取得较好效果。迄今猕猴桃果品氯吡脲检测国内尚无简便、可靠方法,为此我们进行了检测方法优化,并采用新确立的方法对眉县猕猴桃氯吡脲残留量进行了检测。
1 材料和方法
1.1 氯吡脲测定方法的确定
1.1.1 仪器与试剂 主要有高效液相色谱仪串联三级四重杆质谱仪、高速冷冻离心机、超声提取仪;氯吡脲标准品(浓度100 μg·ml-1,农业部环境保护科研检测所)、甲醇、乙腈、一级水、C18填料、PSA填料、氯化钠、无水硫酸镁、0.22 μm有机滤膜。
标样溶液配制:称取一定量的氯吡脲标准品,用甲醇配制成8 μg·ml-1的标样储备液,储存于0~4 ℃的条件下,根据需要用甲醇稀释至适当浓度的标样溶液。
1.1.2 仪器参数
(1)色谱条件
色谱柱:C18 柱(50 mm×2.1 mm,1.9 μm);流动相A:水;流动相B:甲醇;流动相C:0.1%甲酸水;流动相D:乙腈;流速:0.25 mL/min;柱温:35 ℃;进样量:5 μL。梯度程序如表1。

表1 流动相梯度程序
(2)质谱条件
正、负离子模式下氯吡脲均有较强响应,15 ng·ml-1氯吡脲标准品在设定条件下正离子响应为1.04×106;负离子模式响应为5.48×105。通过实验,负离子模式下存在杂质干扰,检测值不稳定且加标回收率偏小;而正离子模式下回收率和精密度均符合要求,故选择正离子模式。正离子模式条件为:碰撞气为氮气;电喷雾电压为3 200 V;离子传输管温度320 ℃;离子源温度350 ℃;辅助气压力5Arb;SRM模式下的参数见表2。

表2 正离子模式下的质谱参数
1.1.3 样品前处理 称取均质样品5.0 g放入50 mL塑料离心管内,加入10 mL乙腈(分析纯)涡旋提取2 min,超声5 min,以6 000 r/min离心5 min,取上清液到另一离心管中备用;再用10 mL乙腈试剂对原样品残渣涡旋提取一次,离心取全部上清液与第一步的提取液合并,向合并后的提取液中加入2 g氯化钠,涡旋混匀,离心后取适量上层提取液,过0.22 μm有机滤膜,供液相色谱—串联质谱测定。
1.2 猕猴桃果品氯吡脲含量测定
1.2.1 样品采集 在全县范围内选取栽植面积大而集中,管理技术水平具有代表性的乡镇,再在所选乡镇选取有代表性的田块,并在其中随机选取生长正常的植株5个并编号挂牌(样株),在每个样株不同方位选取基本等量的果品。样品采集时间为植物生长调节剂处理后第80、90、100 d,每次采集时每个样株选取的果品按株混合、及时预处理和妥善保存。
1.2.2 测定方法 按2.1 氯吡脲确定的测定方法测定。
2 结果与分析
2.1 样品提取和净化
2.1.1 溶剂乙腈量的选择 采用提取率较高的乙腈提取法,在猕猴桃阴性样品中添加一定量(20 μg·kg-1)氯吡脲标准溶液,10 ml乙腈一次提取、20 ml乙腈一次提取、20 ml乙腈二次提取,回收率分别为90.5%、93.7%和95.4%,表明使用20 ml乙腈分二次提取更充分。
2.1.2 除杂过程的选择 经对猕猴桃阴性样品进行50 μg·kg-1水平氯吡脲加标(限量值加标),收集二次10 ml乙腈提取液混匀,取3 ml加入到各实验组对应的除杂试剂中(同时做不除杂对照),涡旋离心后取上清液检测,取得的不同除杂试剂回收率结果如表3。
从表3可看出,猕猴桃样品经过乙腈提取后,提取液中会含有来自于猕猴桃样品中的水分,这部分水分会对提取液产生稀释作用,从而导致加标回收率偏低。而采用氯化钠、无水硫酸镁或无水硫酸钠除水后的提取液避免了水分对样品的稀释,从而实验回收率趋于正常。不除杂的对照实验中,上机检测出峰位置并无杂质干扰,只是回收率处于较低水平;单纯使用氯化钠除水后的样品,检测结果同样无杂质干扰,且回收率较为理想。与使用氯化钠除水相比,使用无水硫酸镁和无水硫酸钠除水时,使用前需要对试剂烘干,且成本高于氯化钠,故本研究确定单独使用氯化钠分离样品中水分的方法。在猕猴桃称样量5.0 g、20 ml乙腈提取的条件下,2 g氯化钠即可在猕猴桃样品所含的水分中达到饱和并析出,从而与乙腈分层,所以本方法最终确定了 “2.1.3样品前处理”中的提取方法。
图1 空白基质中添加氯吡脲标样溶液的选择粒子总流图(20 μg·ml-1)

表3 不同除杂试剂的氯吡脲加标回收率
2.2 线性方程及检出限
通过配置不同浓度梯度的氯吡脲标准品(0.08~30 ng·ml-1)检测,以浓度为横坐标,定量离子峰面积为纵坐标,得到线性归方程为:Y=0.218 6×106x+0.527×105,R2=0.999 6,线性良好。以3倍信噪比(S/N=3)所对应的标样溶液质量分数为仪器的最低检测浓度,再根据样品的稀释倍数(20倍),确定本法的最低检出限为0.4 μg·kg-1。
2.3 测定方法的准确度和精确度
在猕猴桃氯吡脲阴性样品中添加浓度分别为0.4、10、100 μg·kg-1时,测定计算结果显示,本方法回收率为85%~107%,相对标准偏差1.26%~5.47%(表4)。试验回收率和相对标准偏差均满足GB/T27404-2008要求。该方法最低检出限为0.4 μg·kg-1。

图2 氯吡脲标准曲线
2.4 猕猴桃氯吡脲测定方法的可行性
对比美国环境保护局对大部分水果规定的氯吡脲最大残留量0.01 mg·kg-1,我国GB 2763-2019食品安全国家标准规定的猕猴桃(食品)氯吡脲最大残留限量0.05 mg·kg-1,和本实验猕猴桃4个品种(徐香、红阳、海沃德、秦美)的阴性样品不同浓度氯吡脲加标实验结果(表4)及最低检出限0.4 μg·kg-1,表明本方法能满足猕猴桃果品氯吡脲残留分析要求,完全适用于猕猴桃氯吡脲残留分析。

表4 实验回收率和精确度
2.5 眉县猕猴桃中氯吡脲残留量
表5显示,眉县猕猴桃主栽区和主要栽植品种在浸蘸植物生长调节剂80 d后即8月上旬前后果品氯吡脲残留量0.025~0.058 mg·kg-1,其中徐香品种既有最高值也有最低值,小法仪镇测定的2个品种含量都较高,浸蘸植物生长调节剂90 d、100 d氯吡脲残留量高低也呈现同样趋势,表明猕猴桃果品氯吡脲残留量高低与品种没有必然联系,可能与栽植区域即地形地势和小气候有关。
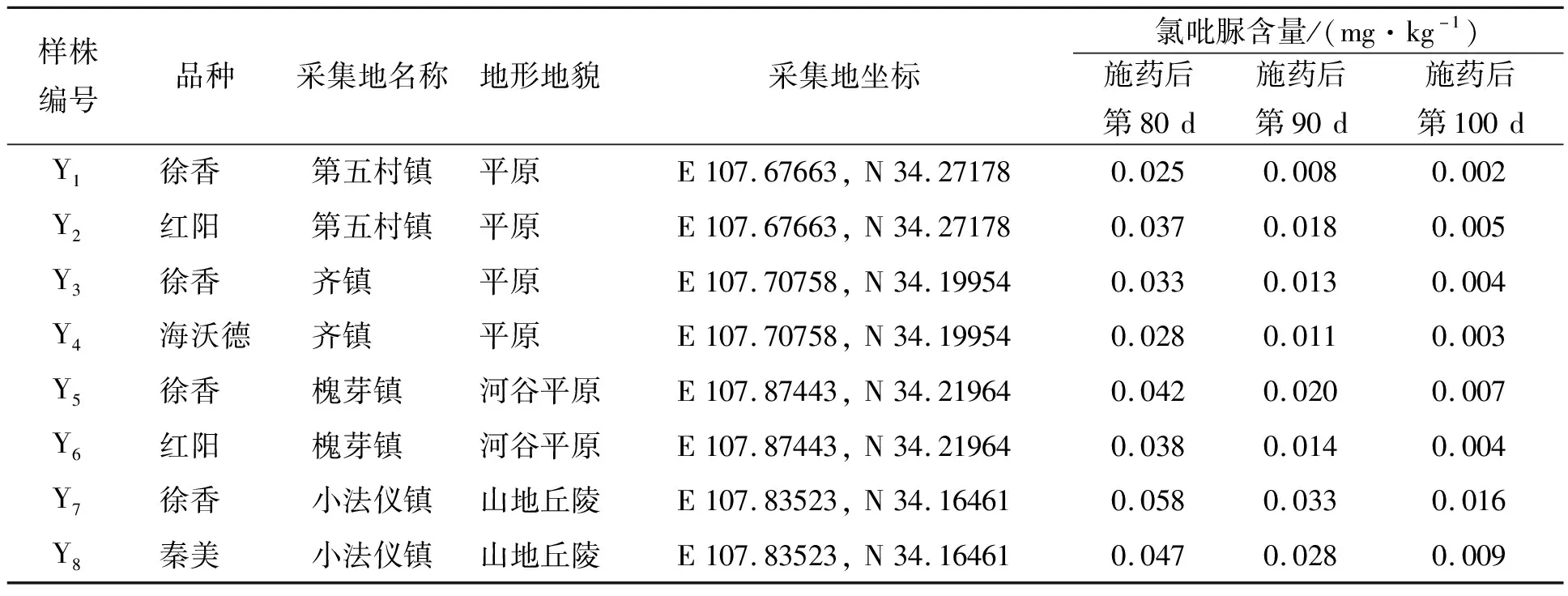
表5 眉县猕猴桃果品氯吡脲含量
所测定的全部样品氯吡脲残留量从浸蘸植物生长调节剂80 d后的0.025~0.058 mg·kg-1、平均0.039 mg·kg-1,降低到90 d后(8月中旬)的0.008~0.033 mg·kg-1、平均0.018 mg·kg-1,降幅为40.4%~68.0%、平均55.0%;又从90 d后降低到100 d后(8月下旬)的0.002~0.016 mg·kg-1、平均0.006 mg·kg-1,降幅为51.5%~75.0%、平均68.1%;表明随着生长,果品的氯吡脲残留量逐步降低,且随时间延长降低幅度加大,原因可能有二,一是药物自身的代谢衰减,二是生长后期猕猴桃果实进一步增重,对药物残留浓度起到了稀释作用。
所测定的全部样品氯吡脲残留量在蘸植物生长调节剂90 d、100 d后都低于我国标准(0.05 mg·kg-1),且分别只有国家标准值的16.0%~66.0%(平均36.3%)、4.0%~32.0%(平均12.5%),即使是残留量较高的蘸植物生长调节剂80 d也只有1个样品高于我国标准,说明眉县猕猴桃果品氯吡脲残留量在8月中旬以后合格、安全。
3 结论与讨论
(1)本研究确定的猕猴桃果品氯吡脲残留量测定方法步骤为:称取均质样品5.0 g放入50 ml塑料离心管内,加入10 ml乙腈(分析纯)涡旋提取2 min,超声5 min,以6 000 r·min-1离心5 min,取上清液到另一离心管中备用;再用10 ml乙腈试剂对原样品残渣涡旋提取一次,离心取全部上清液与第一步的提取液合并,向合并后的提取液中加入2 g氯化钠,涡旋混匀,离心后取适量上层提取液,过0.22 μm有机滤膜,供液相色谱—串联质谱测定。
(2)眉县猕猴桃果品浸蘸氯吡脲类植物生长调节剂80、90、100 d后,氯吡脲残留量依次为0.025~0.058、0.008~0.033、0.002~0.016 mg·kg-1,除80 d后1个样品高于国家标准外,其余批次均符合国家标准要求,食用安全,尤其是施药后100 d的残留量非常低,仅为国家标准(0.05 mg·kg-1)的4.0%~32.0%(平均12.5%)。
(3)相关研究表明[13], 猕猴桃中氯吡脲的代谢消解符合非线性一级动力学消解模式,浸蘸后27 d之内残留量急剧下降,消解率达到60%~80%,不同生长时期对消解率有显著影响,不同施药浓度、不同品种对消解率影响不显著。眉县猕猴桃生产中绝大多数农户只在5月中旬(开花后30~40 d)、严格按药品使用说明对幼果浸蘸氯吡脲类植物生长调节剂,同时2020年眉县政府有关部门规定并监督检查“8月25日之前禁止采摘销售,8月25日之后分品种视成熟情况采摘”,可确保猕猴桃幼果浸蘸氯吡脲类植物生长调节剂后有100 d以上的生长期,并完全达到国家规定的氯吡脲残留量安全标准。目前市场上可用于猕猴桃生产的氯吡脲类植物生长调节剂合格产品,对提高产量、改善商品性、促进果农增收等作用明显,科学使用氯吡脲类植物生长调节剂不失为一种高效安全的方式。
