磷酸三苯酯对小鼠巨噬细胞Raw264.7的毒性及吞噬功能的影响
2021-08-01张梓涵张文锋张艳超陈慧玲
张梓涵,李 丽,张文锋,张艳超,陈慧玲,石 明,2,*
(1.广东医科大学公共卫生学院,东莞市环境医学重点实验室,广东 东莞523808;2.广东医科大学寮步医院,广东 东莞523400)
随着卤代阻燃剂在全球范围内被逐步禁用,有机磷阻燃剂(organophosphorus flame retardants,OPFRs)因其价格低、品种多、阻燃效果好等优点,被应用于建筑材料、家具、纺织用品、电子产品等行业,并广泛存在于生态环境中。磷酸三苯酯(triphenyl phosphate,TPHP)是一种典型的芳香基OPFRs,在各类工业产品中被广泛用作增塑剂和阻燃剂。但是,TPHP具有较高的挥发性和亲脂性,在生产和使用过程中容易从材料中通过挥发、渗出等方式释放,并持久存在于环境中。由于TPHP难降解,在环境中存留时间较长,在生物体内具有富集效应,对人体健康和环境安全具有较大威胁,其毒性研究受到了人们的广泛关注。
免疫系统作为机体执行免疫应答及免疫功能的重要系统,参与协助各系统发挥正常的生理功能,对外源性化学物较敏感。TPHP可引起某些免疫细胞的损伤,诱导过敏性接触性超敏反应,但目前对其引发的具体免疫毒性作用及机制尚未见报道。巨噬细胞是构成机体免疫系统的重要组成部分之一,具有趋化性运动、吞噬、分泌和抗原呈递等功能,在巨噬细胞吞噬过程中,最为显著的特点是在吞噬体周围出现丝状肌动蛋白F-actin的局部快速积聚与相关蛋白在吞噬体周围分布。Toll样受体4(Toll-like receptor 4,TLR4)是巨噬细胞的表面模式识别受体之一,被激活后可诱导巨噬细胞释放炎性细胞因子,启动巨噬细胞的免疫防御功能和吞噬功能。TLR4的激活能够引起磷脂酰肌醇-3-激 酶(PI3K)-丝/苏 氨 酸 激 酶(serine/threonine kinase,Akt)-哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号轴的激活,其中PI3K/Akt信号通路在调节细胞活化、炎症反应、细胞存活和凋亡中发挥着中心作用。
因此,本研究以小鼠巨噬细胞系Raw264.7为研究对象,通过检测TPHP对巨噬细胞的存活率、细胞毒性和吞噬功能的影响,探讨TPHP暴露对免疫系统的毒性作用和潜在机制,为TPHP暴露对免疫系统影响和毒性风险提供参考。
1 材料与方法
1.1 主要试剂
DMEM培养基、胎牛血清(fetal bovine serum,FBS)、CCK-8试剂均购自Gibco公司;乳酸脱氢酶释放检测试剂盒(CytoTox 96Non-Radioactive Cytotoxicity Assay)购自Promega公司;SDS-PAGE凝胶制备试剂盒购自康为世纪生物科技有限公司;牛血清白蛋白(BSA)购 自Sigma公 司;TLR4、p-Akt、Akt、p-mTOR、mTOR抗体购自Cell Signaling Technology公司;ECL发光液购自ThermoFisher Scientific公司;Phagocytosis Assay Kit(IgG-FITC)购自Cayman公司。
1.2 细胞系和细胞培养
小鼠巨噬细胞系Raw264.7为广东医科大学闫冲教授惠赠。在含有10%胎牛血清的DMEM培养基,于37℃、CO体积分数为5%、饱和湿度的培养箱中静置培养。定时观察培养基颜色和细胞状态,及时更换新鲜培养基和传代培养。将细胞培养至贴壁状态,于普通光学显微镜下观察并拍摄细胞的形态和伪足。
1.3 CCK-8比色法检测TPHP对Raw264.7细胞活性的影响
取对数生长期的Raw264.7细胞,按照每孔5×10个细胞加入到96孔板中,待细胞贴壁后,加入不同浓度(12.5、25、50、100、200、400 μmol/L)的TPHP溶液处理细胞。对照组每孔加入等体积的DMEM培养液。在细胞培养箱中继续培养24、48或72 h后,每孔加入10 μL CCK-8试剂并在37℃培养箱中继续孵育3 h。使用酶标仪检测吸光度D
(450)。按如下公式计算细胞存活率:
1.4 乳酸脱氢酶释放法检测细胞毒性
将Raw264.7细胞以5×10/孔加入到96孔板中,待细胞贴壁后,加入不同浓度(12.5、25、50、100、200、400 μmol/L)的TPHP溶液处理细胞,对照组每孔加入等体积的培养液,乳酸脱氢酶(lactate dehydrogenase,LDH)最大释放量组则在加CytoTox 96试剂前45 min加入10 μL的10×裂解液。在细胞培养箱中继续培养24 h、48 h或72 h后,将所有待测孔的50 μL上清液转移至新的96孔板中,再加入50 μL CytoTox 96Reagent检测液,室温避光孵育30 min后,每孔加入50 μL终止液,使用酶标仪读取490 nm波长处的吸光度值D
(490)。LDH释放率用如下公式计算:
1.5 荧光微球法测定Raw264.7细胞吞噬功能
将Raw264.7细胞均匀接种于6孔板中,待细胞贴壁后,加入不同浓度(0、12.5、25和50 μmol/L)的TPHP继续孵育24 h,加入FITC标记的荧光微球(用含5% BSA的TBST缓冲液按1∶500稀释),在培养箱中继续孵育4 h,期间每隔30 min振动培养板。弃去培养基,用1 mL预冷的PBS洗涤细胞后,加入0.2%台盼蓝淬灭吸附在细胞表面的荧光,再用预冷的PBS洗涤细胞两次,采用流式细胞术测量吞噬荧光微球阳性细胞的数目及比例。
1.6 Western blot检测各蛋白的表达
不同浓度(0、12.5、25和50 μmol/L)TPHP处理Raw264.7细胞24 h后,用PBS洗涤细胞2次,再加入细胞裂解混合液(细胞裂解液、磷酸酶抑制剂、PMSF的体积比为100∶1∶1),冰上裂解30 min后刮取细胞,超声充分破碎,4℃、12 000 r/min离心10 min,吸取上清液,采用BCA蛋白定量试剂盒测定蛋白浓度后,加入5×上样缓冲液,100℃煮沸5 min制备蛋白样品。各组取30 μg的蛋白于5%的浓缩胶、8%的分离胶进行电泳,电压调至80 V,当样品进入分离胶,更换100 V电压。电泳后将蛋白转移到PVDF膜上。用5% BSA室温封闭PVDF膜2 h后,分别加入mTOR、p-mTOR、TLR4、Akt、p-Akt和βactin抗体,4℃孵育过夜。次日用TBST洗膜3次,每次10 min。加入HRP标记的山羊抗兔二抗孵育1 h后,用TBST洗膜3次。最后加入ECL发光液进行显影。使用ImageJ软件分析各条带灰度值,计算目的蛋白的相对表达水平。
1.7 统计学分析
采用SPSS 19.0软件进行统计学分析,数据采用x
ˉ±s
表示。两组间比较采用t
检验,3组及以上采用单因素方差分析,率的比较采用χ
检验,检验水准α=0.05,P
<0.05为差异具有统计学意义。2 结果
2.1 TPHP对Raw264.7细胞活性的影响
CCK-8比色法检测结果如图1所示。当TPHP作用24 h时,200和400 μmol/L的TPHP对细胞活力的抑制率超过50%,而12.5、25、50 μmol/L的TPHP未引起明显的细胞毒性作用(图1A)。当作用时间达到48 h,50 μmol/L及以上浓度的TPHP可显著抑制细胞的存活率(P
<0.05,图1B)。当作用时间达到72 h,即使最低浓度的TPHP(12.5 μmol/L)也可引起巨噬细胞存活率明显下降(P
<0.05,图1C)。TPHP对Raw264.7细胞的毒性作用呈剂量依赖性(r
=0.960,P
<0.05)和时间依赖性(r
=0.980,P
<0.05)。以上结果说明随着TPHP浓度和作用时间的增加,Raw264.7细胞的存活率逐渐降低。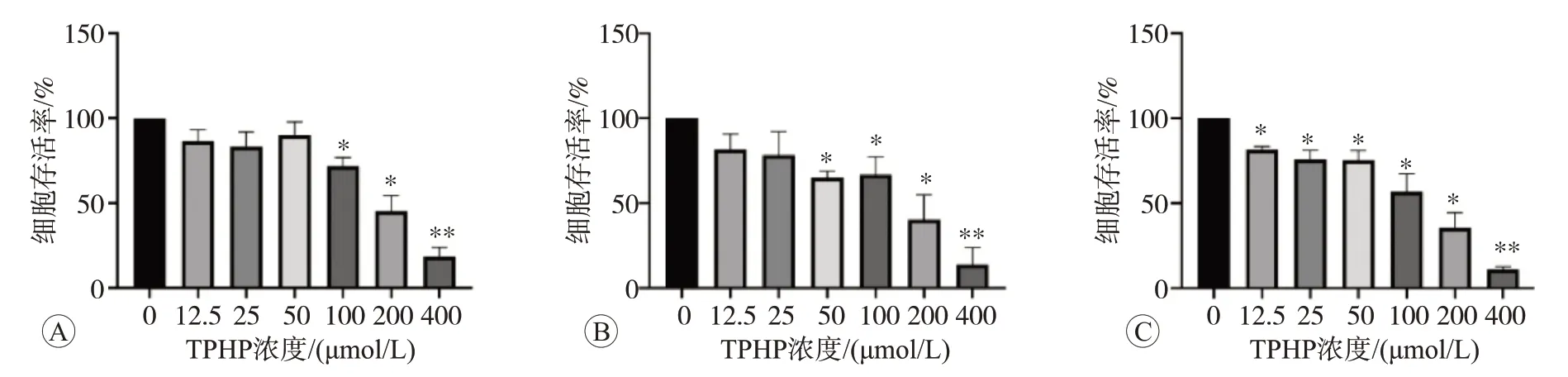
图1 不同浓度的TPHP处理Raw264.7细胞不同时间的细胞存活率比较
2.2 TPHP对Raw264.7细胞LDH释放的影响
正常状态下,LDH存在于细胞质中。当细胞膜的磷脂双分子层结构的完整性被破坏后,LDH会穿过不完整的细胞膜渗漏到培养液中,通过检测细胞培养上清中的LDH活性,可以反映细胞的损伤程度。LDH释放率检测结果如图2所示。与对照组相比,50~400 μmol/L组Raw264.7细胞培养基中LDH水平均明显升高(P
<0.05)。从作用时间来看,TPHP作用72 h后,即使是25 μmol/L的TPHP也会导致Raw264.7细胞培养液中的LDH水平升高(P
<0.05)。以上结果说明TPHP对Raw264.7细胞具有明显的细胞毒性。
图2 不同浓度的TPHP处理Raw264.7细胞不同时间的LDH释放率比较
2.3 TPHP引起Raw264.7细胞形态改变
采用普通光学显微镜观察TPHP处理Raw264.7细胞24 h后的形态变化,结果如图3所示。对照组细胞呈规则圆形,体积小,贴壁紧密,生长状态良好(图3A)。低浓度(25 μmol/L)TPHP处理后,细胞形态与对照组相比无明显的差异,说明低浓度TPHP对细胞结构损害较小,这与CCK-8检测结果一致(图3B)。当TPHP细胞浓度达到100 μmol/L,有较多细胞的细胞膜向外延伸呈不规则形,细胞呈长梭形,伸出较多伪足(图3C)。以最大浓度(400 μmol/L)TPHP处理后,大多数细胞的细胞膜向外延伸呈不规则形,有大量伪足(图3D),说明高浓度的TPHP暴露会引起Raw264.7细胞发生分化。

图3 不同浓度TPHP处理Raw264.7细胞24 h后的细胞形态变化(×40)
2.4 TPHP能够增强Raw264.7细胞吞噬作用
当TPHP的浓度≤50 μmol/L时对Raw264.7细胞的毒性较小,同时考虑染毒时间过长会对细胞造成非毒性伤害,造成实验结果的偏倚,故选择TPHP浓度为50 μmol/L、染毒时间为24 h进行后续巨噬细胞吞噬作用及相关蛋白表达水平的测定。巨噬细胞的吞噬作用在维持非特异性免疫的稳态中发挥重要作用。本研究采用荧光微球法测定巨噬细胞的吞噬能力,结果如图4所示。与对照组相比,当TPHP浓度为25和50 μmol/L时,FITC-A细胞的比例显著增加,说明较高浓度的TPHP能够增强Raw264.7细胞的吞噬作用。

图4 荧光微球法检测不同浓度TPHP处理Raw264.7细胞24 h后的吞噬能力
2.5 TPHP促进TLR4的表达及Akt、mTOR的磷酸化
TLR4是Toll样受体家族的成员,表达于巨噬细胞膜上,在巨噬细胞发挥先天免疫激活中起重要作用。Western blot检测结果见图5,显示随着TPHP浓度的升高,TLR4的表达水平亦升高,与对照组相比,12.5~50 μmol/L TPHP处理组TLR4的表达差异均有统计学意义(P
<0.05或P
<0.01),说明不同浓度的TPHP均能够激活巨噬细胞表面TLR4的表达。为了进一步研究TPHP对巨噬细胞活性和功能的影响,本研究还检测了TPHP处理24 h后Akt和mTOR的表达情况,结果显示TPHP可以促进Akt和mTOR的磷酸化(P
<0.05)。以上结果表明TPHP可引起免疫相关蛋白的变化。
图5 不同浓度的TPHP对Raw264.7细胞mTOR、TLR4和Akt蛋白表达的影响
3 讨论
本研究以Raw264.7细胞作为研究对象,分析不同浓度TPHP在不同作用时间下的细胞毒性,通过普通光学显微镜观察,借助流式细胞术检测巨噬细胞吞噬荧光微球的能力,结合Western blot验证TLR4蛋白表达水平和Akt和mTOR的磷酸化水平。结果表明,TPHP对Raw264.7细胞具有明显的细胞毒性,诱导细胞伸出伪足,增强巨噬细胞吞噬功能,同时引起上述蛋白表达升高或触发磷酸化水平。
由于TPHP通常以添加剂的形式存在于终产品中,很容易被释放到自然界中。TPHP较难被降解,最终可通过空气、水等媒介进入人体,并在人体内蓄积,产生潜在毒性作用。目前在室内空气、灰尘、土壤、污水处理厂排放液等环境介质中均已检测到了TPHP。研究显示,TPHP的暴露会对浮游生物、鱼类、底栖生物等造成伤害,如能够抑制斜生栅藻和小球藻的生长,导致稀有鮈鲫肝脏组织病理学变化、血脑屏障被破坏,使斑马鱼发育畸形、视力受损并干扰游泳行为等。环境介质中的TPHP可通过呼吸、饮食、皮肤等进入机体,在人或动物体内蓄积,并对内分泌系统、肝脏、肾脏、生殖系统和神经系统造成极大的威胁。陈敏等采用气相色谱测定了TPHP通过尾静脉暴露昆明小鼠后的组织分布,发现TPHP主要蓄积在小鼠脾脏、肝脏和肾脏中。研究显示,TPHP对机体多个系统具有毒性效应。
巨噬细胞是机体重要的免疫效应细胞,具有免疫防疫、免疫监视、免疫调节、抗原呈递等功能,在维持机体内环境稳态和抵御微生物入侵过程中发挥重要作用。由于巨噬细胞已经成功建系,体外传代培养方法均已成熟,因此本研究选择Raw264.7细胞系作为研究对象,探讨TPHP对巨噬细胞的毒性作用。本研究结果显示,随着TPHP暴露浓度和作用时间的增加,TPHP呈现明显的毒性作用(P
<0.05)。当作用时间为24 h时,较低浓度(12.5、25和50 μmol/L)的TPHP无明显细胞毒性,但是当作用时间达到72 h时,低浓度的TPHP也会显著影响细胞的存活率。An等的研究发现高浓度(150和200 μmol/L)的TPHP可导致A549细胞和Caco-2细胞的存活率降低,而低于100 μmol/L的TPHP则对细胞存活率无明显影响。Canbaz等发现浓度高于50 μmol/L的TPHP对小鼠骨髓来源的树突状细胞具有明显细胞毒性。以上研究与我们的检测结果基本一致。吞噬能力是反映巨噬细胞免疫防御能力的一个重要指标。我们测定了较低浓度(12.5、25和50 μmol/L)的TPHP作用24 h对巨噬细胞吞噬功能的影响。本研究结果发现25和50 μmol/L的TPHP能增强Raw264.7细胞的吞噬功能。TLR4是巨噬细胞膜上大量表达的模式识别受体,其异常激活后会引发巨噬细胞释放炎症介质,从而激活固有和获得性免疫系统来清除异物。本研究检测结果发现TPHP能够促进细胞膜表面TLR4的表达。TLR4可以通过PI3K/Akt信号通路调节机体的免疫反应,参与细胞的生长、增殖、分化和运动。PI3K是细胞内的重要信号传导分子,激活后的PI3K可以作为第二信使激活Akt,活化的Akt可以调节下游的效应因子mTOR,进而影响固有免疫细胞的生存、迁移和分泌相关炎症因子。在免疫细胞中,mTOR调节新陈代谢以决定细胞的活性、增殖和效应功能。本研究显示TPHP可促进Raw264.7巨噬细胞Akt和mTOR的磷酸化,说明TPHP能够通过TLR4/Akt/mTOR信号通路影响巨噬细胞的功能。研究显示,PI3K/Akt信号通路能够进一步激活下游的mTOR,而mTOR是一种高度保守的丝氨酸/苏氨酸蛋白激酶,在维持机体免疫稳态中发挥着重要的作用,能够影响固有免疫细胞如巨噬细胞、树突状细胞、肥大细胞等的增殖、迁移和效应功能。Lee等的研究结果指出,TLR4-mTORC1调控膜脂质筏和肌动蛋白细胞骨架之间的聚合与解聚,介导巨噬细胞吞噬作用。但是,本研究仅检测了TPHP对巨噬细胞Raw264.7的细胞毒性、吞噬功能以及TLR4、Akt和mTOR蛋白的表达,并未验证相关信号通路的作用。因此,在后续研究中将会使用阻断剂来检测TPHP是否通过影响TLR4/Akt/mTOR信号通路进而影响巨噬细胞的吞噬作用等功能。
综上所述,本研究采用不同浓度TPHP处理巨噬细胞,发现TPHP可抑制巨噬细胞的活力、损伤细胞膜的完整性,还可引起TLR4蛋白表达水平升高,Akt和mTOR磷酸化水平升高,通过TLR4、Akt和mTOR蛋白调控巨噬细胞的功能,为进一步研究TPHP诱导Raw264.7巨噬细胞功能改变的机制奠定了基础,也为OPFRs的污染防控提供了基础参考数据。
