小鼠脂肪组织中免疫细胞分离方法的优化及亚群在肥胖小鼠中的作用
2021-07-31武永乐尚宏伟孙广永丁惠国
武永乐 尚宏伟 孙广永 张 栋* 丁惠国*
(1.首都医科大学附属北京佑安医院肝病消化中心,北京 100069;2.首都医科大学基础医学院实验教学中心,北京100069; 3.首都医科大学附属北京友谊医院科研实验中心,北京 100050)
久坐的生活方式及过多的能量摄入导致肥胖发生率逐年增加。而由肥胖引发的胰岛素抵抗、非酒精性脂肪性肝病、动脉粥样硬化等多种代谢性疾病,大大增加了患者死亡风险。目前肥胖作为一种慢性炎症疾病的观点已是共识。研究[1]显示,脂肪组织中的炎症反应是诱发肥胖、胰岛素抵抗及各种肥胖相关疾病的核心,几乎所有的免疫细胞(如巨噬细胞、粒细胞、T淋巴细胞、B淋巴细胞)均不同程度地参与了肥胖及其代谢性疾病的过程。其中巨噬细胞是肥胖中介导脂肪组织炎症反应的主要细胞,其活化后能分泌大量趋化因子,促进T细胞、自然杀伤(natural killer,NK)细胞等向脂肪组织趋化募集;同时其产生的活性氧、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)亦能引起氧化应激,加重脂肪组织的炎症反应。另外,脂肪组织中的CD4、CD8等促炎T细胞功能、数量的增加及调节性T细胞数量的降低也与脂肪组织的炎症反应密切相关[2]。因此,认识脂肪组织中巨噬细胞、T淋巴细胞及其他免疫细胞的比例、功能状态是研究肥胖等代谢性疾病免疫学发病机制的基础。分离纯化脂肪组织免疫细胞的技术多种多样,目前主要有机械研磨及酶消化方式,后者包括Ⅱ型胶原酶、Ⅳ型胶原酶和Liberase酶消化。不同的操作方式导致提取免疫细胞的数量和质量参差不齐,并且某些繁琐的程序进一步影响免疫细胞活性和抗原表位,影响脂肪组织免疫环境评估的准确性。因此,建立一套高效的、稳定的分离脂肪组织免疫细胞的方法非常必要。本研究比较了机械研磨和不同消化酶消化脂肪组织的效果,以期能最大限度地提高脂肪组织中免疫细胞的数量及活性。并通过高脂饮食建立小鼠肥胖模型,进一步分析了小鼠脂肪组织中巨噬细胞、T淋巴细胞等免疫细胞的比例及亚群变化。
1 材料与方法
1.1 材料
1.1.1 实验动物
8周龄雄性C57BL/6J小鼠购自北京维通利华公司(动物合格证号:110322211100187237),60%的高脂饲料购自上海派克生物公司。小鼠在首都医科大学附属北京友谊医院的SPF级动物设施中饲养。采用数字表法随机将小鼠分为正常饮食(normal control diet,NCD)组及高脂饮食(high fact diet,HFD)组,高脂饮食组喂养60%高脂饲料建立小鼠肥胖模型,正常饮食组喂养正常饲料作为对照。16周后吸入麻醉并处死小鼠,取附睾周围脂肪组织进行机械研磨或酶消化处理。本研究经首都医科大学附属北京友谊医院伦理委员会批准(批准编号:20-2038),符合动物伦理与福利的相关规定要求。
1.1.2 试剂与抗体
Ⅱ型胶原酶、Ⅳ型胶原酶和Liberase酶(包括嗜热菌蛋白酶低、中、高含量)购自Sigma公司(美国);DNA酶Ⅰ (DNase Ⅰ)购自Roche公司(德国);无钙镁的DPBS (1×)购自Corning公司(美国)。抗小鼠的CD3、CD4、CD8、NK1.1、CD45、F4/80、CD11b、CD11C、CD206、髓样细胞表达激发受体1(triggering receptor expressed on myeloid cells 1,TREM1)、TNF-α、干扰素-γ(interferon-γ,IFN-γ)、Foxp3荧光抗体购自BioLegend公司(美国);7AAD试剂盒购自BD Pharmingen公司(美国)。组织匀浆仪(Gentle MACSTM)和匀浆管(Gentle-MACSTMC)购自美天旎公司(德国)。流式细胞仪(FACS Aria Ⅱ)购自BD公司(美国)。
1.2 方法
1.2.1 机械研磨分离脂肪组织免疫细胞
①在深度麻醉下,切取C57BL/6J雄性小鼠附睾周围脂肪组织,小心地移到有盖培养皿中。②将脂肪组织剪碎成小团块状,直径小于1 mm,并进一步在70 μm的滤网上研磨过滤。③将过滤后的细胞悬液,50 g,4 ℃,离心5 min,去除沉淀。取上清,500 g,4 ℃,继续离心 5 min。④将上述细胞沉淀用含0.5%(质量分数)牛血清白蛋白(bovine serum albumin, BSA)的杜氏磷酸缓冲液(Dulbecco’s phosphate buffered saline, DPBS)重悬洗涤两次。上述过程全程在冰上操作,最后用含0.5%(质量分数)BSA的DPBS重悬进行细胞计数检测。
1.2.2 体外酶消化法分离脂肪组织免疫细胞
①在深度麻醉下,切取C57BL/6J雄性小鼠附睾周围脂肪组织,小心地移到有盖培养皿中。②将脂肪组织剪碎成小团块状,直径小于1 mm,用5 mL消化酶将脂肪组织重悬于组织匀浆管中。③将上述悬液在组织匀浆仪中按脂肪组织消化的程序匀浆两次。37 ℃,孵育30 min。之后在组织匀浆仪中继续匀浆两次。④加入10 mL含2%(体积分数)血清的DPBS终止消化,将悬液在70 μm的滤网上过滤,弃掉滤出的脂肪残渣。⑤将过滤后的细胞悬液50 g,4 ℃,离心5 min。去除沉淀,取上清,500 g,4 ℃,继续离心5 min。⑥将上述细胞沉淀用含0.5%(质量分数)BSA的DPBS重悬洗涤两次。上述过程除酶消化步骤外,全程在冰上操作,最后用含0.5%(质量分数)BSA的DPBS重悬进行细胞计数检测。
Liberase酶消化液:1 mg/mL BSA,0.2 mg/mL的Liberase,0.001%(质量分数)的DNA酶;Ⅱ型胶原酶消化液:1 mg/mL BSA,1.0 mg/mL的Ⅱ型胶原酶, 0.001%(质量分数)的DNA酶;Ⅳ型胶原酶消化液:1 mg/mL BSA,0.1 mg/mL的Ⅳ型胶原酶,0.001%(质量分数)的DNA酶。
1.2.3 流式细胞仪分析检测
所有细胞样本均用含0.5%(质量分数)BSA的DPBS重悬,细胞进行荧光染色后在流式细胞仪上进行检测。流式数据用FlowJo_v10.7.1版软件(Treestar)进行统计分析。具体染色方案如下。巨噬细胞:CD45+7AAD-F4/80+CD11b+Ly6G-;中性粒细胞:CD45+7AAD-CD11b+Ly6G-;M1型巨噬细胞:CD45+7AAD-F4/80+CD11b+Ly6G-CD11C+CD206-;M2型巨噬细胞:CD45+7AAD-F4/80+CD11b+Ly6G-CD11C-CD206+;CD4 T细胞:CD45+7AAD-CD3+NK1.1-CD4+CD8-;CD8 T细胞:CD45+7AAD-CD3+NK1.1-CD4-CD8+;双阴性T细胞(double negative T cell,DN T):CD45+7AAD-CD3+NK1.1-CD4-CD8-;Th1细胞:CD45+7AAD-CD3+NK1.1-CD4+CD8-IFNγ+;调节性T细胞(Treg细胞):CD45+7AAD-CD3+NK1.1-CD4+CD8-Foxp3+。
1.3 统计学方法

2 结果
2.1 机械研磨和不同酶消化对脂肪组织免疫细胞活性及获取量的影响的比较
机械研磨、Ⅱ型胶原酶、Ⅳ型胶原酶、Liberase酶消化4种方式所获得的CD45+的免疫细胞7AAD阴性的细胞为活细胞。如图1所示,上述4种消化方式,所获得的细胞的死亡率依次为30.7%±3.73%,9.71%±1.01%,14.3%±2.11%和6.43%±1.23%。其中机械研磨对免疫细胞造成的损伤最大,死亡细胞比例最高;Ⅱ型胶原酶和Liberase酶消化的方式对免疫细胞造成的损伤较小,死亡细胞比例最低。各组之间死亡细胞比例差异均有统计学意义(P<0.05)。
每只小鼠的附睾周围脂肪组织中,通过上述4种消化方式能获得的有活性的CD45+的免疫细胞数量如图1所示,上述4种消化方式所能获得的7AAD-CD45+的免疫细胞数依次为0.55×105±0.12×105、1.12×105±0.11×105、0.80×105±0.15×105、1.35×105±0.13×105。其中机械研磨所获得的免疫细胞数最少,Ⅱ型胶原酶消化和Liberase酶消化所获得的免疫细胞数最多。各组间比较差异有统计学意义(P<0.01)。

图1 比较机械研磨和不同酶消化的方式所能获得的脂肪组织免疫细胞的数量及活性Fig.1 Comparison of the number and activity of adipose tissue immune cells obtained by mechanical grinding and different enzymatic digestion methodsA: a typical flow gating process for detecting the activity of immune cells in adipose tissue; B: Survival of CD45+ immune cells in adipose tissue was detected by 7AAD staining under mechanical grinding and different enzymatic digestion methods; C: statistical analysis of the mortality of CD45+ immune cells obtained in different ways; D: statistical analysis of the number of immune cells that obtain active CD45+ in different ways; *P<0.05; **P<0.01.
2.2 Liberase酶消化和Ⅱ型胶原酶消化的最佳作用条件的优化
分别应用嗜热菌蛋白酶低、中及高含量的Liberase,消化脂肪组织,免疫细胞死亡率分别为11.8%±1.23%、7.76%±1.13%、5.17%±0.67%,嗜热菌蛋白酶含量越高,对CD45+免疫细胞的损伤越小,其死亡率也越低,各组间比较差异有统计学意义(P<0.01)。
用不同浓度的 Ⅱ 型胶原酶(0.5、1.0、2.0 mg/mL)对脂肪组织进行消化。CD45+免疫细胞死亡率分别为8.21%±1.01%、12.7%±1.41%、20.8%±2.03%,各组间比较差异有统计学意义(P<0.01)。随着Ⅱ型胶原酶浓度的增加,免疫细胞的死亡率增加,0.5 mg/mL的Ⅱ型胶原酶造成的CD45+免疫细胞的死亡率最低。
将作用条件优化后的Liberase及Ⅱ型胶原酶进行比较,嗜热菌蛋白酶高含量的Liberase消化后的免疫细胞死亡率要比0.5 mg/mL的Ⅱ型胶原酶消化后的免疫细胞死亡率低,差异有统计学意义(P<0.01)。结果详见图2。

图2 不同作用条件的Liberase及Ⅱ型胶原酶消化对脂肪组织免疫细胞存活的影响Fig.2 Effect of Liberase and type Ⅱ collagenase digestion under different conditions on the survival of adipose tissue immune cellsA: a typical flow chart of digesting adipose tissue with Liberase containing different amounts of thermolysin and different concentrations of type Ⅱ collagenase, affecting the survival of immune cells; B: statistical analysis of digesting adipose tissue with Liberase of different enzyme content and type Ⅱ collagenase of different concentration, affecting the survival of immune cells; ** P<0.01.
2.3 肥胖过程中,脂肪组织中巨噬细胞的促炎作用明显增强
C57BL/6J小鼠喂养高脂饲料16周后,小鼠的体质量明显增加,并伴随有胰岛素抵抗的发生(图3A,B)。同时肥胖小鼠脂肪组织中,免疫细胞的浸润明显增加(图3C)。利用上述优化的脂肪组织消化方案,对脂肪组织中的固有免疫细胞亚群,特别是中性粒细胞和巨噬细胞亚群进行检测,结果显示,HFD饮食诱导的肥胖小鼠脂肪组织中中性粒细胞的比例(1.46×105±0.36×105)较(图3D)正常组(0.52×105±0.13×105)增加(P<0.01)。
肥胖小鼠中,脂肪组织巨噬细胞的比例明显增加,占CD45+免疫细胞的比例,正常组为17.1%±2.34%,HFD诱导的肥胖组为26.0%±4.51%(P<0.01)。巨噬细胞中主要是M1型巨噬细胞(CD11C+CD206-)的比例明显增加,而M2型巨噬细胞(CD11C-CD206+)的比例明显降低(图3E、F)。肥胖小鼠脂肪组织中分泌TNF-α的巨噬细胞比例明显增加,其中正常组为5.55%±1.13%,HFD诱发的肥胖组为14.9%±3.13%(P<0.01)。同时,肥胖小鼠的脂肪组织中TREM1+巨噬细胞的比例明显增加,其中正常组为24.0%±3.85%,HFD诱发的肥胖组为50.4%±5.34%(图3G~H)。

图3 高脂饮食诱导的肥胖小鼠脂肪组织中巨噬细胞比例及促炎作用的分析Fig.3 Analysis of the proportion of macrophages and their pro-inflammatory effects in adipose tissue of obese HFD miceA: The body weight changes of mice fed with normal diet and HFD for 16 weeks. B: The glucose tolerance test (GTT) showed that the insulin resistance level of high-fat diet mice was significantly higher than that of normal diet mice after 16 weeks of feeding mice with different diets. C: It was confirmed by hematoxylin-eosin staining that the number of inflammatory cells infiltrated in adipose tissue of obese mice was significantly higher than that of normal mice. D: It was confirmed by flow cytometry that the proportion of CD11b+Ly6G+ neutrophils in the adipose tissue of obese mice to CD45+ immune cells was significantly higher than that of normal diet mice. E,F: It was confirmed by flow cytometry that the proportion of macrophages and M1 type macrophages in adipose tissue of obese mice was significantly higher than that of normal mouse adipose tissue, while the proportion of M2 type macrophages was significantly reduced. G,H: Compared with normal diet mice, the ability of macrophages in adipose tissue of obese mice to secrete TNF-α and the expression of TREM1 were significantly increased. *P<0.05; **P<0.01; HFD: high-fat diet; NCD: normal control diet; TNF-α: tumor necrosis factor-α; TREM1: triggering receptor expressed on myeloid cells 1.
2.4 肥胖过程中,脂肪组织中促炎T细胞的比例明显增加
检测NCD小鼠及HFD小鼠中适应性免疫细胞比例,结果显示,HFD组CD3 T淋巴细胞占CD45+免疫细胞的比例(NCD组:38.3±2.31%;HFD组:47.5%±3.29%),特别是CD8 T细胞的比例(NCD组:6.72±2.28%;HFD组:16.8%±3.31%),明显增加;而NK细胞(NCD组:11.6%±2.32%;HFD组:6.31%±1.35%)及双阴性T细胞(DN T,NCD组:14.0%±1.21%;HFD组:8.33%±1.30%)的比例均有明显的降低(图4A~C)(P<0.01)。
在小鼠肥胖过程中,Th1细胞占CD4 T细胞的比例明显增加(NCD组:7.02%±1.35%;HFD组:12.3%±2.35%,P<0.01),而Treg细胞占CD4T细胞的比例有一定程度的降低(NCD组:7.21%±1.35%;HFD组:6.02%±1.15%)。同时,与NCD小鼠相比,HFD小鼠脂肪组织中Th1与Treg的比值也明显增加(Th1/Treg:2.18±0.56,P<0.01)(图4D~F)。
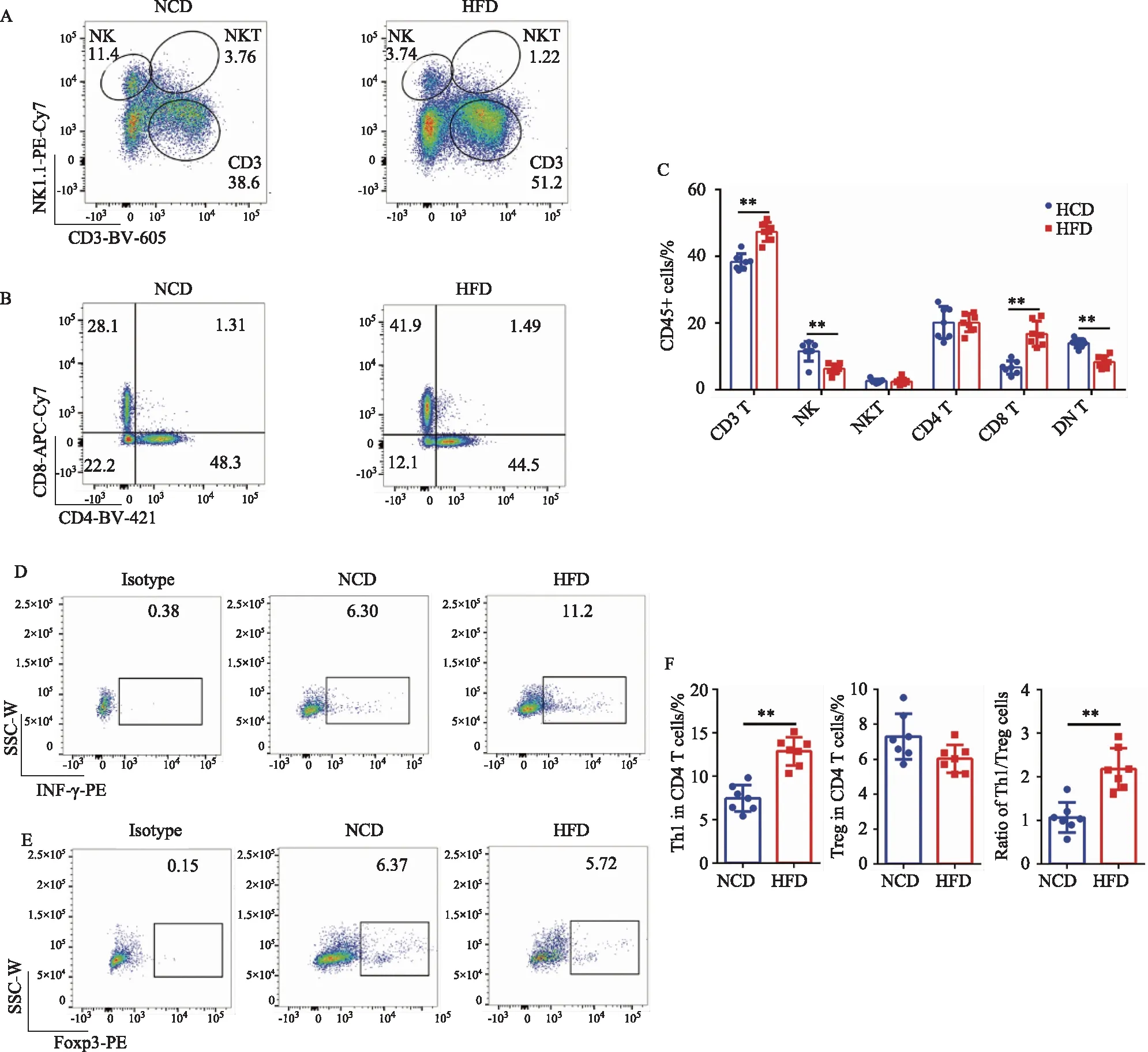
图4 高脂饮食诱导的肥胖小鼠脂肪组织中T淋巴细胞比例及促炎作用的分析Fig.4 Analysis of the proportion and pro-inflammatory effects of T lymphocytes in adipose tissue of obese mice induced by high-fat diet A-C: typical graphs and statistical analysis of the proportion of T lymphocytes, NK cells and NKT cells in CD45+ immune cells in the adipose tissue of mice on normal diet and high-fat diet by flow cytometry; D-F: typical graphs and statistical analysis of the proportion of Th1 and Treg cells in the adipose tissue of mice on normal diet and high-fat diet by flow cytometry; HFD: high-fat diet; NCD: normal control diet; NK: natural killer cell; IFN-γ: interferon-γ; NKT: natural kill T cell; DN T: double negative T cell; *P<0.05; **P<0.01.
3 讨论
肥胖是一种代谢性疾病,同时也是一种慢性炎症疾病。探讨脂肪组织中免疫细胞的比例及炎症状态,对于深入了解肥胖及胰岛素抵抗的免疫调节机制具有重要意义。本研究试图提供一种高效、低损伤的分离检测脂肪组织免疫细胞的方式,以期为脂肪组织内炎症反应的研究提供技术支持。
目前,关于脂肪组织中免疫细胞分离的技术主要有两类:机械研磨法和酶消化法。机械研磨法简单、快速、费用低。但通过机械研磨法得到细胞的活力显著低于酶消化法,且机械分离得到的免疫细胞亚群往往缺乏CD34表达[3]。胶原酶是酶消化法中最常用的酶类,其具有独特的水解天然胶原蛋白的能力,可消化脂肪、肝脏等组织中的细胞外基质,被广泛应用于动物组织中细胞的分离[4]。早期,胶原酶主要用于分离脂肪组织中的脂肪细胞及脂肪前体细胞,并用于脂肪细胞代谢的研究[5]。随着流式细胞检测技术的发展,通过胶原酶消化的方式,分离脂肪组织中的免疫细胞,并对其亚群、比例进行流式检测也愈发普遍。有文献[6-8]显示,以胶原酶为基础的酶消化方式获得有核细胞的效率要明显高于机械研磨的方式。而本研究也比较了机械研磨和酶消化对脂肪组织免疫细胞的获取量及免疫细胞活性的影响,与之前报道[6-8]一致,与机械研磨相比,胶原酶消化能获得脂肪组织免疫细胞的产量更高,对免疫细胞损伤更低,活性也更好。
目前常用于酶消化的胶原酶类,主要包括Ⅱ型胶原酶、Ⅳ型胶原酶及Liberase等。其中Ⅱ型胶原酶常用于脂肪细胞的消化分离[9-11],Ⅳ型胶原酶常用于胎盘组织[12]、肝脏组织[13]等的消化分离。Liberase主要是将高度纯化的胶原酶Ⅰ、胶原酶Ⅱ和嗜热菌蛋白酶按精确比例混合,从而达到高效的解离原代组织的目的,常用于皮肤组织、脂肪组织的消化[14]。而本结果也显示,Liberase酶能有效地提高脂肪组织免疫细胞的获得率,且对免疫细胞的损伤最低。嗜热菌蛋白酶是Liberase酶类的主要成分之一,是一种非梭菌中性蛋白酶,其能够快速水解疏水性强的氨基酸,具有分离产量高、分离得到的细胞活力强等特点[15]。Liberase 酶类根据其中嗜热菌蛋白酶含量的不同,又可分为低含量、中含量及高含量3种。笔者发现,随着嗜热菌蛋白酶含量的增加,脂肪组织免疫细胞的获得率增高,所获得免疫细胞的活性增强,说明嗜热菌蛋白酶在脂肪组织免疫细胞的消化分离中发挥着关键作用。同时本的结果也提示,嗜热菌蛋白酶高含量的Liberase是最佳的消化分离脂肪组织中免疫细胞的酶类。
脂肪组织的炎症反应是诱发肥胖及胰岛素抵抗的核心[16]。其中的巨噬细胞是调控脂肪组织炎症反应的主要免疫细胞,可分为M1、M2两种类型。M1型巨噬细胞主要分泌促炎因子TNF-α、IL-1β、IL-6、IL-12等,也能通过激活一氧化氮合酶产生活性氧及一氧化氮,加重脂肪组织炎症反应[17]。而M2型巨噬细胞主要分泌抑炎因子IL-10,并通过分泌趋化因子CCL22,趋化Treg细胞向脂肪组织募集,从而起到抑制脂肪组织炎症反应的作用[18]。本研究证实,肥胖过程中巨噬细胞比例增加,主要是促炎的M1型巨噬细胞的比例明显上调,而M2型巨噬细胞比例明显下调,这也可能是诱发脂肪组织炎症反应的重要原因之一。TREM1是表达于单核巨噬细胞膜表面的受体蛋白,其能招募巨噬细胞及中性粒细胞至炎症部位,亦能促进巨噬细胞分泌IL-1β、IL-6、CCL2等炎性因子,级联放大组织中的炎症反应[19]。本研究也证实,肥胖过程中脂肪组织TREM1+的巨噬细胞比例明显增加,而这有可能是诱发脂肪组织炎症反应的另一重要因素。
脂肪组织巨噬细胞的活化能分泌大量趋化因子促进T淋巴细胞向炎症部位募集。不同的T淋巴细胞亚群在脂肪组织炎症反应中发挥不同的调节作用。其中Th1细胞分泌的IFN-γ也能促进巨噬细胞在脂肪组织中的募集活化,加重脂肪组织中的炎症反应[20]。而Treg细胞,作为一种调节性T细胞,可抑制CD4、CD8 T细胞的活化增殖,炎性因子分泌及细胞毒性等,发挥抗炎作用,也能增加脂肪细胞对胰岛素的敏感性,提高脂肪细胞葡萄糖的摄入量[21]。由此可见,Th1及Treg细胞的比例及促炎、抑炎的平衡,在调控脂肪组织炎症及肥胖过程功能中也发挥着重要作用。而本研究也显示,在肥胖过程中,脂肪组织中Th1细胞的比例明显增加,而Treg细胞的比例有一定程度降低,其中Th1与Treg细胞的比值增加最为明显。这进一步证实,肥胖过程中Th1与Treg促炎抑炎的失衡,也是导致脂肪组织炎症反应的重要原因之一。
总之,通过此研究,建立了一套以嗜热菌蛋白酶含量较高的Liberase为核心的高效消化分离脂肪组织免疫细胞的方法,此方法获得的脂肪组织免疫细胞数量较多,且免疫细胞活性较高。通过此方法,进一步检测了肥胖过程中,脂肪组织免疫细胞亚群的变化。笔者发现巨噬细胞及T淋巴细胞在脂肪组织中的促炎作用明显增强,这可能是导致脂肪组织炎症,诱发肥胖发病的关键因素。通过此研究,希望能为深入探索肥胖及胰岛素抵抗中的免疫学发病机制提供研究基础及技术支持。
