Rac 3通过MAGEA6/AMPKα途径抑制肺腺癌A549细胞的自噬
2021-07-31杜天宇肖旭阳
杜天宇,肖旭阳
(锦州医科大学附属第一医院,辽宁 锦州 121000)
肺癌目前是我国最常见的恶性肿瘤,在中国每年肺癌新发病例73.33万人,死亡病例61.02万人,居恶性肿瘤发病率及死亡率的首位[1]。随着人们体检意识增强,肺腺癌的检出率、发病率逐渐提升,因此肺腺癌的发生、发展、耐药等基础研究一直是肿瘤研究中的热点。
Rac 3是一种分子量为21 kd的小分子蛋白,属于Rac家族成员,该家族被认为是细胞骨架的重要调节因子,在神经发育及肿瘤中起到重要作用[2]。Rac 3在肺癌中表达增高,沉默Rac 3后影响肺腺癌A549细胞的侵袭、迁移、上皮间质转化,抑制增殖并促进凋亡[3-5]。自噬是一种高度保守的生物学过程,在肿瘤生存条件恶劣时可以提供必要的养分供细胞生存,而另一方面自噬可诱导凋亡,进而导致肿瘤细胞的死亡。Rac 3能在多种细胞系内引起自噬[6],但是探讨Rac 3对肺癌自噬影响的研究较少,相关机制仍不明确。
CRISPR/cas9是一种新兴的基因编辑技术,在小向导RNA(small guide RNA,sgRNA)的作用下可以切断DNA双链,并在基因组受损修复过程中发生移码突变,从而达到敲除基因的效果[7]。本研究使用CRISPR/cas9技术,敲除肺腺癌A549细胞中的Rac 3基因并构建稳定表达的细胞系,并建立Rac 3过表达细胞株,探讨Rac 3对肺腺癌自噬的影响及机制。
1 材料与方法
1.1 细胞培养和主要试剂
1.1.1 细胞培养:肺腺癌细胞系A549购自中科院细胞库,用含10%胎牛血清的RPMI-1640,于37 ℃、5% CO2的恒温恒湿培养箱内进行培养。
1.1.2 主要试剂:Addgene购买质粒pSpCas9(BB)-2A-Puro (PX459,Plasmid #48139),Rac 3抗体够自ABCam,SQSTM-1/p62、AMPKα购自万类生物,LC3、Phospho-AMPKα、ERK 1/2、Phospho-ERK 1/2购自CST,AKT、Phospho-AKT、MAGEA6购自ProteinTech。
1.2 puro-cas9-Rac 3-sgRNA质粒的构建
1.2.1 sgRNA的设计与合成:通过在线工具(https://zlab.bio/guide-design-resources)设计2条sgRNA,分别位于第2、3外显子,序列分别为:sgRNA1#:5’-CGGTGGGGATGTACTCTCCG-3’和sgRNA2#:5’-CGGGTCAGGAGGACTACGAT-3’。sgRNA的正义链及反义链由Takara公司合成,收到的2对寡核苷酸链常规退火。
1.2.2 sgRNA载体构建:PX459质粒使用BbsI酶37 ℃酶切1 h,T4连接酶16 ℃过夜连接,导入到感受态细胞DH5α凃板,挑菌提取质粒,BbsI酶切后产物进行琼脂糖凝胶电泳,选取不含酶切位点的质粒送碱基测序验证。
1.3 Rac 3敲除及过表达A549细胞株的建立
1.3.1 敲除质粒转染及单克隆提取:质粒使用Lipofectamine 3000试剂进行转染,用筛选培养基(嘌呤霉素浓度1 μg/mL)筛选72 h后转为维持浓度继续培养,镜下观察单个细胞形成约含50个细胞的细胞集落时,消化稀释细胞浓度至0.5个/微升,按2 微升/孔接种到96孔板内,标记出单个细胞的孔并加培养基继续培养,约7 d后对标记的单克隆消化、扩大培养及鉴定。
1.3.2 Rac 3敲除细胞株的鉴定:根据sgRNA位置设计PCR引物,分别为:sgRNA1#(5’-CTTAGGTCGCCACGGATCTG-3’,5’-CTAGAACTCTGGCCAGCACC-3’)和sgRNA2#(5’-GGTGCTGGCCAGAGTTCTA-3’,5’-GGCTCACCAGAGAGAAGCAG-3’)。PCR产物使用T7EI酶于37 ℃反应20 min后进行琼脂糖凝胶电泳,选取存在编辑的样本送生物公司测序。
1.3.3 Rac 3过表达慢病毒感染A549细胞:Rac 3过表达慢病毒HBLV-h-RAC3-3xflag-NEO由上海汉恒公司包装,A549细胞接种于96孔板,向孔内加入慢病毒,随后用含G418培养基(800 μg/mL)进行筛选,72 h后降至维持浓度并扩大培养。
1.4 EBSS饥饿法诱导自噬
待检测细胞按每个平皿按照1×106接种入10 cm培养皿中,至细胞融合约70%时弃液,PBS清洗2次后加入EBSS 10 mL,于37 ℃ 5%CO2的孵箱内,培育4 h后提取蛋白进行鉴定。
1.5 Western Blot检测蛋白表达
待检测的各细胞株在细胞融合至约70%时,用含PMSF及磷酸酶抑制剂的RIPA细胞裂解液提取蛋白,并采用BCA法进行定量。各组进行SDS-PAGE电泳后将蛋白转移至PVDF膜上,5%BSA封闭,4 ℃摇床过夜孵育一抗,二抗室温孵育,ECL化学发光法进行显影。
1.6 统计学分析
采用GraphPad Prism 7.0软件进行统计学分析,采用t检验进行比较,以P<0.05为差异有统计学意义。
2 结 果
2.1 sgRNA的设计
从NCBI获得人源Rac 3蛋白的cDNA,使用在线工具分别于第2、3外显子上设计sgRNA1#和sgRNA2#,确保当基因编辑导致移码突变时,所有的Rac 3转录本都不能正确翻译,以达到敲除的效果,见图1。

图1 通过在线工具设计sgRNA序列
2.2 Rac 3敲除的验证
将含有puro-cas9-sgRNA1#和puro-cas9-sgRNA2#的质粒转染入A549细胞中,单克隆筛选后进行T7E1酶切实验。由sgRNA1#、sgRNA2#介导的Rac 3敲除细胞株分别记为KO1、KO2。T7E1酶切实验中KO1和KO2细胞株的PCR产物都被切成了大小不同的两条带,证实基因组DNA存在错配,即两种sgRNA都对基因组DNA进行了编辑。将发生基因编辑的KO1和KO2细胞株送测序,提示KO1存在2个碱基丢失,KO2存在35个碱基丢失,均达到移码突变的效果,见图2。
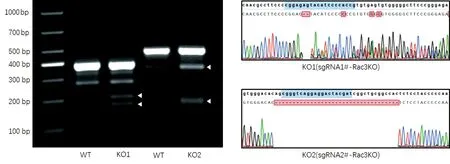
图2 T7E1酶切实验及Sanger测序验证Rac 3基因编辑
2.3 Western Blot验证Rac 3的敲除及过表达
对KO1、KO2两珠Rac 3敲除细胞株及慢病毒过表达Rac 3细胞株(OE)提取蛋白进行Western Blot检测,提示与野生型A549细胞(WT)相比,KO1、KO2细胞株的中Rac 3蛋白被完全敲除了,OE细胞株表达Rac 3-3xflag,且Rac 3表达水平明显高于WT组,见图3。

**P<0.01
2.4 EBSS诱导自噬后LC3、SQSTM-1/p62的表达
经过EBSS诱导自噬4 h后提取蛋白。与未诱导的WT组A549细胞相比,EBSS诱导后各细胞株的LC3 II及LC3 II/I的比值升高。EBSS诱导后,KO1和KO2两组的LC3 II、LC3 II/I比值均高于WT组,SQSTM-1/p62低于WT组,OE组的LC3 II、LC3 II/I比值低于WT型,差异均具有统计学意义。提示在肺腺癌A549细胞中,Rac 3敲除后自噬被激活,Rac 3过表达自噬受到抑制,见图4。

*P<0.05;**P<0.01
2.5 双向调控Rac 3后相关蛋白表达的变化
EBSS诱导自噬后,对各组进行Western Blot检测活化的caspase3、MAGEA6、AKT及其磷酸化蛋白、ERK 1/2及其磷酸化蛋白、AMPK及磷酸化蛋白的变化。在Rac 3敲除后,MAGEA6表达下降,AMPKα及磷酸化AMPKα的表达增强,caspase3活化增强;在Rac 3过表达后,MAGEA6表达升高,AMPKα及磷酸化AMPKα表达降低,caspase3活化减弱。Rac 3表达出现变化后AKT和ERK1/2变化不显著。提示EBSS诱导自噬,Rac 3敲除可以促进凋亡,并且降低MAGEA6的表达,促进AMPKα的表达及磷酸化水平,进而促进细胞自噬,而Rac 3过表达则相反,见图5。

*P<0.05;**P<0.01
3 讨 论
本研究通过CRISPR/cas9技术敲除肺腺癌细胞系A549中的Rac 3基因,使用慢病毒感染的方法过表达了A549细胞中的Rac 3基因,再以EBSS诱导自噬的方法,确定了Rac 3抑制A549细胞的自噬,并初步明确了Rac 3是通过MAGEA6/AMPKα途径影响肺腺癌自噬。簇状规则间隔的短回文重复序列(CRISPR)是一种广泛存在于微生物内的适应性免疫系统,在进行工程化后的CRISPR/cas9技术具有快速、低成本、高效、拓展性高等特点[7]。CRISPR/cas9技术是通过设计sgRNA引导cas9蛋白靶向切割基因组DNA达到DNA双链断裂,随后细胞以非同源末端连接的方式修复基因组DNA,在这一过程中有概率发生碱基的插入或丢失并导致移码突变,从而达到敲除基因的效果[8]。sgRNA序列通常为在线工具所设计,因存在与其他基因相似序列结合的可能,故CRISPR/cas9基因编辑存在脱靶的风险并导致实验结论的错误[9]。本研究通过设计两个位于不同外显子的sgRNA,并设立过表达组来减少该类误差。
Rac 3是小分子GTPase,这类蛋白常在细胞中起到分子开关的作用,目前已知其在肿瘤及神经发育中起到重要作用。既往的研究表明,在膀胱癌中Rac 3通过PYCR1/JAK/STAT通路促进增殖、迁移和侵袭性[10],在肺癌中沉默Rac 3能抑制细胞增殖及诱导细胞凋亡[4]3061-3065,并且Rac 3可以通过p38 MAPK途径调节细胞迁移、侵袭和EMT[3]2511-2522,在乳腺癌中沉默Rac 3导致侵袭性减少[11],Rac 3过表达诱导促生长和促迁移的基因,并且提示ERα阳性乳腺癌预后不良[12]。Rac 3在结肠癌中可以维持和诱导肿瘤细胞干性,并可以诱导非肿瘤细胞向肿瘤转化[13]。Rac 3还可以增强宫颈癌细胞对顺铂的耐药[14]。自噬是目前的一个研究热点,在肿瘤细胞中自噬既可以保护肿瘤生存,同时也可以促进凋亡,而Rac 3被发现在多种细胞系中可以抑制自噬[6]35291-35298。我们研究发现在A549细胞中敲除Rac 3可以促进LC3 I型向II型转化、p62积累水平降低及促进caspase3活化,而相反的过表达Rac 3抑制LC3 I型向II型转化并抑制caspase3活化。这提示Rac 3对肺腺癌的自噬及凋亡起抑制的作用。在前期的预实验中,我们对Rac 3敲除及过表达的细胞株做了RNA-Seq,筛选得到4个差异基因ADAMTS2、GABRA3、MAGEA6及CSRNP3,通过预实验验证及查询文献,我们推测Rac 3对自噬的抑制与MAGEA6基因有关。
MAGEA6是黑色素瘤抗原家族的成员,该家族成员在真核生物中保守,在肿瘤中常被异常激活。MAGEA6沉默在胶质瘤、肾细胞癌等多种肿瘤中直接上调AMPKα表达及磷酸化并抑制mTORC1通路[15-16]。MAGEA3/6可以特异性的结合TRIM28 E3泛素连接酶,导致AMPKα的泛素化降解[17]。在我们的研究中观察到,当Rac 3敲除后MAGEA6表达随之降低,这导致了AMPKα泛素化降解的减少,AMPKα及其磷酸化水平的增高。AMPKα磷酸化水平增高会抑制mTORC1的活性,从而解除了mTOR通路对自噬的抑制,导致自噬的增强[18-19]。当过表达Rac 3后,MAGEA6表达随之升高,这导致AMPKα降解的增加及活性降低,从而导致mTOR通路被激活,抑制自噬。在肺癌等多种肿瘤中,Rac 3表达水平上升,这也就导致MAGEA6的高表达,进而抑制AMPKα并激活mTOR通路,导致自噬被抑制,从而达到减少凋亡、促进细胞成活的目的。但是Rac 3是如何调控MAGEA6的机制目前尚不确认,有待于进一步研究。
综上所述,我们发现Rac 3可以上调MAGEA6的表达水平,抑制AMPKα表达及活性,激活mTOR信号通路,抑制自噬及凋亡,从而达到使肺腺癌细胞成活的目的。这提示Rac 3在肺腺癌中起到重要作用,可能会为肺癌的治疗提供新的靶标。
