氯喹对脂多糖诱导的Ⅱ型肺泡细胞损伤的影响
2021-07-30朱莹莹张姣姣孙俊楠王海嵘
朱莹莹,张姣姣,孙俊楠,王海嵘
(上海交通大学医学院附属新华医院急诊医学科,上海 200092)
脓毒症是宿主对感染的反应紊乱所致威胁生命的器官功能障碍[1]。急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是脓毒症中常见的器官功能障碍。研究表明,肺泡损伤是ARDS的主要机制之一[2-3]。尸检发现,临床诊断为中重度ARDS的患者中有40%~58%存在弥漫性肺泡损伤[4]。哺乳动物的肺泡上皮分为Ⅰ型和Ⅱ型2种,其中Ⅱ型肺泡(alveolar typeⅡ,AT2)细胞占大多数,AT2细胞呈立方形,可以合成并分泌肺泡表面活性物质,调节肺泡表面张力,保证在呼吸过程中肺泡的适当充盈和收缩。此外,AT2细胞还具有干细胞特性,可以增殖并转化为AT1细胞[5-6],有助于修复肺泡上皮。
氯喹(chloroquine,CQ)是一种4-氨基喹啉药物,不仅广泛用于预防和治疗疟疾,还可用于治疗类风湿关节炎、系统性红斑狼疮等自身免疫性疾病以及癌症[7-8]。有研究发现CQ可减轻H5N1病毒感染和出血性坏死性胰腺炎导致的ARDS[9-10],但CQ对脓毒症中ARDS的影响尚不明确。
磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/Akt信号通路是细胞内至关重要的信号转导途径之一。PI3K/Akt信号通路对细胞增殖、细胞凋亡、血管形成等多种细胞活动均有调节作用,进而影响癌症[11]、多发性骨髓瘤[12]等多种疾病。
本课题组前期研究发现,CQ可以通过激活PI3K/Akt信号通路以抑制脂多糖(lipopolysaccharide,LPS)诱导的人脐静脉内皮细胞凋亡[13-14],但CQ对脓毒症所致的AT2细胞损伤是否也有保护作用尚不明确。本研究旨在探究CQ是否能缓解LPS诱导的AT2细胞损伤,以及PI3K/Akt信号通路在其中的作用。
材料与方法
一、主要材料
AT2细胞株为实验室保存,购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。磷酸CQ购自美国Cell Signaling Technology公司,LPS来源大肠杆菌(Escherichia coli)血清型O55:B5购自美国Sigma-Aldrich公司;细胞计数试剂盒-8(cell counting kit-8,CCK-8)为上海翊圣生物科技有限公司产品;一抗为β-肌动蛋白(β-actin)(美国abcam)、β-微管蛋白(β-tubulin)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Bcl-2、Bax、Akt、磷酸化Akt(p-Akt)、辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗小鼠抗体(武汉爱博泰克生物科技有限公司)、HRP标记山羊抗兔抗体(上海莱兹生物科技有限公司)、裂解的胱天蛋白酶3(美国Cell Signaling Technology公司);PI3K抑 制剂LY294002购自 上海碧云天生物技术有限公司。
二、方法
1.药物浓度筛选:取对数生长期的AT2细胞配制成1×104/mL的细胞悬液,以每孔100μL均匀铺于96孔板。分别向各孔加入1、10和50 mg/L的LPS处 理AT2细 胞24 h或0.5、5、10、25、50、100μmol/L CQ处理AT2细胞4 h。弃去96孔板原有培养基,每孔加入100μL新鲜配制含10%CCK-8试剂的完全培养基,放回培养箱。2 h后取出,用酶标仪检测各孔450 nm波长的A值,并计算细胞活力。细胞活力=(实验组A值-空白组A值)/(对照组A值-空白组A值)。
2.细胞分组:取处于对数生长期的AT2细胞进行实验,用含10%胎牛血清、1%青链霉素混合液和89%DMEM高糖培养基的完全培养基培养AT2细胞。将细胞分为正常对照组(完全培养基)、LPS处理组(单加LPS)、CQ处理组(单加CQ)和LPS+CQ组(加入LPS和CQ共处理)4组;后增加LPS+CQ+LY294002组(加 入LPS、CQ和LY294002共处理)。
3.CCK-8法检测细胞活力:取对数生长期的AT2细胞铺在96孔板中,每孔10 000个细胞,用100μL完全培养基培养。待细胞贴壁后,按上述实验分组分别加入药物作用24 h。吸出孔中原有培养基,加入新鲜含10% CCK-8试剂的完全培养基,每孔100μL。在CO2恒温培养箱中培养2 h后取出,用酶标仪检测450 nm波长的A值,并计算细胞活力,计算方法同上。
4.蛋白质印迹法(Western blotting)检测蛋白表达:将AT2细胞均匀接种在6孔板中,当孔中细胞融合至约70%时,更换为不含血清的DMEM高糖培养基培养12 h,后按上述分组处理细胞。24 h后弃去原有培养基,用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗2次,加入含蛋白酶抑制剂和磷酸酶抑制剂的放射免疫沉淀实验(radioimmunoprecipitation assay,RIPA)裂解液于冰上反应30 min,13 523×g,4℃离心15 min,收集上清,用二喹啉甲酸(bicinchoninic acid,BCA)法测浓度后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),转膜及快速封闭液室温下封闭15 min后,加入β-微管蛋白、Bcl-2、Bax、胱天蛋白酶3、裂解的胱天蛋白酶3、Akt、p-Akt抗体于4℃孵育过夜,用TBST洗涤10 min×3次,加入对应二抗室温下孵育1 h,用TBST洗涤10 min×3次后进行曝光显影。
三、统计学分析
使用SPSS 22.0软件进行数据统计分析,用Graphpad Prism 6.0进行绘制。用±s表示计量资料。采用t检验和单因素方差分析比较组间差异。P<0.05为差异有统计学意义。
结 果
一、药物对AT2细胞活力的影响
用LPS处理AT2细胞24 h后,CCK-8检测细胞活性显示,与对照组(100.00%±1.80%)相比,LPS为1 mg/L(97.03%±4.73%)、10 mg/L(97.12%±3.32%)时,AT2细胞活力无明显变化(P分别为0.366 8、0.257 9),LPS为50 mg/L(76.84%±1.40%)时,AT2细胞活力降低显著(P=0.000 6)(见图1A)。因此用50 mg/L LPS刺激细胞24 h以构建AT2细胞脓毒症细胞模型。用CQ处理AT2细胞4 h,CCK-8结果显示,与对照组(100.00%±1.07%)相比,CQ 0.5μmol/L和5μmol/L对AT2细胞活力无明显影响(分别为98.11%±1.67%、99.06%±3.19%,P分别为0.104 9、0.596 2);当CQ终浓度为10μmol/L(87.80%±1.20%),AT2细胞活力下降(P<0.000 1)(见图1B)。因此选用5μmol/L作为CQ的治疗浓度。
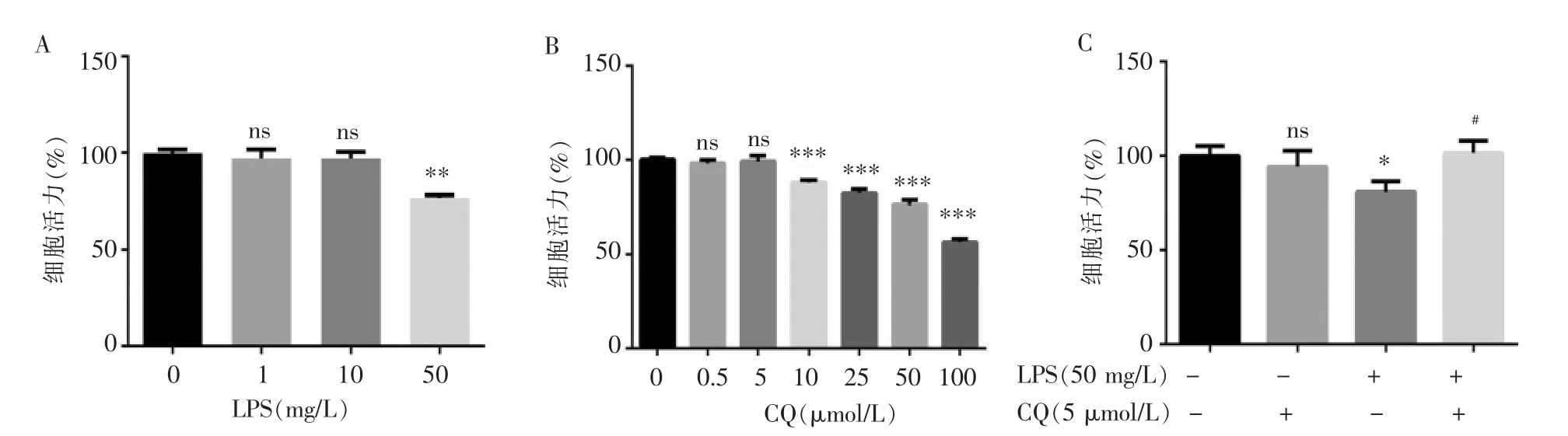
图1 LPS和CQ对AT2细胞活力的影响
二、CQ对LPS诱导所致AT2细胞损伤的影响
CCK-8检测细胞活力发现,与对照组(100.00%±2.58%)相比,LPS(80.89%±2.51%)能明显降低细胞活力(P=0.001 2);而5μmol/L CQ预处理4 h后用50 mg/L LPS处理24 h(101.6%±2.92%),细胞活力与对照组相比无明显改变,与LPS组相比明显增加(P=0.000 7),而CQ本身(94.33%±3.42%)对细胞活力无明显影响(P=0.265 3)(见图1C)。
三、CQ对AT2细胞线粒体凋亡途径的影响
用蛋白质印迹法检测线粒体凋亡相关蛋白发现,与对照组相比,LPS组裂解的胱天蛋白酶3表达增加(P<0.05),Bax蛋白水平增加,而Bcl-2表达减少,Bcl-2/Bax比值减少(P<0.05);CQ和LPS共同作用后上述蛋白和LPS组呈现相反改变,Bcl-2/Bax蛋白比值增加(P<0.05),裂解的胱天蛋白酶3表达减少(P<0.05);CQ单独作用对裂解的胱天蛋白酶3无明显作用(P>0.05),Bcl-2/Bax比值较对照组差异无统计学意义(P>0.05)(见表1、图2A、B)。
四、Akt蛋白在CQ减轻LPS诱导的AT2细胞损伤中的改变
蛋白质印迹法检测Akt蛋白的磷酸化发现,与对照组相比,LPS组中p-Akt水平减弱(P<0.05);CQ和LPS共处理组中,与LPS组相比,p-Akt增加(P<0.05)(见表1、图2C)。
表1 CQ对AT2细胞凋亡相关蛋白及Akt蛋白磷酸化水平的影响(n=3,±s,%)
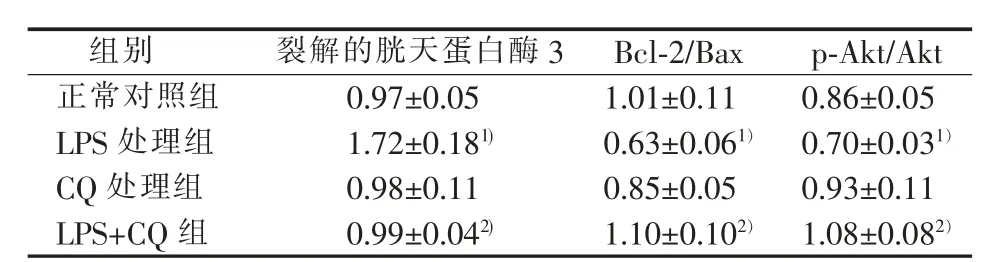
表1 CQ对AT2细胞凋亡相关蛋白及Akt蛋白磷酸化水平的影响(n=3,±s,%)
1):与正常对照组相比,P<0.05;2):与LPS处理组相比,P<0.05。
组别 裂解的胱天蛋白酶3 Bcl-2/Bax p-Akt/Akt正常对照组 0.97±0.05 1.01±0.11 0.86±0.05 LPS处理组 1.72±0.181) 0.63±0.061)0.70±0.031)CQ处理组 0.98±0.11 0.85±0.05 0.93±0.11 LPS+CQ组 0.99±0.042) 1.10±0.102)1.08±0.082)
五、PI3K/Akt信号通路在CQ减轻LPS诱导的AT2细胞损伤中的作用
与对照组相比,LPS刺激后裂解的胱天蛋白酶3表达增加(P<0.05),Bax增多,Bcl-2表达减少,Bcl-2/Bax比值减少(P<0.05);CQ和LPS共处理后凋亡相关蛋白和LPS组呈现相反改变,裂解的胱天蛋白酶3减少(P<0.05),Bcl-2/Bax比值增加(P<0.05);而加入PI3K抑制剂LY294002干扰后,裂解的胱天蛋白酶3增加(P<0.05),Bax增加,Bcl-2减少,Bcl-2/Bax比值减少(P<0.05)(见图3、表2)。
表2 PI3K/Akt通路在CQ减轻LPS诱导的AT2细胞损伤中的作用(n=3,±s,%)

表2 PI3K/Akt通路在CQ减轻LPS诱导的AT2细胞损伤中的作用(n=3,±s,%)
1):与正常对照组相比,P<0.05;2):与LPS处 理组 相 比,P<0.05;3):与LPS+CQ组相比,P<0.05。
组别 裂解的胱天蛋白酶3 Bcl-2/Bax正常对照组 0.45±0.05 0.97±0.07 LPS处理组 1.13±0.101) 0.73±0.041)LPS+CQ组 0.71±0.042) 1.30±0.052)LPS+CQ+LY294002组 1.09±0.043) 0.98±0.063)
讨 论
脓毒症是重症监护病房患者非冠状动脉疾病死亡的主要原因之一,具有高发病率、高死亡率的特点。在脓毒症中,ARDS是造成脓毒症死亡率居高不下的主要因素之一[15]。肺泡上皮细胞损伤是ARDS的主要机制之一[2-3]。AT2细胞的重要功能之一是合成、储存、分泌肺泡表面活性物质,可以帮助调节肺泡表面张力辅助呼吸[3]。研究发现,AT2细胞还在增强肺泡液清除率和减少肺部炎症方面起积极作用[16]。
CQ是经典的预防和治疗疟疾的药物,文献报道CQ可以抑制AT2细胞凋亡,减轻百草枯导致的小鼠肺损伤[17]。但CQ对脓毒症中AT2细胞损伤的作用尚不明确。本研究构建了LPS诱导所致的AT2细胞损伤模型,并筛选出合适的CQ治疗浓度。进一步用CQ处理LPS诱导的AT2细胞损伤模型,观察CQ对细胞活力和细胞凋亡的作用。结果显示,CQ能够显著逆转LPS诱导所致的细胞活力下降,促进细胞增殖。
Bcl-2家族是细胞线粒体凋亡途径中的关键蛋白,也是Akt信号通路的下游调控因子,且多项研究发现Akt蛋白磷酸化激活可以减轻细胞凋亡[11-12]。本课题组以往在其他细胞模型中研究发现CQ可以激活PI3K/Akt信号通路以抑制LPS诱导的细胞凋亡[13-14],故我们推测CQ可能通过激活Akt蛋白,从而减轻LPS诱导所致的AT2细胞凋亡。
细胞凋亡是细胞为维持内环境稳定而进行的细胞自主有序死亡,最常见的启动途径是线粒体途径(内源性途径)和外源性途径。我们的前期研究和相关文献均发现CQ可以抑制线粒体凋亡的发生[13,18]。本研究结果显示CQ作用后,Bcl-2/Bax比值增加,裂解的胱天蛋白酶3表达下降,提示对于AT2细胞株,CQ可以通过抑制线粒体凋亡途径,从而减轻LPS诱导造成的AT2细胞凋亡。

图2 CQ对AT2细胞凋亡相关蛋白及p-Akt水平的影响

图3 PI3K/Akt通路在CQ减轻LPS诱导的AT2细胞损伤中的作用
PI3K/Akt信号通路中,Akt可被磷酸化激活,调控下游因子,参与细胞代谢、细胞死亡和细胞迁移等多种重要的细胞过程;线粒体凋亡途径中Bcl-2家族是PI3K/Akt信号通路激活后的下游调控因子。本课题组在LPS诱导的人脐静脉内皮细胞损伤模型研究中发现,CQ可以通过激活PI3K/Akt信号通路,减轻LPS诱导的血管内皮细胞凋亡[14]。因此,本研究对AT2细胞中Akt蛋白活化水平进行研究。Akt蛋白的活化水平可以通过Akt蛋白的磷酸化水平和Akt蛋白活性试剂盒进行检测。本研究通过蛋白质印迹实验检测各组p-Akt水平,结果发现LPS可以减少Akt蛋白的磷酸化水平,而加入CQ后,LPS的作用被逆转,Akt磷酸化增加,说明CQ可以通过激活PI3K/Akt信号通路,抑制细胞凋亡的发生。为了进一步验证CQ主要通过激活PI3K/Akt信号通路,抑制LPS诱导的AT2细胞凋亡,本研究加入了PI3K/Akt信号通路抑制剂LY294002(LPS+CQ+LY294002组),结果发现,抑制PI3K/Akt信号通路后,Bcl-2/Bax比值降低,且裂解的胱天蛋白酶3水平上升,即CQ对AT2细胞株的抗细胞凋亡作用被消除,表明CQ的确是通过激活PI3K/Akt信号通路,抑制LPS诱导的AT2细胞凋亡。
综上所述,LPS可以损伤AT2细胞,而CQ能够通过激活PI3K/Akt信号通路,增加Akt蛋白磷酸化,抑制线粒体凋亡,减轻LPS诱导的AT2细胞损伤。FAS/FASL信号通路是细胞凋亡中的主要调控途径之一,下一步本课题组将对该信号通路进一步研究。同时本课题组将着眼细胞功能,探究CQ对AT2细胞合成分泌炎症因子、肺表面活性物质等的影响。
