卵泡抑素样蛋白1对氧化低密度脂蛋白诱导血管平滑肌细胞增殖的影响
2021-07-30叶佳雯
肖 凡,查 晴,刘 亚,杨 玲,叶佳雯,刘 艳
(上海交通大学医学院附属第九人民医院心血管内科,上海 200011)
目前,心血管病的负担越来越严重,已成为全球较为严重的公共卫生问题。流行病学研究显示心血管病的死亡率占居民总死亡原因的首位[1]。而脂质沉积是心血管病的重要危险因素之一[2]。既往研究证明,氧化低密度脂蛋白(oxidized low-density lipoprotein,Ox-LDL)诱导的血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖效应可被沉默信息调节蛋白1(silencing information regulatory protein 1,SIRT1)阻断[3]。抑制平滑肌细胞的增殖则有利于抵抗血管重构,从而减少血管生理异常的发生和发展[4-5]。
本课题组前期研究发现,APE小鼠发生脂质沉积的血管区域中存在卵泡抑素样蛋白1(follistatinlike protein 1,FSTL1)表达降低的现象。有研究报道,FSTL1也可参与细胞增殖调控的过程中[6],例如FSTL1抑制增殖相关通路的激活从而抑制肿瘤细胞增殖能力[7]。FSTL1是否参与Ox-LDL调控血管增殖的过程鲜有报道。本研究旨在探讨Ox-LDL和FSTL1参与VSMC增殖发生和发展。
材料与方法
一、材料
4周龄、雄性C57BL/6J小鼠(北京维通利华实验动物技术有限公司上海分公司)用于VSMC的提取。胎牛血清(fetal bovine serum,FBS)、磷酸盐缓冲液(phosphate buffer saline,PBS)、青霉素-链霉素(penicillin-streptomycin)双抗溶液、抗青霉素-链霉素-新霉素(anti-penicillin,streptomycin,and neomycin)三抗溶液、0.25%胰蛋白酶(trypsin)、DMEM培养基(dulbecco’s modified eagle medium)均购自美 国Gibco公司。其他有人重组FSTL1(美国R&D Systems公司)、SIRT抑制剂(中国Med Chem Express公司)、细胞活力检测试剂盒(cell counting kit-8,CCK-8)(日本Dojindo公司)。RNA反转录试剂盒及实时定量PCR检测试剂盒购于日本Takara公司。FSTL1抗体(1∶1 500)购自美国Abcam公司。Ox-LDL购于赛默飞世尔科技(中国)有限公司。
二、方法
1.动物分组:实验动物载脂蛋白E(apolipoprotein E,ApoE)-/-小鼠分为对照组(普通饲料喂养4个月)和血管病变组(高脂喂养4个月),每组6只小鼠。实验重复3次。实验周期结束后将小鼠处死。保留心脏、血管和肾脏等组织用于后续实验检测。
2.VSMC的提取和鉴定:将小鼠麻醉致死,剥离取小鼠主动脉并浸泡于10%的三抗溶液中。于显微镜下仔细剥离血管外膜的脂肪、胶原和血管等组织,并将其从中剖开,用沾有三抗溶液的棉棒将血管内膜的内皮细胞刮除。随后,将剥离干净的血管组织转移至超净台中,用三抗溶液再次洗涤2~3次,随后用显微剪将其剪成小组织块。最后加入少许FBS,将其与组织块混合均匀放入培养箱45 min~1 h。待FBS将组织块黏于皿底后加入DMEM培养基(DMEM+10%FBS+1倍双抗)。培养至约1周,可见组织块边缘有平滑肌细胞爬出。可加入胰酶将细胞消化下来,重新接种于新的培养皿,用于后续细胞鉴定和实验。
3.细胞增殖实验:取100μL对数期的细胞接种于96孔板中;每组设置6个复孔,实验处理结束后,每个孔中加入10μL的CCK-8溶液,重新放入培养箱培养5 h。酶标仪设定450 nm吸光度A值。根据公式计算:增殖率(细胞活力)=(实验组-空白对照)/(阴性对照-空白对照)×100%,实验组为实验组细胞和CCK-8溶液的A值;阴性对照为对照细胞和CCK-8溶液的A值;空白对照为培养基和CCK-8溶液的A值。实验重复5次。Ox-LDL刺激浓度分别为12.5、25和50 mg/L,Ox-LDL联合FSTL1刺激浓度分别为50 mg/L和100μmol/L。
4.蛋白质印迹(Western blotting):运用细胞裂解液提取总蛋白,细胞实验条件为Ox-LDL刺激浓度0、12.5、25、50 mg/L,刺激时间0、6、12和24 h;然后用二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,并计算所需要的蛋白样品体积,总体积20μL(上样缓冲液体积∶蛋白样品体积=1∶3);将样品置于100℃加热10 min,使样品变性。将样品和标志物加入电泳胶的加样孔内;电泳分离不同分子量的蛋白,120 V电泳,时间为标志物对应的目的条带分离时终止电泳;电泳后切除多余的胶。将胶转移至转膜液中放置15 min,将事前准备的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(0.45μm)泡于甲醇中10 min,制作转膜“三明治”顺序为:转移盒负极-海绵-滤纸-凝胶-PVDF膜-滤纸-海绵-转移盒正极的顺序由下而上放置(300 mA);转膜结束后封闭(5%牛奶、1 h);洗膜缓冲液(Tris buffered saline Tween,TBST)洗5次,每次5 min;加一抗孵育(1∶1 500、4℃、12 h);TBST洗5次,每次5 min;加入二抗孵育(室温、1 h),配置显影液,拍照观察。实验重复5次。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参。
5.免疫组织化学(免疫组化):取新鲜的血管样品经4%甲醛固定,随后用石蜡包埋并切片。用二甲苯对组织切片进行脱蜡。将样品依次浸入无水乙醇、95%乙醇、85%乙醇和75%乙醇各5 min,最后用双蒸水清洗。用拘橼酸盐修复液修复抗原表位(pH 6.0、95℃2 min),自然冷却样品至室温,TBS溶液洗涤样品3次,每次5 min。用3%双氧水阻断内源性过氧化物酶的作用20 min,TBS溶液洗涤样品3次,每次5 min。用5%马血清封闭、室温、30 min,加一抗1∶1 5 00,4℃孵育12 h。将样品从冰箱取出,室温放置30 min;TBS溶液洗涤样品3次,每次5 min;加入二抗1∶5 000室温孵育30 min。TBS溶液洗涤样品,PBS孵育10 min,TBS溶液洗涤样品3次,每次5 min。配置二氨基联苯胺显色溶液,控干TBS后,将二氨基联苯胺显色溶液加于组织上。于显微镜下观察到黄色阳性染色出现后,吸掉染色液,将样品置于蒸馏水中终止反应。苏木素复染细胞核3 min,自来水洗掉染色液,盐酸乙醇分化5~10 s,自来水冲洗;分化后将样品依次浸入95%乙醇1~3 min,无水乙醇5 min;中性树脂封片;显微镜观察。免疫组化采用半定量分析方法,采用image pro plus软件分析积分光密度(integrated optical density,IOD值),最后用IOD值/面积。实验重复6次。
6.免疫荧光:实验刺激结束后用PBS洗细胞3次,加入4%多聚甲醛固定细胞20 min,PBS洗涤样品3次。5%马血清封闭,室温、1 h。加一抗1∶500,4℃孵育12 h;PBS洗涤样品3次;加二抗1∶1 000室温、1 h,PBS洗涤样品3次。4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染色15 min,PBS洗涤样品3次。采用40倍镜观察,每个细胞皿取上、下、左、右、中5个视野,每个视野的细胞数为3~5个。重复5次。
三、统计学分析
结 果
一、原代VSMC的鉴定
免疫荧光检测原代平滑肌细胞中特异性蛋白α-SMA的表达,结果显示,提取的细胞具有α-SMA的表达,且细胞形态为长梭型,证明提取的细胞为小鼠原代VSMC(见图1)。
二、Ox-LDL下调FSTL1表达量
免疫组化染色分析结果显示,与小鼠正常血管组织相比,FSTL1在Ox-LDL沉积的病变血管组织中表达减少(0.223±0.010比0.097±0.019,t=27.381,P<0.01)(见图2)。

图1 原代细胞免疫荧光染色(40×)

图2 FSTL1在Ox-LDL沉积的病变组织中表达情况
Ox-LDL 0、12.5、25、50 mg/L分别刺激VSMC 24 h,蛋白质印迹法检测FSTL1表达水平分别为1.330±0.055、0.905±0.027、0.753±0.037和0.243±0.016,在Ox-LDL浓度最高时,FSTL1表达水平最低(F=260.600,P<0.000 1)(见图3A)。
50 mg/L Ox-LDL分别刺激VSMC 0、6、12、24 h,蛋白质印迹法检测FSTL1的表达分别为1.383±0.033、0.782±0.047、0.381±0.022和0.230±0.017,Ox-LDL诱导时间为24 h时,FSTL1表达水平最低(F=151.000,P<0.000 1)(见图3B)。
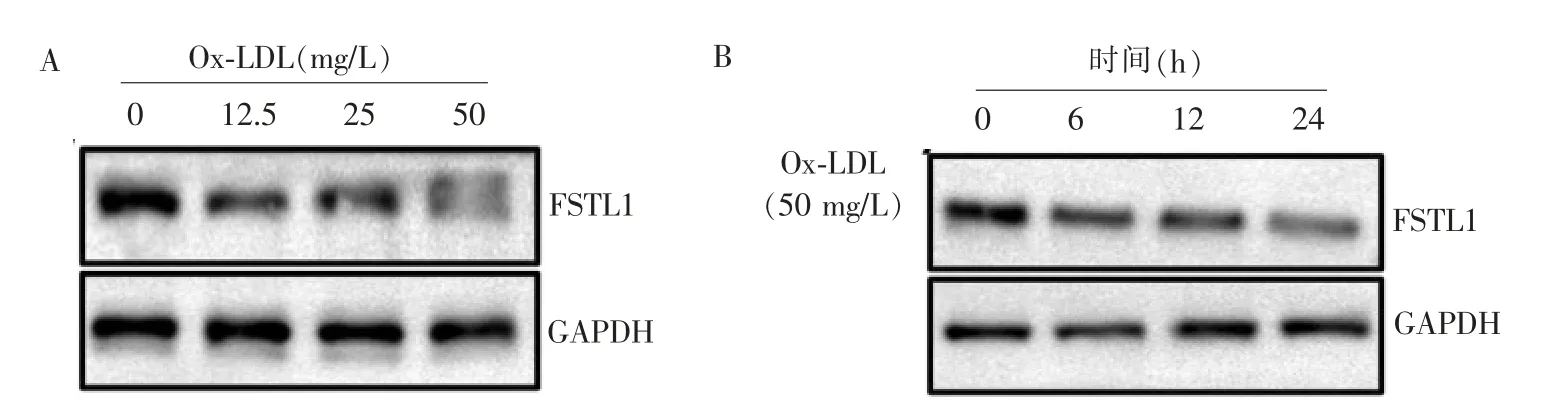
图3 VSMC的FSTL1表达量
三、FSTL1抑制Ox-LDL诱导的平滑肌细胞增殖
CCK-8检测结果显示,与对照组相比,Ox-LDL组VSMC增殖能力增加(0.870±0.010比1.890±0.020,t=7.852,P<0.01)。但Ox-LDL+FSTL1共刺激后,VSMC增殖能力比Ox-LDL组低(1.890±0.020比1.200±0.023,t=11.85,P<0.01)(见表1)。
四、FSTL1抵抗Ox-LDL诱 导VSMC的 表 型转化
蛋白质印迹实验结果显示,在Ox-LDL刺激下VSMC的OPN表达上升(t=14.700,P<0.01),但α-SMA(t=15.341,P<0.01)和SIRT1表达减少(t=12.180,P<0.01)(见图4)。
而FSTL1与Ox-LDL共刺激的条件下,VSMC出现OPN表达减少(t=27.790,P<0.05),但α-SMA(t=11.151,P<0.05)和SIRT1表达增加(t=17.800,P<0.01)(见图4)。
五、FSTL1通 过SIRT1抑 制Ox-LDL诱 导VSMC的表型转化
与Ox-LDL+FSTL1组相比,Ox-LDL+FSTL1+SIRT1抑制剂组VSMC中α-SMA和SIRT1表达减少,但OPN表达增多(均P<0.01)(见表2、图5)。

图4 FSTL1对抗Ox-LDL刺激导致的VSMC表型转化
使用蛋白质印迹法检测VSMC在对照组、Ox-LDL刺激组和Ox-LDL+FSTL1组3种情况中SIRT1、α-SMA和OPN的表达量。
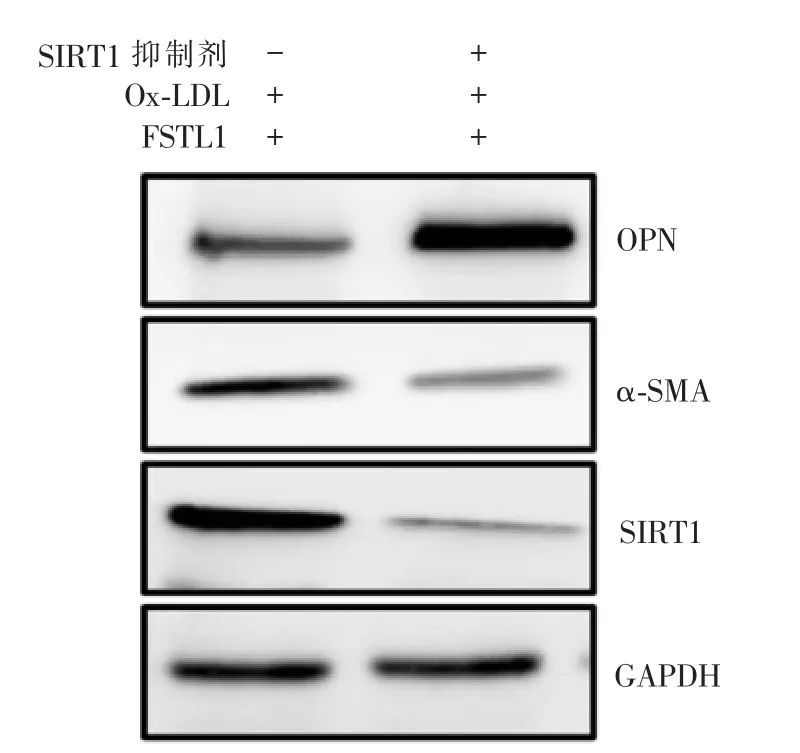
图5 FSTL1通过SIRT1抑制Ox-LDL诱导的VSMC表型转化
六、FSTL1通 过SIRT1抑 制Ox-LDL诱 导VSMC的增殖
使用CCK-8检测方法评估VSMC在不同条件下的增殖能力显示,与Ox-LDL+FSTL1组相比,Ox-LDL+FSTL1+SIRT1抑制剂组VSMC增殖能力增加(t=7.271,P<0.01)(见表2)。
表1 VSMC的增殖检测和蛋白表达量(均n=5,±s)

表1 VSMC的增殖检测和蛋白表达量(均n=5,±s)
1):与对照组相比,P<0.01;2):与Ox-LDL刺激组相比,P<0.01。
项目 对照组 Ox-LDL刺激组 Ox-LDL+FSTL1组 F P A450 nm0.870±0.010 1.890±0.0201) 1.200±0.0232) 314.800 <0.000 1 OPN 1.001±0.031 2.698±0.0011)1.590±0.0012)236.200 <0.000 1 α-SMA 1.303±0.030 0.493±0.0691) 0.653±0.0152) 407.700<0.000 1 SIRT1 0.993±0.044 0.613±0.0301) 1.231±0.0112) 383.500 <0.000 1
表2 VSMC的增殖检测和蛋白表达量(均n=5,±s)

表2 VSMC的增殖检测和蛋白表达量(均n=5,±s)
项目 Ox-LDL+FSTL1组 Ox-LDL+FSTL1抑制剂组 t P OPN 1.643±0.047 3.533±0.100 17.256 <0.01 α-SMA 0.530±0.033 0.283±0.032 6.696 <0.01 SIRT1 1.056±0.020 0.207±0.021 28.821 <0.01 A450 nm 1.280±0.033 2.030±0.092 7.271 <0.01
讨 论
大中动脉的血管壁主要由三层结构组成,内皮细胞构成内膜,平滑肌细胞参与中膜的形成,外膜则由疏松结缔组织组成。血管中膜在构成血管张力上起重要作用,但血管中膜平滑肌细胞的异常增殖是导致高血压、动脉粥样硬化等血管性疾病发生、发展的关键始动因素之一[8]。导致VSMC增殖的原因有很多。研究报道,Ox-LDL是导致血管病变的重要因素之一[9-10]。Ox-LDL沉积的病变血管区域存在较多血管生理异常的现象[11]。Ox-LDL可诱导VSMC由收缩表型(蛋白标志物α-SMA)向分泌表型(蛋白标志物OPN)转化,从而导致VSMC增殖能力增加[12]。这种现象在本研究过程中也有发现,Ox-LDL的刺激可导致VSMC的表型转化,进而导致其增殖能力增加。此外,Ox-LDL可以导致机体中保护性因子的减少,从而诱发疾病的发生、发展[13]。本研究也发现,FSTL1这一心血管保护性因子,随着Ox-LDL诱导的浓度和时间增加,平滑肌细胞表达的FSTL1呈现下降趋势。
既往的研究证明,FSTL1作为外分泌的糖蛋白和许多疾病的发生和发展有关,这可能与参与炎症反应、肿瘤细胞侵袭和迁移、突触传递、血管新生、细胞增殖和凋亡有关[14]。本课题组前期研究发现,Ox-LDL可下调VSMC中FSTL1的含量,且实验结果证实,加入FSTL1后发现,FSTL1能减少Ox-LDL刺激导致的VSMC增殖。这提示,Ox-LDL可能通过下调FSTL1起到诱导VSMC增殖的作用。
文献报道,FSTL1在心血管病中发挥保护心血管的作用。心肌梗死后,FSTL1分泌增多,FSTL1通过DIP2A(disco interacting protein 2 homolog A)受体活化Akt激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路,从而抑制心肌纤维化改善心功能[16]。受到此研究的启发,加之本研究过程也发现Ox-LDL对FSTL1的抑制作用。为揭示VSMC增殖的原因,本研究观测VSMC不同表型对应的标志物。实验证明,Ox-LDL诱导下VSMC由原来的收缩型向分泌型转化,而这种表型转化导致平滑肌细胞增殖能力的增加。而FSTL1能通过激活SIRT1抵抗Ox-LDL诱导的平滑肌表型转化,从而降低Ox-LDL刺激下VSMC的增殖能力。本研究通过探讨FSTL1对于Ox-LDL诱导的VSMC增殖这一病理过程的作用,进一步了解两者的生物学效应。
综上所述,本研究发现Ox-LDL异常沉积的病变血管区存在FSTL1表达下调的现象。加入FSTL1后,发现FSTL1能有效抵抗Ox-LDL对VSMC的增殖作用,这为揭示FSTL1对抗Ox-LDL的血管毒性作用添加了新的证据。
