阿扎胞苷联合venetoclax治疗新诊断老年急性髓系白血病的临床观察
2021-07-30叶晨静徐文彬李军民
黄 磊,叶晨静,吴 超,徐文彬,俞 晴,李军民,阎 骅,
(上海交通大学医学院附属瑞金医院a.全科医学科;b.血液科,上海 200025)
2018年11月美国食品药品监督管理局批准将去甲基化药物(hypomethylating agent,HMA)与抗凋亡蛋白B细胞淋巴瘤因子-2(B-cell lymphoma 2,BCL-2)的选择性小分子抑制剂venetoclax联合应用,治疗不适合强诱导化疗的新诊断老年急性髓系白血病(acute myeloid leukemia,AML)患者[1]。阿扎胞苷是一种同时具有针对DNA及RNA双重作用的HMA,近年来国外多项临床研究肯定了其与venetoclax联合治疗老年AML的有效性及可耐受性[2-3],但国内相关临床报道鲜见。本研究旨在临床观察阿扎胞苷联合venetoclax治疗新诊断初治老年AML的疗效及安全性。
资料与方法
一、临床资料
回顾性分析2018年3月至2020年9月我科收治的新确诊老年AML患者14例,中位年龄70(63~76)岁,男性、女性各7例。诊断根据WHO分类诊断标准[4]。均不适合标准强化疗:包括年龄>75岁,合并严重心脑血管、呼吸系统疾病,中重度慢性肾脏疾病或其他肿瘤治疗史等。排除标准:①之前因血液系统疾病接受过HMA、venetoclax或化疗;②中枢神经侵犯;③研究治疗前7 d内使用过中高强度细胞色素P450 3A酶(cytochrome P450 3A,CYP3A)诱导剂或抑制剂。所有患者之前未接受过AML治疗,白细胞计数<20×109/L,部分患者治疗前应用羟基脲以使白细胞降至这一水平以下是被允许的,尽量避免溶瘤综合征发生。以美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)标准进行体能评分。以美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)标准进行细胞遗传学预后危险分层。
二、治疗方案
所有初治患者采用阿扎胞苷(德国Baxter Oncology GmbH,注射剂100 mg/瓶)+venetoclax(爱尔兰Abbvie Ireland NL B.V,100 mg/片)方案。第一疗程阿扎胞苷75 mg/m2第1~7天(d1~7)皮下注射,venetoclax 100 mg d1、200 mg d2、400 mg d3~28口服,28 d为一疗程。同时予以水化、碱化,防止肿瘤溶解综合征发生;其后所有疗程,阿扎胞苷同前,venetoclax从d1起即400 mg开始口服,疗程28 d。为避免溶瘤综合征发生,确诊时高白细胞患者服用羟基脲,使白细胞降至20×109/L以下后开始治疗。
三、评价指标
每一疗程结束后予骨髓穿刺涂片,行流式细胞术测定微小残留病灶(minimal residual disease,MRD)。根据国际工作组的AML反应标准来评价疗效[5]。主要终点为①复合完全缓解率:完全缓解(complete remission,CR)+CR伴血细胞不完全恢复(CR with incomplete blood count recovery,CRi)率;②总反应率(overall response rate,ORR):CR+CRi+部分缓解(partial remission,PR);③首次到达反应(CR或CRi)时间、反应持续时间(duration of response,DOR):指CR+CRi持续时间。次要终点为总生存(overall survival,OS)期及药物安全性,药物不良反应采用常见不良事件评价标准(common terminology criteria for adverse event,CTCAE)4.03版进行分级。患者出现不可耐受的不良反应时,药物酌情减量,或暂停、或延长治疗间歇期;因各种原因换用其他方案则停止观察随访。随访截止日期为2020年12月1日。
四、统计学方法
采用SPSS 18.0软件进行统计学分析。生存分析采用Kaplan-Meier法,绘制生存曲线。采用Logrank检验进行组间比较。P<0.05为差异有统计学意义。
结 果
一、患者基本特征
14例 患 者 中ECOG评 分1~2分 者13例(93%);继发性白血病2例(14%);按细胞遗传学预后分层高危患者9例(64%),中危患者3例(21%)。5例(36%)核仁磷蛋白1(nucleophosmin 1,NPM1)基因突变,4例(29%)TP53基因突变,1例(7%)Fms样酪氨酸激酶3-内部串联重复(Fms-like tyrosine kinase 3-internal tandem duplication,FLT3-ITD)基因突变。基线骨髓原始细胞数≥30%占多数,共11例(79%)。4例(29%)治疗开始前服用过羟基脲(见表1)。
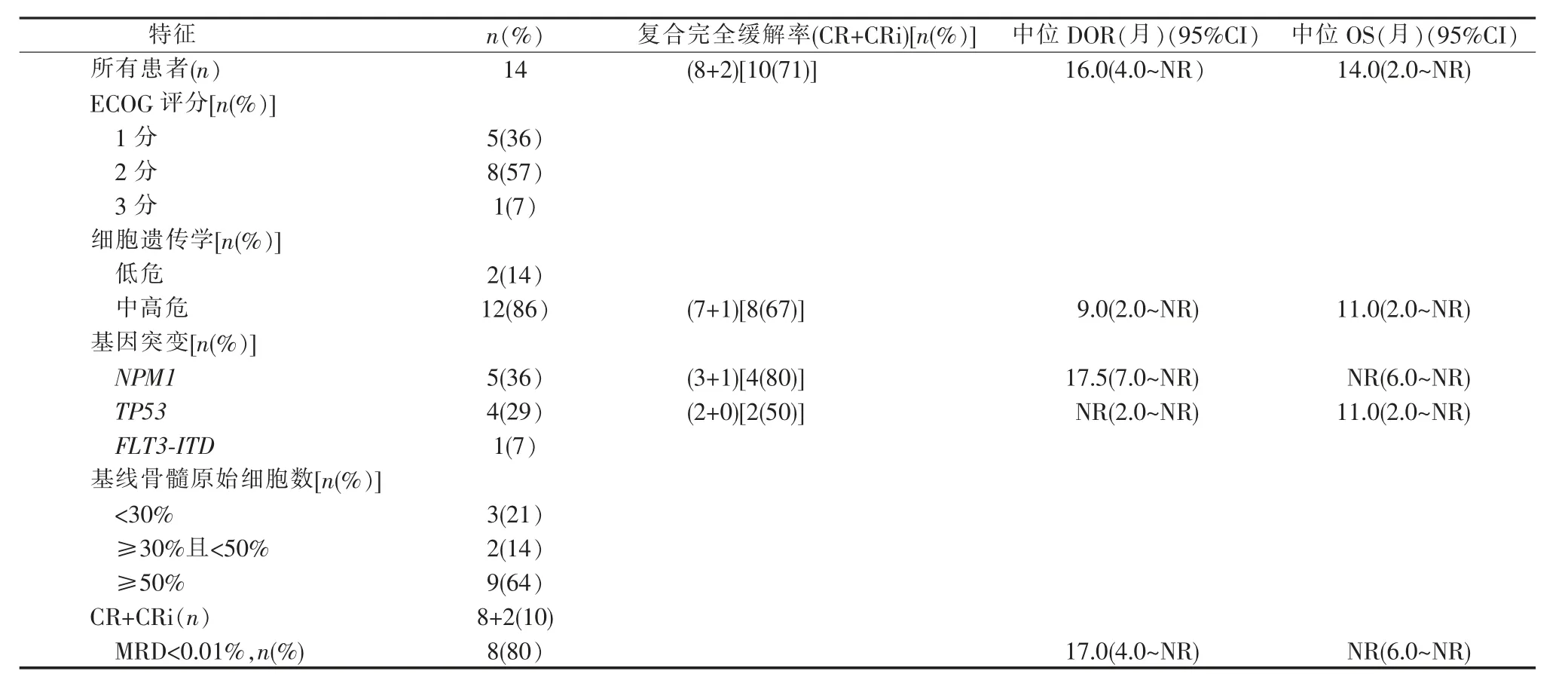
表1 患者基本特性,疗效评价及生存情况(n=14)
二、疗效评价
所有患者中位随访时间为12.5(2.0~24.0)个月,8例(57%)达到CR,2例达到CRi(14%),1例(7%)PR,3例(22%)未缓解。复合完全缓解率(CR+CRi)为71%,ORR为79%;中位首次到达反应时间为1.1(1.0~2.1)个月,中位DOR为16.0个月[95%CI:4.0~未达到(not reached,NR)],中位OS期为14.0个月(95%CI:2.0~NR)。半年、1年、2年的OS率分别为77%、55%和39%。
在CR+CRi的10例患者中,至少1次达到MRD<0.01%者8例(80%),其中位DOR为17.0个月(95%CI:4.0~NR),中位OS未达到(95%CI:6.0~NR)。
在细胞遗传学中高危的12例患者中,共8例(67%)获CR+CRi,中位DOR为9.0个月(95%CI:2.0~NR)。中位OS期为11.0个月(95%CI:2.0~NR)。4例TP53基因突变患者中2例(50%)获CR、2例NR,观察截止时CR患者仍未进展;中位OS期为11.0个月(95%CI:2.0~NR)。5例NPM1基因突变患者中4例(80%)获CR+CRi,中位DOR为17.5个月(95%CI:7.0~NR),中位OS期未达到(95%CI:6.0~NR)。1例FLT3-ITD基因突变患者CR持续7个月后复发、进展死亡,OS期为10.0个月(见表1、图1)。
三、不良反应
最常见的药物相关不良反应为血液系统和胃肠道系统。所有患者都发生不同程度的细胞减少,14例(100%)均发生3级以上粒细胞减少,其他3级以上不良反应包括粒细胞减少伴发热6例(43%),血小板减少7例(50%),贫血5例(36%)。2例(14%)出现严重肺部感染。对于4例缓解后持续3级以上细胞减少患者予适当药物减量、延长治疗间歇期,venetoclax减至200 mg/d或300 mg/d,服用2~3周,每28~42 d为一疗程。
血液系统以外不良反应主要是胃肠道反应,有恶心、呕吐9例(64%),腹泻1例(7%),便秘2例(14%);另外乏力9例(64%),2例(14%)出现皮疹,1例(7%)口腔溃疡。以上非血液系统不良反应为1~2级,均可控、耐受。仅1例发生溶瘤综合征,积极治疗后可控。
讨 论
AML诊断时的中位年龄为68岁[6],即半数以上患者为老年人。老年患者常因高龄体力状态差、合并症多,往往难以耐受高强度化疗;且不良生物学特征多见,早期病死率高,长期生存率低,整体预后差。临床上一直在探求针对老年患者高效且安全的治疗方案。
阿扎胞苷具有良好的调控白血病细胞分化作用,促进凋亡。多项临床研究证实阿扎胞苷较传统治疗可安全有效地延长老年AML的总生存时间[7-9],但是单药治疗仍面临反应率较低(通常<30%)、起效较慢等不足,总体生存不够理想(中位OS期<1年)。Venetoclax可致AML细胞快速启动凋亡,在治疗AML中具有单药临床活性和可耐受的安全性[10]。在体外实验中,venetoclax与阿扎胞苷显示了协同作用[11];BCL-2蛋白家族中的髓细胞白血病因子-1(myeloid cell leukemia 1,MCL-1)是AML发病机制中至关重要的抗凋亡蛋白,并可能与venetoclax耐药相关,阿扎胞苷可明显降低细胞中MCL-1的浓度水平,以上为两药联合提供了理论依据[12-13]。
由此,DiNardo等[2-3]先后进行了2项前瞻性多中心临床试验,显示阿扎胞苷与venetoclax 400 mg剂量联合组初治老年AML,起效快、缓解率高。CR+CRi率可达73%;在高危患者中,CR+CRi率也超过了60%;中位OS期超过1年,疗效显著且安全、耐受性好。本研究中,venetoclax采用前述临床试验推荐的400 mg/d剂量,联合阿扎胞苷治疗新诊断的不适合强化疗的老年AML患者,其中细胞遗传学预后不佳者占大部分,但总体CR+CRi达到71%,中位OS期达到14.0个月,中位首次到达反应时间为1.1个月,即1个疗程就到达,半年、1年、2年的OS率约分别为77%、55%和39%,与之前DiNardo等[2-3]报道结果基本一致,也与近期公布的Viale-A研究[14]相仿,这项国外Ⅲ期临床研究证实对于初治年龄大(>75岁)及不适合强诱导化疗的AML患者,两药联合临床疗效显著优于阿扎胞苷单药,OS期明显延长达到14.7个月,比对照组提高了50%,死亡率降低34%,CR+CRi率达到66.4%,高于对照组3倍,患者获得更快及更高比例的深度缓解。而本研究从缓解深度分析,在获得CR+CRi患者中有80%达到至少1次MRD<0.01%,且DOR和OS期有更长的趋势,中位数分别为17.0个月和NR。故提示在老年AML患者中,两药联合治疗同样具有反应迅速、缓解率高、生存时间长及高比例深度缓解的特点。
因病例数较少,本研究着重研究了细胞遗传学中高危患者,CR+CRi率达到67%,中位DOR和中位OS期分别为9.0个月和11.0个月,介于DiNardo等[3]研究的中危组与高危组之间,结果相仿,证实中高危患者也可以在两药联合治疗中获得较满意的疗效。TP53基因突变往往提示AML患者预后不良,国外研究显示两药联合在这类患者中反应率最低、生存时间最短。本研究TP53基因突变病例数少,但也显示出一定的获益;而本研究中NPM1基因突变患者两药联合显示出很好疗效,也与国外研究相似,具有高反应率、持续缓解及OS期延长,预后较好。以上也提示了老年AML患者分子分型与疗效反应的相关性。
药物安全性方面,所有患者都发生血液系统不同程度的细胞减少,其中3级以上粒细胞减少如预期全部出现,另外还有不同比例的血小板减少、粒细胞减少伴发热、贫血等,可能与传统化疗一样会经过细胞减少这一过程,一般不予药物调整;若缓解后持续细胞减少,则首先考虑venetoclax为主的不良反应,因为在之前venetoclax单药治疗慢性淋巴细胞白血病患者中已报道较高比例的粒细胞减少发生率[15]。故本研究4例缓解后仍持续3级以上细胞减少患者,参考国外文献,采用venetoclax减量、延长治疗间歇期的策略,至观察截点其中3例持续缓解,1例复发进展。非血液系统不良反应为1~2级,多可控可耐受。溶瘤反应少见,只有1例患者发生且可控。总体来看,两药联合方案对于老年AML患者安全、低毒、耐受性良好。
综上所述,本研究临床实践认为阿扎胞苷联合venetoclax应用于新诊断老年AML患者疗效肯定,安全可耐受,尤其对于不适合强化疗的老年患者,该方案有一定的优势。在今后的工作中,将扩大病例数,进一步探索药物的治疗以及获得CR后的维持治疗,为中国老年白血病人群的整体治疗提供合适的选择。
