带状采伐对毛竹林土壤细菌群落结构的影响
2021-07-30吴昌明范少辉申景昕刘广路
吴昌明,范少辉,冯 云,申景昕,刘广路
(国际竹藤中心 国家林业和草原局竹藤科学与技术重点实验室,北京 100012)
生活在土壤中的微生物常通过代谢活动促进土壤有机质周转,改变土壤的理化性质,促进养分和能量的转化。土壤微生物在养分循环与平衡、土壤质量的改善中起着重要作用,揭示着生态系统功能的变化[1-2]。土壤微生物对外界环境条件的变化十分敏感,常作为反映土壤质量及健康状况的指标。微生物群落结构的稳定性与微生物的物种、功能、系统发育多样性密切相关[3-5]。在不发生自然或人为干扰的条件下,陆地生态系统中的土壤微生物群落结构处于相对稳定的状态,而不同的植被类型、气候类型、经营管理措施、土地利用方式、地形梯度会显著影响土壤微生物群落结构[6-9]。土壤微生物群落结构和生态功能的研究,经历了纯培养、微平板分析、微生物生物量、生物标记物、分子生物学等研究方法[10]。现今,主要通过高通量测序技术对土壤中微生物的特定基因片段进行测序,通过序列间可变区域的测定和比对可揭示微生物群落的多样性[11]。例如:高尚坤[12]利用高通量测序技术对不同营林措施下马尾松人工林的土壤微生物群落特征的研究表明,营林措施显著改变了土壤微生物的群落结构,同时轻度采伐的细菌、真菌Alpha 多样性和丰度显著下降。胡华英等[13]对16S rDNA序列的V3+V4 区域进行测定,研究发现,在杉木人工林中添加生物炭能改变土壤中细菌优势种群的丰度,且影响细菌群落的功能。李伟成等[14]运用Illumina MiSeq 高通量测序技术研究了不同营林方式下中小径级毛竹林土壤细菌群落的变化,经α-多样性和主坐标分析表明,覆盖经营对土壤细菌群落的物种多样性和结构产生了较大影响,细菌的丰度和种类得到提高。同样在毛竹林生态系统,施磷措施能显著改变土壤细菌群落结构,变形菌和子囊菌的相对丰度增加[15]。
1 研究区概况
研究区位于福建省永安市,地处闽中偏西,雨量充沛,日照时间长,霜期短,热量资源充足,属典型的亚热带季风山地气候。四季夏长冬短,气候温暖湿润,年均气温19.3℃;无霜期约为300 d,年均日照1 800 h,年降水量1 600 mm 左右,适于常绿阔叶林等亚热带林木生长。
2019年6月,于属天宝岩自然保护区外沿北部,距永安市城区约28 km 的上坪乡联合村(117°27′43″E,26°00′20″N)进行带状采伐毛竹林试验地调查。该村毛竹林由散户承包,以合作社的形式经营。经营者连年挖笋获取毛竹林的经济收益,毛竹林密度过大时,对密处进行择伐,改善毛竹林林分结构。毛竹林间还散生檫木Sassafras tzumu、杉木Cunninghamia lanceolata、南酸枣Choerospondias axillaris、马尾松Pinus massoniana等树种;林下植被主要有白背叶Mallotus apelta、翅柃Eurya alata、紫金牛Ardisia japonica等灌木;草本植物主要是芒萁Dicranopteris pedata、狗脊Woodwardia japonica、淡竹叶Lophatherum gracile、金丝草Pogonatherum crinitum等,森林覆盖度95%以上。土壤类型为花岗岩和砂岩风化发育成的红壤。
2 材料与方法
2.1 供试土样
供试土样来源于南亚热带分布区的带状采伐毛竹林试验地,以不同采伐带宽的土样为研究对象,保留带的土样为对照,供试混合土壤样品共15 个。
2.2 样品采集与处理
为避免地形等造成的试验误差,样地应选择在坡度、坡向、海拔等大致相同的位置。设置采伐带宽为3、6、9、12 m,长20 m 的采伐样地组3 个;4 个宽度处理的带状采伐措施有3 个采伐处理区组(A、B、C),共15 块固定样地。采伐方法:在试验区内将采伐带内的毛竹垂直等高线全部伐除,采伐带间设置保留带(保留带宽度为采伐带的2 倍)。采伐后将竹枝等剩余物清理出样带。用PVC 管将采伐带与保留带进行界定,便于后期毛竹林更新的监测。采伐带与保留带不采取任何人工营林措施,分别在采伐带、保留带内设置取样点。
采伐前,设置20 m×20 m 的临时样方,对样方内的毛竹进行每木调查,纪录胸径、年龄(度数)、株高等实测因子。其中毛竹年龄按度数统计:Ⅰ度为1年生,Ⅱ度为2~3年生,Ⅲ度4~5年生,Ⅳ度为6~7年生。另外,记录样地所在位置的坡度、坡向、坡位、海拔等地形条件(表1)。

表1 样地区组基本信息Table 1 Basic information of sample plot group
2019年11月1日,在3、6、9、12 m 采伐带、24 m 保留带内采集0~20 cm 的表层土壤,“棋盘式”9 钻为一个混合土样,去除枯枝落叶、碎石等杂质后装入塑封袋混匀,然后取少量表层混合新鲜土样于25 mL 离心管中,保存于干冰盒,迅速带回实验室存于-80℃超低温冰箱,并尽快用于土壤微生物DNA 的提取。将塑封袋内剩余土壤密封,带回实验室用鲜土过2 mm 筛,待自然风干后用于测定土壤化学性质。分别将3、6、9、12 m采伐带内的土壤样品标记为SW3m、SW6m、SW9m、SW12m,24 m 保留带标记为Res。
2.3 养分及酶活性分析
土壤pH 值:用水∶土为2.5∶1 的玻璃电极法测定;土壤有机质(SOM):高温外热重铬酸钾氧化-容量法;全氮(TN):凯氏-蒸馏滴定法;全磷(TK):氢氧化钠熔融-钼锑抗比色法;全钾(TK):氢氧化钠熔融-火焰原子吸收分光光度法;碱解氮(AN):碱解扩散法;有效磷(AP):盐酸-氟化铵提取-钼锑抗比色法;速效钾(AK):乙酸铵提取-火焰原子吸收分光光度法;脲酶(Ure):比色法;磷酸酶(Pho):磷酸苯二钠比色法;过氧化氢酶(Cat):容量法[23]。化学分析中使用到的仪器:火焰原子吸收分光光度计(型号:Z-2300,日本日立公司);分光光度计(型号:UV-754,上海精密科学仪器有限公司)。
2.4 高通量测序
提取土壤微生物基因组DNA,细菌用16S rRNA 的V3+V4 区域引物进行PCR 扩增(338F:5'-ACTCCTACGGGAGGCAGCA-3'/806R:5'-GGACTACHVGGGTWTCTAAT-3');PCR 扩增程序:初始DNA 在98℃下变性2 min;98℃下退火30 s、50℃下退火30 s,70℃下退火60 s,循环30次;最后在72℃下延伸5 min。PCR 产物检测质量合格,将PCR 产物回收后送北京百迈客生物科技有限公司进行建库测序(www.biocloud.net),测序仪器为Illumina HiSeq 2500。
乳酸菌是定居在动物肠道中的正常微生物,常被选用菌种进行发酵饲料,具有潜在的益生作用,有利于维护动物的肠道健康。因其能够代谢生成大量乳酸,降低饲料pH值,且饲料发酵后具有酸香味,从而能极大地提高动物的食欲。同时,经乳酸菌发酵后,能提高饲料中营养物质的含量,降低抗营养因子含量,具有一定的抑菌作用,能够防止杂菌污染,提高发酵饲料的品质[4-5]。一般来说,乳酸菌发酵饲料常采用固态发酵技术,既能降低成本,又能利用其厌氧发酵的特点进行深层发酵,利于大规模发酵的应用。
2.5 数据处理与分析
2.5.1 测序数据处理
使用FLASH(version 1.2.11)软件进行序列(reads)拼接,将拼接得到的序列用Trimmomatic(version 0.33)进行质量过滤,并用UCHIME(version 8.1)去除嵌合体,得到高质量的优化序列(Clean Tags)。用USEARCH(version 10.0)在相似性为97%的水平上对序列进行聚类,以测序所有序列数的0.005%作为阈值过滤OTU。基于OTU 分析结果,用RDP Classifier:置信度阈值为80%(version 2.2,http://sourceforge.net/projects/rdpclassifier/)上分析细菌(16S rRNA)序列;选择Silva 数据库(Release132,http://www.arb-silva.de)。利 用Mothur(version v.1.30,http://www.mothur.org/)分析细菌的Alpha 多样性指数。通过BugBase 软 件(https://bugbase.cs.umn.edu/)预测复杂细菌功能途径的生物水平覆盖以及生物可解释表型。使用R 软件的picante 包对土壤微生物的系统发育多样性指数进行计算[24]。细菌的系统发育多样性指数包括系统发育多样性指数(PD,Phylogenetic diversity,标识群落系统发育树的枝长总和)、净种间亲缘关系指数(NRI,Net Relatedness index)、净最近种间亲缘关系指数(NTI,Nearest taxon index)。
2.5.2 数据分析
运用SPSS 21.0 软件的单因素方差分析(选择最小显著差法(LSD)进行多重比较,显著性水平为95%)分析门水平下不同采伐带宽间土壤细菌的物种相对丰度,分析不同采伐处理间土壤细菌群落α 多样性、BugBase 功能预测特征、系统发育多样性指数的差异性。用R(v.3.6.3)软件vegan 包中的 binary jaccard 算法分析细菌群落特征相似性,作非度量多维标定法(NMDS)图,利用置换多元方差分析(PERMANOVA)检验不同采伐带宽间β 多样性的差异显著性。用R 软件完成门水平土壤细菌与土壤养分、酶活性的冗余分析(RDA),可视化土壤养分、酶活性对土壤细菌群落的重要程度。用mantel 检验土壤养分、酶活性对土壤细菌群落造成的影响程度,通过显著相关性判断影响土壤细菌群落结构变化的相关养分或酶活指标。分别使用Excel、R 软件作图。
3 结果与分析
通过高通量测序分析了15 个样带的15 个混合样品,细菌(16S rRNA)测序共获得序列(Reads)数1 199 145,优化序列(Clean tags)数1 125 429。对所有优化序列进行OTU 划分,按照97%相似性阈值对非重复序列(不含单序列)进行OTU 聚类,得到OTU 的代表序列915 条。在门、纲、目、科、属、种中对OTU 进行聚类,共得到细菌17 门、40 纲、85 目、126 科、195 属、213 种。
3.1 土壤细菌优势门的分布特征
发现细菌的主要优势门为酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)等,相对丰度累计占到95%以上。酸杆菌门、变形菌门、放线菌门相对丰度分别超过10%,在毛竹林土壤中大量存在,说明这三门细菌在毛竹林土壤功能中具有重要作用。由表2可知,毛竹林带状采伐后,土壤放线菌门的相对丰度在3 m 采伐带显著增加(P<0.05),其余细菌类群无显著变化;绿弯菌门、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)的相对丰度呈上升趋势,浮霉菌门的相对丰度呈下降趋势,不同采伐带宽间无显著性差异。

表2 不同采伐宽度下细菌门水平相对丰度的变化Table 2 Variety of relative abundance of bacteria in different cutting widths at phylum level %
3.2 土壤细菌的α 多样性特征
α 多样性(Alpha diversity)反映的是单个土样物种丰度(Richness)及物种多样性(Diversity),有多种衡量指标:Ace、Chao1 多度指数,Shannon、Simpson 多样性指数。Ace、Chao1 多度指数表示物种数量的多少。Shannon 指数值越大,Simpson 指数值越小,说明样品的物种多样性越高[25]。由图1可知,不同采伐带宽间的细菌Ace、Chao1 多度指数有显著性差异(P<0.05),而不同采伐带宽间的细菌Shannon 和Simpson 多样性指数无显著差异。SW3m、SW9m 的Ace 多度指数显著大于Res(P<0.05),具体表现为:SW3m>SW9m>SW6m>SW12m>Res。SW3m 的Chao1 多度指数显著大于Res、SW12m(P<0.05),与SW6m、SW9m 间无显著差异,具体表现为:SW3m>SW9m>SW6m>SW12m>Res。不同采伐处理间的细菌Ace 与Chao1 多度指数表现出相同的趋势,Shannon 和Simpson 多样性指数互为反向规律。
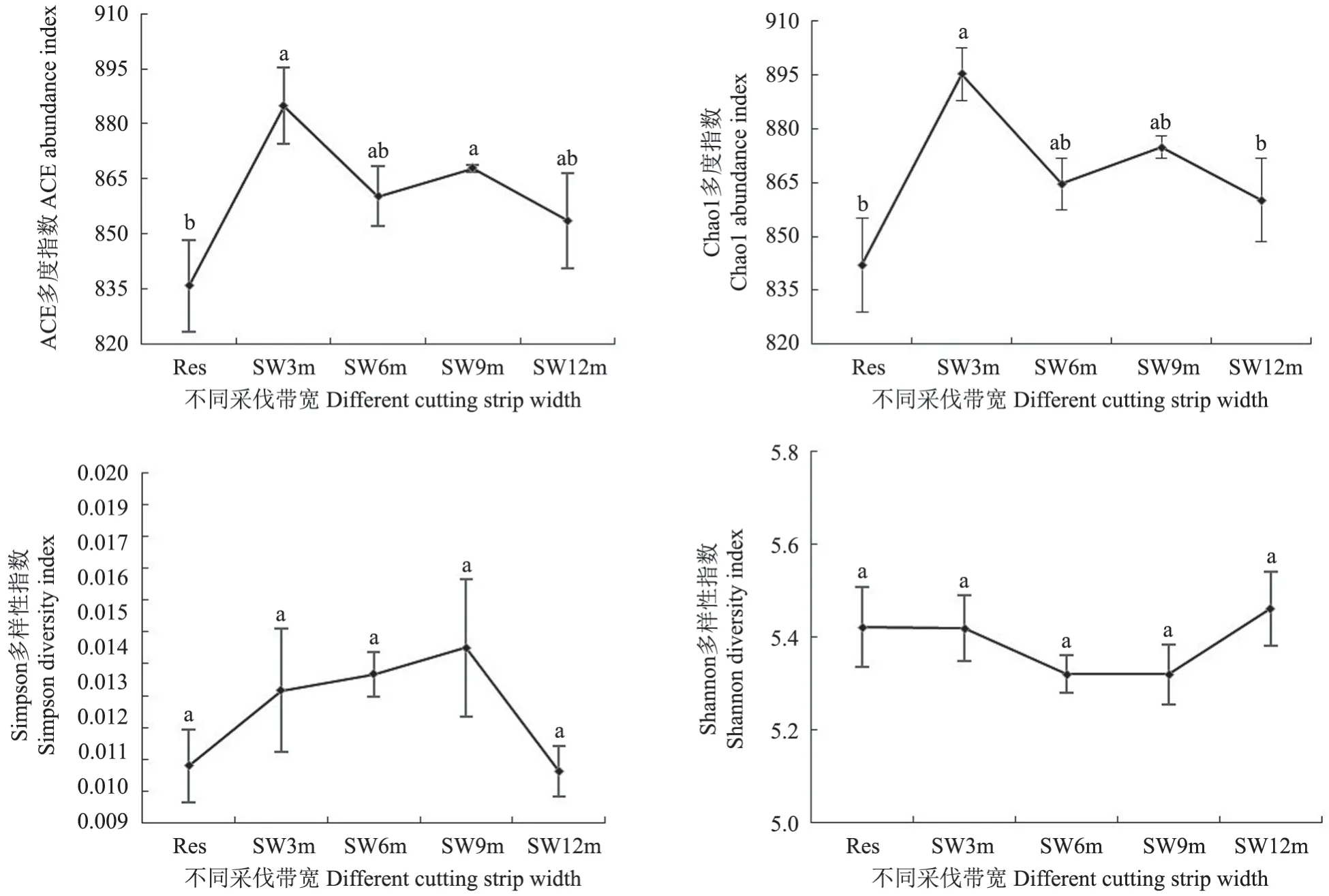
图1 细菌的α 多样性Fig.1 Bacterial α diversity
3.3 土壤细菌的β 多样性特征
使用Binary jaccard 算法分析不同处理间细菌的β 多样性。结果如图2所示,不同采伐带宽的细菌β 多样性与保留带(Res)有较显著差异,SW3m、SW6m、SW12m 与Res 的坐标平均距离最近,其次是SW9m,说明SW9m 改变了细菌群落结构;SW9m 的组内坐标距离最近,群落结构最相似。PERMANOVA 分析结果表明,不同处理间与不同处理组内重复的β 多样性差异不显著,不同采伐带宽下细菌(R2=0.356,P=0.038)的物种组成受到较显著影响。不同处理组的细菌β 多样性大小排序:SW12m>Res>SW3m>SW6m>SW9m(图3)。

图2 土壤细菌的NMDS 图像Fig.2 NMDS diagram of soil bacteria

图3 土壤细菌的PERMANOVA 分析箱型图像Fig.3 PERMANOVA analysis box diagram of soil bacteria
3.4 土壤养分、酶活性的变化特征
由表3可知,毛竹林带状采伐后,表层(0~20 cm)土壤的TP含量发生了显著变化(P<0.05),SW3m、SW6m 的TP 含量显著升高,其他养分指标及酶活性无显著影响。土壤SOM、TK 含量呈减小,Pho 含量呈增大的趋势。
3.5 土壤细菌与养分、酶活性的关系
对土壤门水平细菌与土壤养分、酶活性进行冗余分析(RDA),结果表明(图4),第一主坐标轴(RDA1)解释了31.03%的变异,第二主坐标轴(RDA2)解释了19.38%的变异,土壤养分及酶活性等性质解释了细菌门水平上50.41%的变异。可以初步确定测定的土壤养分及酶活性指标中,全磷、全氮、速效氮、过氧化氢酶、C∶P、N∶P 是土壤门水平细菌群落结构发生变化的主要驱动因子。在不同采伐带宽下,全磷、全氮对SW3m 的门水平细菌影响最大,速效氮、C∶P、N∶P对Res 的门水平细菌影响最大,过氧化氢酶对SW12m 的门水平细菌影响最大。前十门水平细菌的厚壁菌门、拟杆菌门、浮霉菌门在RDA 分析中的因子载荷值较高,是带状采伐后土壤中变化较为明显的细菌类群。通过mantel检验进一步分析(表3),确定门水平细菌群落主要受全氮(R=0.31,P=0.046)、全磷(R=0.19,P=0.040)、C/P(R=0.40,P=0.026)、N:P(R=0.29,P=0.038)的驱动。

表3 门水平细菌与土壤养分及酶活性的mantel 检验†Table 3 Mantel test of between bacteria and soil nutrient,enzyme activity at phylum level

图4 门水平细菌群落与土壤养分、酶活性的RDA 分析Fig.4 RDA analysis of bacterial community and soil nutrient,enzyme activity at phylum level

表3 不同采伐处理下土壤养分及酶活性的变化†Table 3 Vareity of soil nutrients and enzyme activities under different cutting treatments
3.6 土壤细菌系统发育学特征
由图5可知,毛竹林带状采伐后细菌系统发育多样性指数(PD)升高:SW3m>SW9m>SW6m>SW12m>Res,且SW3m 的细菌系统发育多样性指数显著大于SW12m、Res(P<0.05);带状采伐后随着采伐宽度的增大,细菌系统发育净种间亲缘关系距离指数(NRI)先减后增:SW12m>SW9m>Res>SW3m>SW6m;细菌净最近种间亲缘关系指数(NTI)降低:Res>SW9m>SW6m>SW3m>SW12m,且不同采伐处理间的差异未达到显著性水平。

图5 细菌的系统发育多样性指数Fig.5 Phylogenetic diversity index of bacteria at different cutting widths
4 讨 论
本研究中的毛竹林土壤表层(0~20 cm),细菌三大优势门为酸杆菌门、变形菌门与放线菌门,不同于Zhang 等[15]发现的变形菌门为主要群落构建类群。而与Xiao 等[26]在毛竹林0~10 cm表层土壤发现的细菌优势门酸杆菌门、变形菌门、绿弯菌门(Chloroflexi)相类似。与非根际细菌组成不同,酸杆菌门主要在根际土壤聚集[27],本研究酸杆菌门作为优势类群可能与毛竹林土壤中根系分布密集有关。经带状采伐后,3 m 采伐带的土壤放线菌门显著增加,而6、9、12 m 采伐带的土壤放线菌门无显著变化。放线菌门通常参与降解植物木质素和纤维素[28],优先参与植物残体和枯落物的碳源分解[29]。出现这一现象的原因可能是毛竹林带状采伐后,在不同采伐带宽的样地中的进行采伐剩余物清理时,3 m 采伐带中采伐剩余物清理得不够彻底,3 m 采伐带中的采伐剩余物较多,采伐带内土壤温度增加[30],致使土壤放线菌门迅速增加,以分解采伐带中残留较多的采伐剩余物。
土壤微生物的α 与β 多样性是反映土壤微生物群落结构的重要指标。经带状采伐后,3、9 m采伐带的细菌物种丰度显著增大,细菌物种多样性无明显变化;由于采伐带内受光面积增大,光辐射较强,土壤温度升高,且细菌对温度敏感,在土壤温度增加条件下大量增殖,物种丰度增加;而毛竹林中散生有杉木、南酸枣等高大乔木,影响了部分采伐样带中的光合辐射,6、12 m 采伐带中细菌物种丰度相较于保留带无显著变化。群体间的β 多样性越小,群体间的物种类型越相似,9 m 采伐带的细菌β 多样性最小,说明相较于其他采伐带,9 m 采伐带内的细菌群落物种组成发生改变,且在9 m 采伐带内细菌群落组成最相似;当外界环境变化时,细菌因其较高的结构多样性和功能冗余(指特定环境条件下多种微生物行使同一种功能),会表现出较强的稳定性[31]。
带状采伐后,全量养分在土壤表层中变化显著的是全磷,速效养分在土壤表层无显著性变化。放线菌门、厚壁菌门与全磷呈极显著或显著正相关,而与速效磷呈负相关关系,另外,C∶P 在各采伐带降低,C∶P 值越低(图4),表明土壤中微生物对有机质的矿化能力越强,磷的释放能力越大[32],说明放线菌门与厚壁菌门可能存在具有较强解磷功能的细菌类群。已有研究证明细菌主要采取r 生存策略,利用速效氮和根系分泌物等快速生长周转[33-34]。带状采伐后,毛竹林土壤速效氮含量增加,为细菌多度的增加提供了养分基础。浮霉菌门与速效氮显著负相关,厚壁菌门与速效氮显著正相关,说明速效氮对细菌不同类群的存在异向作用,速效氮含量的增加可促进厚壁菌门细菌的生长,而抑制浮霉菌的生长。一般认为,C∶N 与土壤有机质的矿化速率呈反比,C∶N 越低,有机质矿化越快[35]。带状采伐后毛竹林土壤有机质含量、C∶N减小,可能与土壤中细菌的数量增加有关。虽然表层土壤过氧化氢酶、磷酸酶、脲酶酶活性在带状采伐下变化不显著,但是其活性在一定程度上改变了细菌的群落结构特征。带状采伐后,3 m 采伐带过氧化氢酶减少,6、9、12 m 采伐带增加,这与土壤中放线菌有关。毛竹林经带状采伐后土壤紧实,好氧菌数量减少,厌氧菌数量增多,过氧化氢酶通过酶促反应产生氧气以保证好氧菌丰度的稳定。
微生物的系统发育多样性代表着环境生态位的多样性,种间谱系距离越近,表明两者的生态位越近[36]。毛竹林带状采伐引起土壤养分及酶活性的变化,从而造成细菌种群生态位发生调整。因此微生物系统发育多样性代表了不同功能群体在生态系统中的多样性,系统发育多样性越高的微生物群落拥有的功能多样性越高,且功能多样性是反映生态系统群落稳定性的重要指标[37-38]。带状采伐后,毛竹林土壤细菌的系统发育多样性指数(PD)升高,细菌在3 m 采伐带显著升高。植物多样性假说认为植物多样性高可以产生更多的生态位空间,以容纳多样的土壤微生物类群,如土壤细菌、真菌等微生物的多样性均随着植物物种多样性的增加而升高[39-41]。毛竹林的树种结构简单,林下植被物种多样性低,采伐带内的毛竹伐除后,草本层、灌木层植物大量更新或恢复,依附植物生长的细菌种群开始增殖,细菌的物种多样性增大,导致细菌系统发育多样性指数升高。
净种间亲缘关系距离指数(NRI)、净最近种间亲缘关系指数(NTI)可度量群落结构中的物种分布情况,若NRI/NTI>0,则说明与零模型的随机抽取的群落相比更倾向于聚集,即群落中亲缘关系相近的物种更易聚集在一起,而NRI/NTI<0,则呈现为系统发育发散,亲缘关系较远的物种构建群落[42-43]。本研究中细菌的系统发育NRI、NTI均大于0,说明保留带及各采伐带的土壤细菌群落为系统发育聚集(phylogenetic clustering),微生物群落结构的维持机制符合生态位理论,环境因子决定了微生物的群落结构[44-45],属确定性过程。带状采伐对毛竹林土壤细菌的NRI、NTI 无显著性影响,细菌的系统发育方向仍倾向于聚集。另外,毛竹林带状采伐后,土壤细菌的NTI 呈下降趋势,说明土壤细菌近缘种间的系统发育距离变远,生态位也随之分化。
本研究采用的高通量测序技术在细菌群落分析方面表现出较大的优势,但是仅通过高通量测序这一研究方法对细菌的群落结构进行研究,难免会出现研究结果的偏差,后续研究中应考虑加入微生物量、微生物生物标记物或其他分子生物学研究方法,各研究结果间相互加以佐证,可提高研究结论的可靠性。本研究地点设在南亚热带毛竹林分布区,中、北亚热带分布区的毛竹林带状采伐后土壤细菌群落的响应研究还未涉及,今后应在区域尺度上探究带状采伐对微生物群落结构特征的影响。另外,如今毛竹林模拟机械化采伐仍以人工采伐的方式进行,未来采伐机械利用后,应考虑采伐机械的大小、重量、承载力等因素对毛竹林土壤中细菌群落的影响。
5 结 论
以上结果反映了毛竹林土壤细菌对带状采伐干扰的响应特征及响应机制,毛竹林在带状采伐后的恢复初期,对地下土壤细菌群落的物种组成、多样性及系统发育特征无显著性影响,仅细菌的相对丰度在3、9 m 采伐带显著增高。土壤细菌群落结构在9 m 采伐带最相似,说明经带状采伐后,9 m 采伐带的土壤细菌群落稳定性相对较好。毛竹林经带状采伐后短期恢复过程中,所设置的采伐带宽还未达到土壤细菌群落的中度干扰程度。根据带状采伐后毛竹林生产力指标及土壤性质变化特征的已有研究成果,采伐带宽设置6~9 m 较好,若短期内使用带状采伐经营毛竹林可设置9 m采伐带宽,土壤细菌群落的恢复力和抵抗力较强,稳定性较高。
