溃疡性结肠炎患者肠道菌群紊乱与Th17/ Treg 平衡及相关细胞因子的关系
2021-07-29朱梅萍
叶 佳 朱梅萍 刘 畅
上海中医药大学附属曙光医院脾胃病科,上海 201203
炎症性肠病(IBD)是一种慢性非特异性肠道炎症性疾病,而溃疡性结肠炎(UC)是IBD 常见类型,主要特点为结直肠黏膜弥漫、连续炎症改变,病变主要局限于黏膜下层和大肠黏膜[1]。研究认为,免疫失衡在UC 发病中扮演重要角色,以抗炎与促炎因子间失衡为主要研究方向[2]。T 淋巴细胞为机体重要免疫细胞,研究发现T 淋巴细胞激活后可释放多种血管活性物质和细胞因子,加重组织炎症反应,促进UC 发生和发展[3]。辅助性T 细胞17(Th17)和调节性T 细胞(Treg)是新近发现的CD4+T 淋巴细胞亚群,在多种免疫性疾病发生、发展中Th17/Treg 失衡及相关细胞因子的异常表达发挥重要作用[4]。有研究证实,UC 的发生和发展不仅与免疫调节功能紊乱有关,还与肠道菌群紊乱有关,是免疫损伤重要激发因素[5]。本研究就探讨UC 患者肠道菌群紊乱与Th17/Treg 平衡及相关细胞因子的关系。
1 资料与方法
1.1 一般资料
选取2018 年7 月—2020 年7 月上海中医药大学附属曙光医院(以下简称“我院”)收治的30 例活动期UC(AUC)患者为AUC组,其中男14 例,女16 例;平均年龄(45.56±3.72)岁;1∶1 选取我院30 例缓解期UC(RUC)患者为RUC组,其中男15 例,女15 例;平均年龄(45.68±3.63)岁。纳入标准:①经病理检查确诊,符合《炎症性肠病诊断与治疗的共识意见(2018 年,北京)》[6]中AUC、RUC 诊断标准;②患者及家属均知情研究。排除标准:①妊娠及哺乳期妇女;②心、肝、肾功能损害;③近1 个月使用免疫抑制剂、激素、微生态制剂、抗生素;④完全性肠梗阻或不完全性肠梗阻。另选取同期30 名来我院体检健康者为对照组,其中男16 名,女14 名;平均年龄(44.57±3.87)岁;三组一般资料比较,差异无统计学意义(P >0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.2 方法
1.2.1 肠道菌群数目检测 分别留取三组自然排出粪便1 g,粪便基因组DNA 提取试剂盒(北京天根生化科技有限公司;货号:D2700;规格:50T),反转录试剂盒(苏州宇恒生物科技有限公司;货号:R2043;规格:20 μL×100T)转录合成cDNA,加入细菌基因组DNA 引物,引物序列见表1,实时定量聚合酶链反应扩增,根据扩增曲线计算细菌数目,以lg n/g 表示。

表1 肠道菌群引物序列
1.2.2 外周血Th17、Treg、Th17/Treg比值测定抽取三组3mL空腹外周静脉血,密度梯度离心法获取单个核细胞,各管加入CD8a-异硫氰酸荧光素、CD3-藻红蛋白Cy5、白细胞介素(IL)-17 藻红蛋白,室温避光孵育30 min。加入100 μL 固定剂,孵育30 min,加入100 μL 破膜剂A,室温孵育15 min,磷酸缓冲盐溶液洗涤,800 r/min 离心6 min(半径13.5 min),收集细胞,加入100 μL破膜剂B 和IL-17 抗体,室温孵育20 min,磷酸缓冲盐溶液洗涤,磷酸缓冲盐溶液500 μL细胞重悬,贝克曼库尔DxFLEX 流式细胞仪测定Th17 占比。再抽取三组3 mL 空腹外周静脉血,加入10 μL CD127-藻红蛋白-Cy5、CD25-Cy5、CD4-异硫氰酸荧光素,室温孵育20 min,加入1 mL 溶血素,混匀后再加入磷酸缓冲盐溶液2 mL,1500 r/min 离心5 min(半径8 cm),弃上清,磷酸缓冲盐溶液500 μL细胞重悬,贝克曼库尔DxFLEX 流式细胞仪测定Treg 占比,并计算Th17/Treg 比值。
1.2.3 结肠黏膜组织中炎症因子表达水平测定 石蜡切片,二甲苯脱蜡,梯度酒精洗去二甲苯,柠檬酸钠缓冲液抗原修复,使内部抗原决定簇暴露,3%过氧化氢浸泡10 min,封闭,加入稀释一抗4℃孵育12 h,冲洗后加入二抗室温孵育30 min,磷酸缓冲盐溶液冲洗3 次。二氨基联苯胺作用4 min,去离子水终止,高倍镜(400 倍)下取5 个视野,计算黏膜组织中IL-2、IL-6、IL-10、IL-17 光密度值,以平均值为表达水平。
1.3 统计学方法
采用SPSS 26.0 统计学软件进行数据分析,计量资料采用均数±标准差()表示,组间比较采用独立样本t 检验,多组间采用单因素方差分析,组间两两比较采用LSD-t 检验,计数资料以例数和百分率表示,采用χ2检验;Pearson 系数进行相关性分析,以P <0.05 为差异有统计学意义。
2 结果
2.1 三组肠道菌群数目比较
AUC组肠球菌、肠杆菌数目明显多于RUC组、对照组,且RUC组高于对照组(P <0.05);AUC组拟杆菌、乳酸杆菌、双歧杆菌数目明显少于RUC组、对照组,且RUC组低于对照组(P <0.05)。见表2。
表2 三组肠道菌群数目比较(lg n/g,)
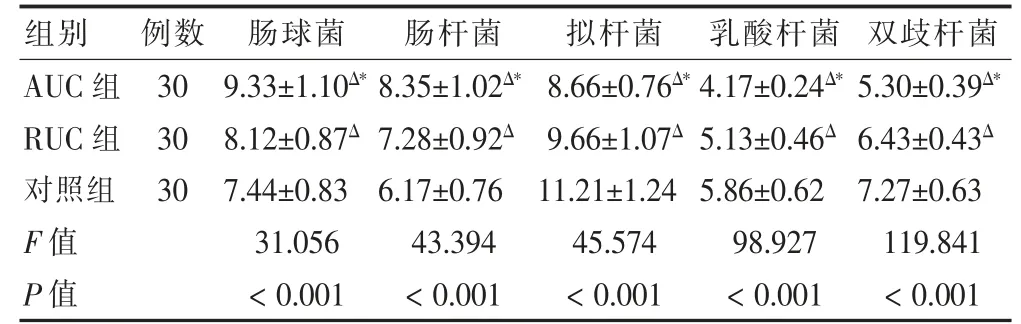
表2 三组肠道菌群数目比较(lg n/g,)
注:与对照组比较,ΔP <0.05;与RUC组比较,*P <0.05。UC:溃疡性结肠炎
2.2 三组外周血Th17、Treg、Th17/Treg 比值比较
AUC组外周血Th17 细胞比例明显高于RUC组、对照组,且RUC组高于对照组(P <0.05);AUC组Treg 细胞比例和Th17/Treg 比值明显低于RUC组、对照组,且RUC组低于对照组(P <0.05)。见表3。
表3 三组外周血Th17、Treg、Th17/Treg 比值比较()

表3 三组外周血Th17、Treg、Th17/Treg 比值比较()
注:与对照组比较,ΔP <0.001;与RUC组比较,*P <0.001。Th17:辅助性T 细胞17;Treg:调节性T 细胞;UC:溃疡性结肠炎
2.3 三组结肠黏膜组织中炎症因子表达水平比较
AUC组黏膜组织中IL-2、IL-6、IL-17 表达明显高于RUC组、对照组,且RUC组高于对照组(P <0.05);AUC组IL-10 表达明显低于RUC组、对照组,且RUC组低于对照组(P <0.05)。见表4。
表4 三组结肠黏膜组织中炎症因子表达水平比较(μm2,)

表4 三组结肠黏膜组织中炎症因子表达水平比较(μm2,)
注:与对照组比较,ΔP <0.05;与RUC组比较,*P <0.05。IL:白细胞介素;UC:溃疡性结肠炎
2.4 UC 患者外周血Th17、Treg 及炎症因子与肠道菌群数目的相关性
Pearson 相关性分析显示,UC 患者外周血Th17、IL-2、IL-6、IL-17 与肠球菌、肠杆菌呈正相关,与拟杆菌、乳酸杆菌、双歧杆菌呈负相关(P <0.05);Treg、IL-10 与肠球菌、肠杆菌呈负相关,与拟杆菌、乳酸杆菌、双歧杆菌呈正相关(P <0.05)。见表5。

表5 UC 患者外周血Th17、Treg 及炎性因子与肠道菌群数目的相关性(n=60)
3 讨论
UC 是消化系统疑难疾病,尽管目前UC 的确切病因不明,但近年有关免疫力和肠道菌群的研究兴起,发现UC 患者肠壁内存在明显过度免疫反应,引起肠道菌群抗原过度应答,导致消化道损伤,最终产生免疫损伤效应机制[7-13]。正常情况下,有超过500 种细菌定居于肠道,其中专性厌氧菌即生理性优势菌占菌群总量的99%,其余兼性厌氧菌即条件致病菌占1%,繁殖处于相对抑制状态[14-16]。Rosen 等[17]、Derikx 等[18]证实,UC 的发生与机体免疫和肠道菌群紊乱有关。Th17和Treg 为CD4+T 淋巴细胞亚群成员,其中Th17 表现为前炎性细胞亚类特征,Treg 表现为拮抗Th17 作用,二者细胞信号通路相互制约、交通,其平衡关系与机体免疫反应密切相关[19]。生理状态下,T 淋巴细胞倾向Treg 分化,以维持机体免疫耐受,但若在感染、炎症反应等病理状态下,可激活免疫系统,使T 淋巴细胞倾向Th17 分化,引起机体对自身抗原免疫反应[20-21]。本研究结果显示,三组外周血Treg 细胞比例逐渐降低,Th17 细胞比例和Th17/Treg 比值逐渐升高(P <0.05),提示UC 发生和发展有Th17/Treg 免疫失衡参与。结果显示,Th17 与肠球菌、肠杆菌呈正相关,与拟杆菌、乳酸杆菌、双歧杆菌呈负相关(P <0.05);Treg与肠球菌、肠杆菌呈负相关,与拟杆菌、乳酸杆菌、双歧杆菌呈正相关(P <0.05),两者与肠道菌群间关系相反,进一步提示肠道菌群紊乱可能通过各种机制影响Th17/Treg 免疫平衡,进而参与UC 发生和发展。
Th17 细胞和Treg 细胞均为CD4+T 细胞亚群之一,Th17 细胞可分泌IL-2、IL-6、IL-17 等促炎细胞,能诱导炎症反应,Treg 细胞可调节IL-10 等抗炎细胞,发挥负向免疫调节作用[22]。本研究结果显示,三组黏膜组织中IL-2、IL-6、IL-17 表达逐渐升高,IL-10表达逐渐降低(P <0.05),提示免疫炎症反应参与了UC 发生和发展。结果还显示,IL-2、IL-6、IL-17 与肠球菌、肠杆菌呈正相关,与拟杆菌、乳酸杆菌、双歧杆菌呈负相关,IL-10 与肠球菌、肠杆菌呈负相关,与拟杆菌、乳酸杆菌、双歧杆菌呈正相关(P <0.05),推测肠道菌群紊乱可诱导Th17/Treg 免疫失衡,调节炎症介质参与UC 发生和发展。但目前尚不明确肠道菌群紊乱影响Th17/Treg 免疫失衡的机制,可能与以下几点有关。①肠道菌群可能通过基因直接影响能量代谢、分化方向等相关物理功能,影响Th17/Treg 平衡:如肠道菌群能作用于胸腺基质淋巴细胞生成素等受体,调控初始CD4+T 淋巴细胞向Th17 细胞或者Treg 细胞分化[23-24]。②肠道菌群可能通过能量代谢途径影响Th17/Treg 平衡:如共生菌产生的三磷酸腺苷酶可直接激动小肠固有层CD11、CD70 细胞,促进CD4+T淋巴细胞向Th17 细胞分化,影响Th17/Treg 平衡,也可通过抑制1 型调节性T 细胞生成,破坏免疫耐受,增加Th17 细胞数目[25]。乳酸菌可上调碳水化合物代谢和转运相关基因,当碳水化合物利用增加时,可增加参与葡萄糖和脂质代谢的短链脂肪酸含量,通过游离脂肪酸受体2 和3 通路增强免疫耐受,抑制免疫炎症反应[26]。③肠道菌群可能通过细胞因子途径影响Th17/Treg平衡:如分节丝状菌能通过肠上皮细胞中树突细胞抗原和淀粉样蛋白A 促进CD4+T 淋巴细胞向Th17 细胞分化;同时树突细胞可分泌IL-22,通过先天淋巴细胞通道增加IL-6、IL-22 分泌,增加淀粉样蛋白A表达,促进向Th17 细胞分化[27-28]。
综上所述,肠道菌群紊乱可能通过各种机制影响Th17/Treg 免疫平衡,调节炎症介质分泌,参与UC 发生和发展。但本研究样本量少,还需大样本前瞻性研究证实。
