亚临床甲减对冠心病患者脂质代谢、斑块稳定性及内皮功能损伤的影响
2021-07-29杨娜梁文龙谢会娟
杨娜,梁文龙,谢会娟
(漯河市中医院检验科,河南 漯河 462000)
亚临床甲状腺功能减退症 (subclinical hypothyroidism,SCH)通常简称为亚临床甲减,患者通常无明显症状体征,实验室检测可见血清促甲状腺素(thyroid stimulating hormone,TSH)水平明显升高而总甲状腺素(total thyroxine,TT4)和游离甲状腺素(free thyroxine,FT4)水平正常[1]。SCH起病隐匿但病程时间较长,可对机体代谢造成不利影响并造成心、肺及神经肌肉等靶器官功能损害,近年来SCH与冠心病(coronary heart disease,CHD)等心脑血管疾病的关系逐渐引起广泛关注,有研究表明SCH可引起代谢异常,凝血障碍和血流动力学紊乱,从而导致CHD发病风险增加[2-5]。冠脉内皮损伤和粥样硬化是CHD主要病因和病理改变,同时脂质代谢异常在其中发挥重要作用,而甲状腺与机体代谢紧密相关,因此这可能是SCH引起CHD发病和进展的重要原因[6,7]。本研究通过分析SCH对CHD患者脂质代谢、冠脉斑块稳定性和血管内皮功能损伤的影响为临床预防和治疗提供参考依据。
1 资料与方法
1.1 一般资料 于2019年1月-2019年12月我院CHD患者中随机抽取128例为样本开展横断面研究,其中男性67例,女性61例,年龄46~92岁,平均(67.52±9.14)岁,体质量指数(BMI)18.2~34.9 kg/m2,平均(23.18±2.71)kg/m2,纽约心脏病协会(NYHA)分级包括Ⅰ级23例、Ⅱ级52例、Ⅲ级38例以及Ⅳ级15。纳入标准:⑴根据患者症状体征和辅助检查结果确诊为CHD[7];⑵患者年龄>18岁;⑶患者及家属均知晓本研究并签署同意书。排除标准:⑴合并其它类型心脑血管病变;⑵合并甲减、甲亢等其它甲状腺疾病或此前1个月内曾应用影响甲状腺功能的药物者;⑶合并甲状腺疾病、手术或外伤等相关病史;⑷此前1周内曾服用降压或降脂药物者;⑸伴其它影响甲状腺功能的疾病;⑹伴严重感染或恶性肿瘤等基础疾病。
1.2 研究方法
1.2.1 实验室检测 采用北京松下公司EW3000腕式电子血压计测量血压,嘱患者静坐休息5min后开始,重复测量3次取平均值,每次间隔5min。采用美国雅培公司c16000型全自动生化仪及配套标准化试剂盒检测总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、载脂蛋白A1(ApoA1)及载脂蛋白B(ApoB)等脂质代谢指标。采用硝酸还原酶法(试剂盒购自武汉新启迪公司)检测血清一氧化氮(NO)水平;采用ELISA法(试剂盒购自上海乔羽公司)测量血清内皮素-1(ET-1)水平。采用电化学发光法(罗氏Elecsys 2010化学发光检测仪及配套试剂)检测血清TSH、FT3和FT4水平。
1.2.2 血管内皮功能检测 采用Sonos 5500型彩色超声诊断仪(荷兰飞利浦公司)和配套4~10 MHz血管探头检测肱动脉内皮依赖性血管舒张功能(FMD)和硝酸甘油所介导的非内皮依赖性血管舒张功能(NMD),操作方法将探头固定于肘窝上方2cm处并测量肱动脉内径,先在静息状态下测量3个心动周期为基础内径(D0),然后采用血压计袖带在肘关节下约2~3cm处充气加压至250mmHg并维持5min后迅速放气,60 s测量内径(D1),嘱患者休息15min后舌下含服硝酸甘油0.5mg,5min后 测 量 内 径(D2),FMD%=(D1-D0)/D0×100%,NMD%=(D2-D0)/D0×100%。采用血管腔内超声(IVUS)检测冠脉斑块回声性质,测量血管外弹力膜面积(EEMA)、斑块最厚和最薄处直径(Dmax、Dmin)、管腔面积(LA)和斑块面积(PA)等参数,然后计算斑块负荷(PB)=PA/EEMA×100%;重构指数(RI)=斑块部位EEMA/参考部位EEMA均值;偏心指数(EI)=(Dmax-Dmin)/Dmax;脂核负荷=脂核面积/斑块面积;根据《血管内超声在冠状动脉疾病中应用的中国专家共识(2018)》中相关诊断标准[9],易损斑块指富含脂质同时纤维帽厚度<65μm的斑块。
1.2.3 数据收集和分析 患者入院后详细收集性别、年龄、个人生活方式及既往史等一般资料,同时完成上述检查内容,以TSH>4.8 mU/L且FT3和FT4正常为SCH组,TSH≤4.8 mU/L为对照组,比较两组各项指标差异,分析TSH与血脂、冠脉内皮细胞功能损伤及斑块稳定性相关参数的关系,然后探讨影响患者斑块稳定性的因素。
1.3 统计学方法 计数资料以率(%)形式表示,采用χ2检验进行比较,计量资料符合正态分布以(s)表示,两组比较采用独立样本t检验,采用Pearson积差系数进行相关性检验,采用多因素Logistic回归分析评估影响CHD患者易损斑块的危险因素,数据分析应用SPSS22.0软件,以P<0.05为差异有统计学意义。
2 结果
2.1 两组CHD患者临床资料比较SCH组年龄、TSH、TG、LDL-C、ApoB、ET-1、PB、脂核负荷以及易损斑块占比均高于对照组,NO、FMD和纤维帽厚度均低于对照组,差异有统计学意义(P<0.05)。
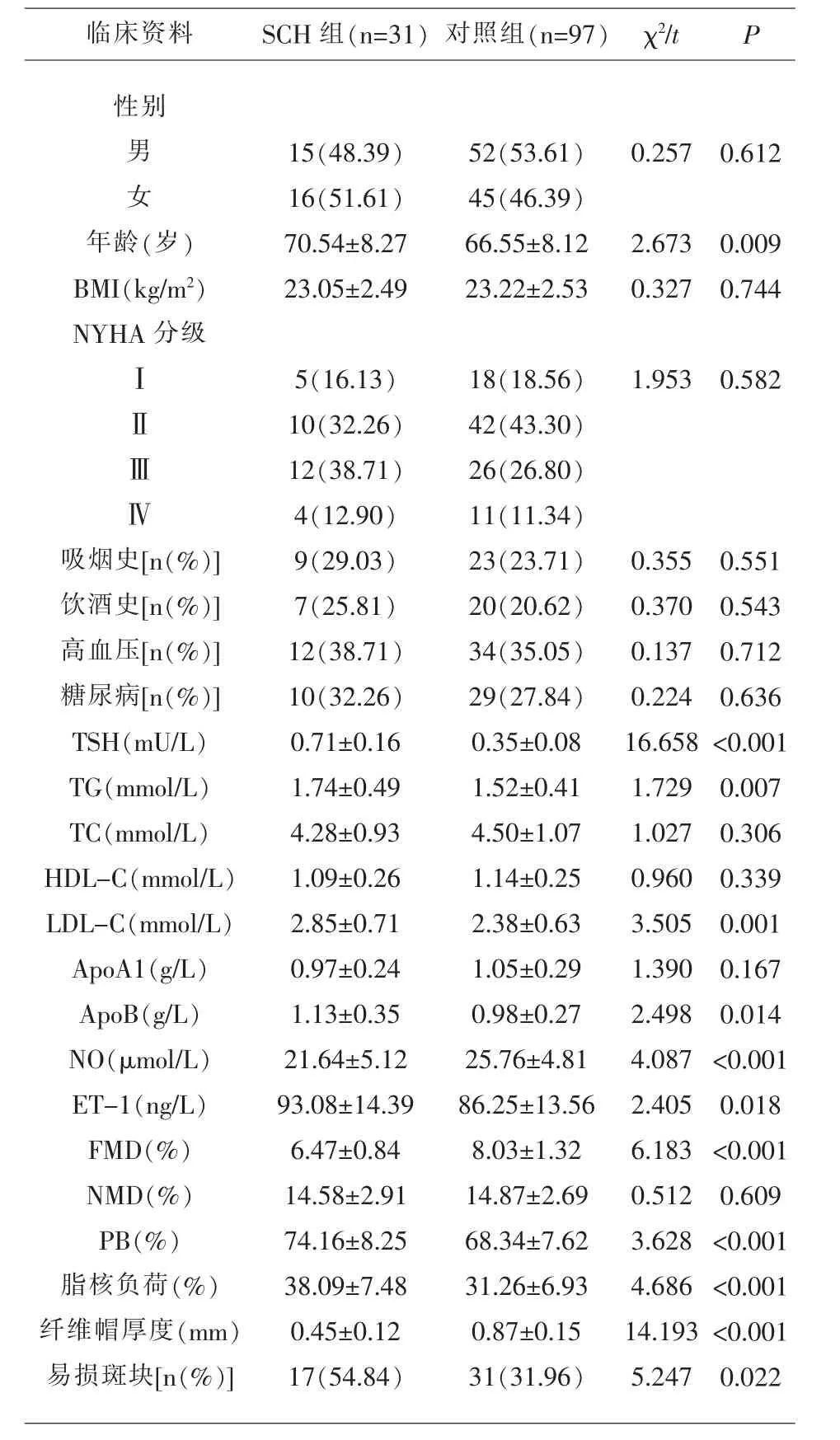
表1 两组CHD患者临床资料比较
2.2 TSH与脂质代谢、内皮功能损伤及斑块稳定性的相关性分析Pearson积差分析显示,SCH合并管CHD患者血清TSH水平与TG、LDL-C、ApoB、ET-1、PB和脂核负荷呈明显正相关性(P<0.05),与NO和FMD呈明显负相关性(P<0.05)。
2.3 不同斑块性质的CHD患者TSH和血脂比较易损斑块组TSH、LDL-C、ApoB、NO和FMD水平均高于稳定斑块组,NO和FMD水平均低于稳定斑块组,差异有统计学意义(P<0.05)。
2.4 CHD患者冠脉斑块稳定性的影响因素分析多因素Logistic回归分析显示吸烟史、TSH、LDLC、NO和ET-1均为影响冠脉斑块稳定性的独立危险因素(P<0.05)。
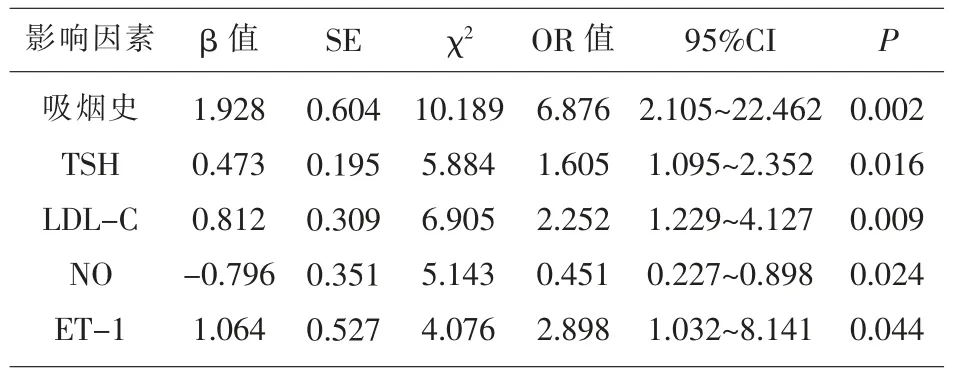
表4 CHD患者冠脉斑块稳定性的影响因素分析
3 讨论
随着社会发展和生活水平改善,心血管疾病已逐渐成为威胁人类身心健康的全球性公共卫生问题,文献报道我国现有患者数量约2.9亿,且每年死亡患者数量达350万,在城市和农村死亡人数中占比分别为39.1%和32.9%[10]。此外SCH也是临床常见病变,调查显示我国患病率约为16.7%,且随着年龄增长而明显升高[11]。SCH对CHD发病存在明显影响现已获得国内外普遍认可,积极探寻其详细机制并合理干预对心血管疾病预防和治疗具有重要意义。

表2 TSH与脂质代谢、内皮功能损伤及斑块稳定性的相关性分析
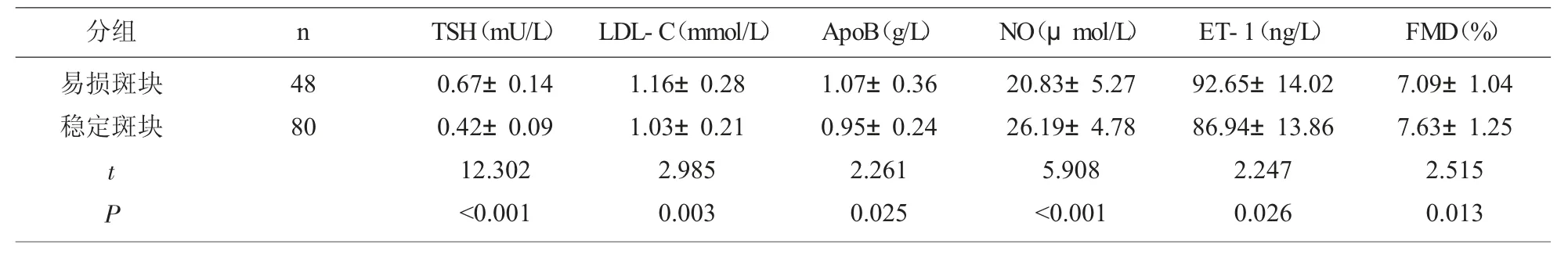
表3 不同斑块性质的CHD患者TSH和血脂比较
有研究认为TSH可明显提升3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)表达水平并抑制其磷酸化,从而促使胆固醇大量合成,同时甲状腺功能减退时可引起肝细胞表面LDL-C受体表达减少,导致胆固醇清除障碍,因此SCH患者血清TG、LDL-C和ApoB等表达水平可明显升高并增加CHD发病风险[12]。本研究显示CHD患者SCH患病率约为24.22%,明显高于王利娟等[13]报道的15.34%,较荣荣等[14]研究结果33.90%偏低,其原因可能与SCH发病率随年龄增长而升高有关,本研究中SCH合并CHD年龄明显升高也证实了上述观点。此外本研究显示SCH组血清TG、LDL-C、ApoB均明显高于对照组,可见CHD合并SCH患者脂质代谢紊乱情况明显加重,而血脂异常同时又是血管内皮功能损害和斑块形成重要危险因素,提示SCH可能导致CHD病程进展和加重。分析认为SCH还可促进炎症因子表达并与脂质代谢紊乱相互作用,导致血管内皮损伤加重,从而在冠脉粥样硬化过程中发挥重要作用。NO和ET-1均为评估血管内皮功能的重要参考指标[15,16]。本研究中SCH组血清NO明显低于对照组,血清ET-1明显高于对照组,且采用多普勒超声进行检查显示SCH组FMD明显低于对照组,且TSH与NO和FMD具有明显负相关性,同时与ET-1呈明显正相关性,表明SCH可对CHD患者内皮功能相关因子表达造成不利影响,从而导致内皮舒张功能减退,其原因除脂质代谢紊乱外,还可能与甲状腺功能障碍引起的血管慢性炎症反应有关。
冠脉粥样硬化和斑块形成是导致CHD的主要原因,且斑块稳定性是影响患者预后的重要原因,易损斑块破裂风险较高,容易导致血栓形成并引起脑卒中等不良事件,文献报道SCH可能在高龄患者易损斑块形成中发挥重要作用[14]。本研究结果显示SCH组PB、脂核负荷以及易损斑块占比明显高于对照组,纤维帽厚度明显低于对照组,且Pearson积差分析显示TSH与PB和脂核负荷均呈明显正相关性,表明易损斑块形成与脂质代谢紊乱有关。同时本研究分析结果显示吸烟史、TSH、LDL-C、NO和ET-1均为影响易损斑块形成的危险因素。而TSH与LDL-C、NO又与ET-1均存在明显相关性,因此可以推测SCH通过影响脂质代谢和血管内皮功能而增加冠脉粥样硬化和易损斑块形成风险,证实SCH可导致CHD患者脂质代谢紊乱加重,并对血管内皮功能和冠脉斑块稳定性造成不利影响,故对合并SCH的CHD患者需要对甲状腺功能进行监测和干预,同时积极改善脂质代谢和内皮细胞功能,以增加斑块稳定性,降低心脑血管事件发生风险。本研究不足之处为样本容量相对较小,选取时间段较窄且存在区域局限性,可能导致结果存在一定偏倚,因此还需要后续更多临床试验进行证实。
综上所述,SCH可对CHD患者脂质代谢、血管内皮功能和斑块稳定性造成不利影响,增加易损斑块形成风险。
