扁蓿豆MrERF1 的转录激活活性、亚细胞定位及表达分析
2021-07-28雷雨晴张业猛王海庆
雷雨晴,张业猛,王海庆
(1. 中国科学院高原生物适应与进化重点实验室 / 中国科学院西北高原生物研究所,青海 西宁 810001;2. 中国科学院大学,北京 100049;3. 青海省作物分子育种重点实验室,青海 西宁 810001)
干旱、寒冷、高盐和水淹等非生物胁迫是影响植物生长发育和地理分布的重要环境胁迫因子。当受到外界环境的胁迫时,植物会启动多种信号途径,激活转录因子的表达[1]。转录因子通过调控一系列下游靶基因的表达在植物应对不利环境胁迫时发挥重要作用[2]。植物在进化的过程中产生了脱落酸(abscisic acid,ABA)、钙离子和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号转导途径[3]。ABA 与植物干旱、高盐和寒冷等胁迫密切相关,除了通过调节植物的气孔和促进植物体内渗透调节物质的积累来帮助植物适应逆境胁迫外,还参与植物体内离子浓度平衡的调节[4]。ABA信号转导途径可通过激活下游转录因子参与植物逆境胁迫调控[5]。拟南芥(Arabidopsis thaliana) AtABR1转录因子是参与调控ABA 信号途径的乙烯应答因子(ethylene responsive factor,ERF)亚家族成员,Choi等[6]研究表明MAP3K16 可通过磷酸化激活AtABR1转录因子。
植物中抵抗逆境胁迫相关的转录因子有AP2(APETALA 2)/ERF、WRKY、MYB、NAC 和bZIP 等[7]。AP2/ERF 转录因子超家族是植物中最大的转录因子家族之一,包括AP2、ERF、RAV(Related to ABI3/VP1)、DREB (dehydration-responsive element binding protein)和Soloist 亚家族。ERF 亚家族仅包含一个保守的AP2结构域,可与下游基因启动子的GCC-box 结合[8],在植物响应病原菌侵染、高盐、干旱、损伤、低氧和高低温等胁迫时发挥重要调控作用[9-10]。例如,外源性内皮素、ABA 和钙离子可诱导簇毛麦(Haynaldia villosa)ERF1-V的表达,在小麦(Triticum aestivum)中过表达ERF1-V提高了小麦对白粉菌的抗性和对盐、干旱胁迫的耐受性,表明ERF1-V通过参与生物和非生物胁迫的不同信号转导途径发挥作用[11];Zhuo 等[12]从黄花苜蓿(Medicago falcata)中克隆到MfERF1基因,MfERF1的过表达增强了转基因植株的抗寒性和抗氧化活性,进一步研究表明MfERF1可通过调节多胺转运、提高抗氧化酶活性和促进脯氨酸积累来提高转基因植株的抗寒性。此外,ERF 亚家族还参与植物的生长发育和代谢调控。例如,SmERF115是丹参(Salvia miltiorrhiza)中次级代谢产物酚酸生物合成的正向调节转录因子,SmERF115 通过与SmRAS1基因启动子中的GCC-box 结合激活其表达来控制酚酸的生物合成[13];拟南芥中的ERF 亚家族成员AtABR1 转录因子能够响应创伤信号并诱导生长素的合成,促进根的再生[14]。解析ERF 转录因子亚家族成员在植物逆境响应中的功能,对于揭示植物适应逆境机制和农作物抗逆改良具有重要的理论价值和应用前景。
扁蓿豆(Medicago ruthenica)为豆科(Leguminosae)苜蓿属矩荚苜蓿组的多年生草本植物[15],分布于西伯利亚、蒙古国和我国北方高纬度高寒地区[16-17]。其枝叶繁茂,叶片柔软,营养价值高,适口性好,与黄花苜蓿和紫花苜蓿(Medicago sativa)相比,扁蓿豆对包括干旱、寒冷等不利环境具有更强的耐受性,是有望在紫花苜蓿等苜蓿属栽培种无法越冬地区人工驯化利用的优质豆科牧草资源[18]。赵丽丽等[19]通过相对发芽率、相对活力指数和半致死渗透胁迫强度3 个指标对扁蓿豆和黄花苜蓿进行抗旱性鉴定,结果表明在种子萌发期4 份扁蓿豆种质材料的抗旱性均强于黄花苜蓿;于洁等[20]利用复盐溶液模拟盐胁迫对10 份不同地区的野生紫花苜蓿和扁蓿豆材料进行耐盐性综合评价,通过灰色关联分析法和加权隶属函数法等分析表明,扁蓿豆萌发期的耐盐性较紫花苜蓿强。
目前对扁蓿豆的抗逆性研究多集中在形态解剖、生长发育以及生理生化水平[21-22],在分子水平上解释扁蓿豆适应极端逆境的机制,发掘逆境适应相关基因,对于苜蓿属栽培种的抗逆改良具有重要的参考价值。过去10 年中,高通量测序技术的快速发展和检测成本的不断下降,为分离和分析非模式植物中逆境相关基因的功能提供了方便。本研究根据此前低温胁迫转录组测序分析结果,在对青藏扁蓿豆中的一个编码AP2/ERF 转录因子基因MrERF1转录激活活性和亚细胞定位分析的基础上,对其在多种非生物胁迫下的表达模式进行了分析。所获得的结果为今后鉴定该基因在非生物胁迫下的功能提供了信息。
1 材料与方法
1.1 植物材料与处理
扁蓿豆种子由中国农业科学院草原研究所孙启忠研究员提供。将种子用98%浓硫酸处理8 min,无菌水冲洗多次去除残余的硫酸后,置于铺有湿滤纸的培养皿上于4 ℃暗处理24 h,而后转移到21 ℃、16 h光照/8 h 黑暗条件下萌发。3 d 后将发芽种子移栽于蛭石 ∶ 营养土(3 ∶ 1)的混合基质中培养。生长3 周后对幼苗进行非生物胁迫和脱落酸处理。将幼苗置于4 ℃、16 h 光照/8 h 黑暗条件的培养箱中进行低温处理;将整株幼苗洗净后,转移到铺有多层吸透200 mmol·L-1NaCl 溶液的吸水纸的培养皿中进行高盐胁迫处理;脱落酸处理将整株幼苗转移到铺有多层吸水纸的培养皿中,用含有0.05% Tween20 (V/V)的50 μmol·L-1脱落酸溶液喷雾后,封盖以防植株脱水;干旱处理将整株幼苗转移到培养皿中,在室温条件下进行自然脱水;水淹处理将整株幼苗转移到培养皿中并淹没于水中;对照组将整株幼苗转移到铺有多层吸水纸的培养皿中。上述处理在不同时间分别对整株幼苗、幼苗地上部分和根进行取样,液氮速冻后于-80 ℃冰箱中保存备用。此外,将处于开花期的扁蓿豆植株于4 ℃处理8 h 后,收集根、茎、叶、顶芽和花序样品,用于不同器官中的基因转录水平检测。
1.2 MrERF1 基因cDNA 克隆与序列分析
总RNA 提取使用TRIzol 试剂进行,提取的总RNA按照说明利用Recombinant DNase I (TaKaRa,大连)处理去除基因组DNA,cDNA 第一链的合成按照M-MuLV 逆转录试剂盒(生工,上海)的说明操作。根据本实验室前期扁蓿豆低温胁迫转录组测序结果,设计正向引物MrERF-F(5′-TGAAGAGGGACAAG AACTATCG-3′)和反向引物MrERF-R(5′-AATCA TAACGGAAGTAGGGACC-3′),以4 ℃处理8 h 幼苗的cDNA 为模板,使用PyrobestDNA 聚合酶(TaKaRa,大连)进行扩增,扩增产物胶回收后,连接到pBluescript Ⅱ SK+/-载体进行测序。
利用DNAMAN8.0 软件分析核酸序列、编码的氨基酸序列以及开放阅读框;通过NCBI 网站(https://www.ncbi.nlm.nih.gov)进行蛋白序列相似性检索,利用网址(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)查找保守结构域;利用WoLF PSORT网站(https://www.genscript.com/wolf-psort.html)进行核定位信号预测[23];ExPASy 的ProtParam 程序(http://web.expasy.org/protparam/)用于对蛋白质理化性质进行分析;通过SignalP5.0 Server 网站 (http://www.cbs.dtu.dk/services/SignalP)预测该蛋白是否有信号肽;在拟南芥网站(https://www.arabidopsis.org)进行MrERF1保守结构域序列的相似性检索;通过MEGA7.0 软件中Neighbor-Joining 法构建系统进化树,对各个节点的检验使用自举法(Bootstrapping),程序重复1 000 次,其他参数默认。
1.3 转录激活活性验证
根据已测序的MrERF1cDNA 序列设计含EcoRⅠ位点的正向引物ERF1 (5′-GAATTCGGATCCATG CCATTGCCAATGATGTT-3′)和反向引物ERF2 (5′-GAATTCGAGCTCTCACCCTGAGGGAGAGGAG CT-3′),扩增MrERF1基因编码区。扩增的片段测序确认后用EcoR Ⅰ酶切,将酶切后的片段插入到经EcoR Ⅰ酶切后并使用热敏磷酸酶(NEB,北京)处理的pGBKT7 (BD Biosciences,美国)酵母表达载体内,转化DH5α 大肠杆菌感受态,挑选阳性克隆提取质粒,酶切鉴定后,获得重组的酵母表达载体pGBKT7-MrERF1。
通过PEG/LiAc 法[24]将pGBKT7-MrERF1 转化进入酵母AH109 感受态细胞(Clontech,美国),同时转化pGBKT7 空质粒为阴性对照,涂布在SD/-Trp固体培养基中。培养3 d 后挑取单菌落重悬于100 μL灭菌ddH2O 中,分别取2 μL 重悬液点在SD/-Trp 及含X-α-gal (Solarbio,北京)的SD/-His 固体培养基上,根据菌落生长情况及是否变蓝来验证MrERF1的转录激活活性。
1.4 亚细胞定位分析
根据已测序的MrERF1cDNA 序列设计含BamHⅠ位点的正向引物MrERF1 (5′-GAATTCGGATCC ATGCCATTGCCAATGATGTTT-3′)和含KpnⅠ位点的反向引物MrERF2 (5′-GAATTCGGTACCTGAG GGAGAGGAGCTATATC-3′),扩增MrERF1基因编码区。扩增的片段测序确认后用BamHⅠ和KpnⅠ双酶切,将酶切后的片段插入到经BamHⅠ/KpnⅠ双酶切的PBI121-EGFP 载体内,转化DH5α 大肠杆菌感受态,挑选阳性克隆提取质粒,酶切鉴定后,获得重组表达载体35S∶∶MrERF1∶EGFP。
将构建好的35S∶∶MrERF1∶EGFP 重组载体及35S∶∶EGFP 阴性对照载体分别转化农杆菌C58C1感受态细胞。挑选阳性单克隆菌落于含50 μg·mL-1Kan 和25 μg·mL-1Gent 的LB 液体培养基中28 ℃震荡培养至OD600为0.6。离心收集菌体,用0.5 mol·L-1的2-N-吗啡乙磺酸(2-morpholinoethanesulfonic acid,MES) (pH = 5.7)、1 mol·L-1的MgCl2和100 mmol·L-1的乙酰丁香酮(pH = 5.7)配制的溶液重悬菌体使重悬液OD600为0.5。用无针头注射器吸取重悬液于叶背面注入生长3 周的本氏烟草(Nicotiana benthamiana)叶片内,在黑暗条件下培养3 d 后于荧光显微镜下观察叶片细胞中荧光的分布。
1.5 MrERF1 基因的表达分析
在不同非生物胁迫和ABA 处理下分别用整株扁蓿豆幼苗、幼苗的地上部分和根为样品分析MrERF1的表达。将材料中所述样品合成cDNA,稀释至100 ng·μL-1为模板,用TaqDNA 聚合酶(TaKaRa,大连)进行半定量RT-PCR,反应体系20 μL。扩增反应条件:94 ℃预变性3 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,共计35 个循环;72 ℃延伸10 min。MrERF1基因的上游引物和下游引物分别为MrERF-F (5′-TGAAGAGGGACAAGAACTAT CG-3′)和MrERF-R (5′-AATCATAACGGAAGTAG GGACC-3′),Actin基因的上游引物和下游引物分别为MrActin-F (5′-TGCTTCTAACTGAGGCTCCAC T-3′)和MrActin-R (5′-AAAGGACTTCTGGGCAA CG-3′)。反应完成后使用浓度为0.7%的琼脂糖凝胶电泳检测。
2 结果与分析
2.1 MrERF1 基因的克隆和生物信息学分析
根据已有的扁蓿豆转录组测序数据设计引物,采用反转录聚合酶链式反应(Reverse transcriptionpolymerase chain reaction,RT-PCR)方法从低温处理8 h 的扁蓿豆幼苗中扩增得到约1 200 bp 的特异片段,将其命名为MrERF1(GenBank 登录号:MW600721)。测序结果显示该cDNA 长1 225 bp,开放阅读框为948 bp,编码316 个氨基酸。MrERF1 的氨基酸序列在NCBI 网站上查询,发现MrERF1 含有1 个AP2保守结构域(图1A),具有ERF 转录因子亚家族成员的特性,与蒺藜苜蓿(Medicago truncatula)、大豆(Glycine max)、红车轴草(Trifolium pratense)、鹰嘴豆(Cicer arietinum)等豆科植物ERF 家族成员高度同源;对MrERF1 的核定位序列预测表明,在78~81位(KRRR)、141~147 位(PKRKYRG)存在核定位信号(图1A);用DNAMAN8.0 软件进行的氨基酸序列比对结果显示(图1A),比对的序列均含有一个AP2保守结构域,其中与蒺藜苜蓿同源蛋白的相似性达91%。采用ProtParam 工具预测MrERF1 蛋白的分子量为35.05 kDa、理论等电点为6.45,其中阴性氨基酸(Asp + Glu) 30 个、阳性氨基酸(Arg + Lys) 28 个,总平均亲水性-0.81,属于亲水性蛋白。信号肽预测结果表明,MrERF1 不含信号肽。
用MEGA7.0 对豆科同源ERF 蛋白氨基酸序列构建系统进化树(图1B),表明MrERF1 与蒺藜苜蓿ERF 蛋白的亲缘关系最近。在拟南芥网站对MrERF1保守结构域进行序列相似性检索,用MEGA7.0 对拟南芥同源蛋白的AP2 保守结构域序列构建系统进化树(图1C),表明MrERF1 与拟南芥中AtABR1同源性最高。

图1 MrERF1 序列分析Figure 1 Sequence analysis of MrERF1
2.2 MrERF1 转录激活活性分析
将转pGBKT7-MrERF1 质粒和pGBKT7 质粒的酵母菌液分别点在SD/-Trp 和含X-α-gal 的SD/-His固体培养基上培养3 d 后,酵母生长情况如图2 所示。在SD/-Trp 固体培养基上,转化质粒的两个酵母均能够正常生长;在含X-α-gal 的SD/-His 固体培养基上,转pGBKT7 质粒的酵母不能正常生长,而转pGBKT7-MrERF1 质粒的酵母能够正常生长并且变蓝。

图2 MrERF1 转录激活活性验证Figure 2 Validation of MrERF1 transcriptionalactivation activity
2.3 MrERF1 蛋白的亚细胞定位
本氏烟草叶片瞬时表达结果显示(图3),35S 驱动下的增强型绿色荧光蛋白(Enhanced green fluorescent protein,EGFP) (35S∶∶EGFP)的荧光信号分布于整个叶片细胞中,而MrERF1 与EGFP 的融合蛋白(35S∶∶MrERF1∶EGFP)其荧光信号分布于叶片细胞核上。亚细胞定位结果表明,MrERF1 转录因子定位于细胞核。
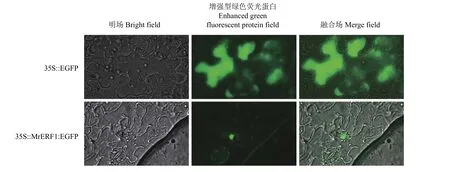
图3 MrERF1 的亚细胞定位Figure 3 Subcellular localization of MrERF1
2.4 MrERF1 表达模式分析
2.4.1MrERF1在不同组织中及光周期下的表达
此前转录组测序分析发现MrERF1受到低温诱导表达,为了揭示不同组织中MrERF1的表达情况,以4 ℃处理8 h 的扁蓿豆各组织为样品进行半定量RT-PCR 分析。结果显示(图4A),MrERF1不在根中表达,在茎、叶、芽和花序中均有表达。由于植株地上部分易受到光刺激,为了探究MrERF1的表达是否受光周期或者生物节律的影响,对室温下正常生长的扁蓿豆植株地上部分组织进行半定量RT-PCR分析。结果表明(图4B),MrERF1的表达不受光周期或生物节律的调节。
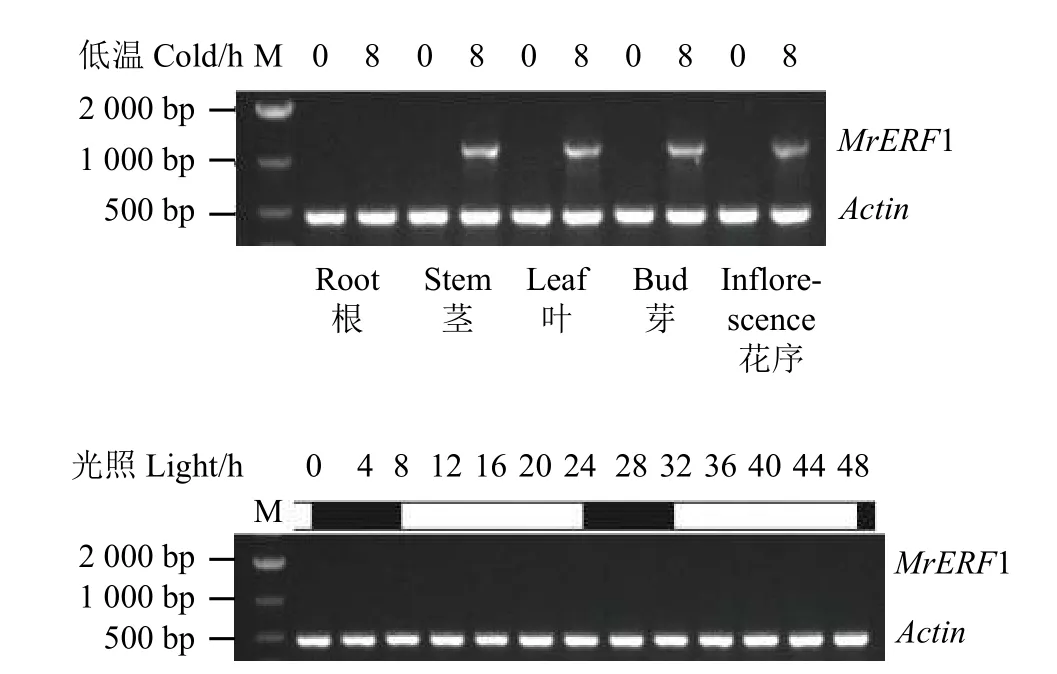
图4 MrERF1 基因在各组织中及光周期下的表达Figure 4 Expression of MrERF1 in various tissues and photoperiod
2.4.2MrERF1在不同非生物胁迫和ABA 处理下的表达
为了进一步探讨不同非生物胁迫和ABA 处理对MrERF1表达的影响,对低温、高盐、干旱、水淹和ABA 处理以及对照组的整株扁蓿豆幼苗进行半定量RT-PCR 分析。结果显示(图5A),除对照组外MrERF1的表达均受到了诱导,并且其表达均呈现先上调后下调的趋势;在ABA、水淹、高盐、干旱和低温处理后MrERF1受到诱导开始表达的时间分别为0.5、0.5、1、1、8 h。
此外,之前的研究结果表明,在低温处理下MrERF1不在根中表达,因此对扁蓿豆幼苗进行除低温外的ABA、高盐、干旱和水淹处理后,分别以幼苗的根和地上部分为样品对MrERF1转录本检测发现(图5B),不同处理下MrERF1在扁蓿豆幼苗的地上部分表达,不在根中表达。
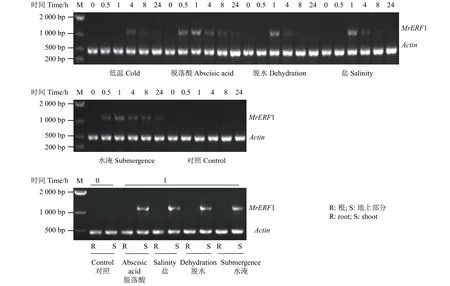
图5 MrERF1 基因在不同非生物胁迫和ABA 处理下的表达Figure 5 Transcription response of MrERF1 gene to abiotic stress and ABA treatment
3 讨论与结论
本研究从低温处理8 h 的扁蓿豆中克隆到了MrERF1基因,对其编码的蛋白序列进行同源比对分析,结果表明其含有一个保守的AP2 结构域,属于ERF 亚家族。与拟南芥中同源ERF 蛋白的AP2结构域构建系统进化树表明,MrERF1 与拟南芥中AtABR1 同源性最高。在酵母中的研究结果表明,报告基因HIS和LacZ的转录被激活,MrERF1 与拟南芥AtABR1[25]相同且具有转录激活活性,而其激活活性序列在N 端或C 端有待进一步研究。亚细胞定位结果表明MrERF1 属于核定位蛋白,与AtABR1蛋白的亚细胞定位结果一致[26],具有典型的转录因子特性。
MrERF1的组织特异性表达分析结果与AtABR1不同。MrERF1不在根中表达,在茎、叶、芽和花序中均有表达且不受光周期或生物节律的调节;而AtABR1在拟南芥所有器官中均表达,在角果和种子中的表达量非常低[27]。张文慧等[28]对白桦(Betula platyphylla)bERF1/2/3的3 个基因研究表明,在高盐胁迫下,bERF1基因在根、茎、叶中的表达均呈下调趋势;bERF2的表达在叶中呈上调趋势、根中呈下调趋势而在茎中无明显变化;bERF3的表达在茎和叶中呈上调趋势,在根中无明显变化。这表明,尽管这些基因均属于ERF 亚家族成员,但在不同植物组织中的表达模式存在差异,在植物生长发育过程中发挥着不同的功能。
拟南芥AtABR1 蛋白最初被Pandey 等[27]报道为ABA 信号通路负调控因子,在拟南芥中AtABR1蛋白是与MrERF1 同源性最高的ERF 蛋白。本研究表明在ABA、脱水、高盐和低温处理下,MrERF1的表达均受到了诱导,这与Pandey 等[27]对相同处理下AtABR1表达的研究结果一致,表明MrERF1 蛋白与AtABR1 蛋白可能具有同源功能。最近Bäumler等[29]研究表明AtABR1还受到水淹诱导表达。与Pandey 等[27]研究结果不同的是,Bäumler 等[29]认为AtABR1不参与ABA 信号转导并且与干旱胁迫响应无关,而是幼苗从花盆中取出时受到损伤诱导其表达,因此本研究在对扁蓿豆进行处理时使用整株幼苗且轻柔操作避免幼苗受到损伤胁迫,高盐和ABA处理的幼苗避免受到水淹胁迫。半定量RT-PCR 结果显示,对照组中MrERF1的表达没有受到诱导,这表明不同处理下MrERF1的表达没有受到损伤诱导的影响,因此推测MrERF1基因参与了依赖于ABA 的逆境胁迫信号转导途径,这更倾向于Pandey 等[27]的研究结果。水淹是一种复合胁迫,除了会引发低氧胁迫外还可能引起植物营养缺乏、机械胁迫和增加感染风险等[30]。当植物遭受水淹时会迅速积累高水平的植物激素乙烯引发进一步的信号级联[31],因此还可对扁蓿豆进行乙烯、茉莉酸甲酯和水杨酸等处理进一步分析MrERF1的表达。
综上所述,本研究克隆了扁蓿豆ERF 转录因子基因MrERF1,开放阅读框为948bp,编码316 个氨基酸。MrERF1编码的蛋白定位于细胞核且具有转录激活活性。半定量RT-PCR 结果表明MrERF1的转录与光周期和生物节律无关且存在组织特异性表达;MrERF1受到高盐、干旱、水淹、低温和脱落酸的诱导表达。尽管MrERF1在扁蓿豆的发育过程中的调控作用仍未知,但可以推测MrERF1在调节扁蓿豆抵抗干旱、高盐、低温等非生物胁迫中行使了一定的功能。本研究为MrERF1转基因功能验证奠定了基础,有助于进一步揭示扁蓿豆非生物胁迫响应的分子机制,对扁蓿豆抗逆种质资源的进一步应用及苜蓿属牧草的抗逆育种具有重要意义。
