黄土高原雨养区苜蓿种植年限对土壤固碳细菌丰度和活性有机碳组分的影响
2021-07-28蔡雪梅潘占东罗珠珠李玲玲牛伊宁蔡立群刘家鹤
蔡雪梅,潘占东,罗珠珠,2,李玲玲,牛伊宁,蔡立群,2,刘家鹤
(1. 甘肃农业大学资源与环境学院,甘肃 兰州 730070;2. 甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;3. 甘肃农业大学农学院,甘肃 兰州 730070)
西部黄土高原雨养区是中国乃至世界水土流失最严重的地区之一,严重的水土流失不仅破坏生态环境,而且降低土壤质量并减少土壤碳固存[1-2]。紫花苜蓿(Medicago sativa)根系具有较强的根瘤固氮作用,能够增加土壤有机质和氮含量,改善土壤团粒结构,对于西北生态脆弱区的生态修复和土壤质量提高起着极为重要的作用[3]。但是,作为多年生牧草,苜蓿持续种植一定年限后会导致草地严重退化[4]、地面覆盖度与产量下降,再加上刈割时地上生物量被大量带走,苜蓿枯枝落叶对土壤的归还量减少,土壤有机碳含量降低,因此苜蓿种植年限对土壤固碳效应有一定的影响。有研究表明,苜蓿地土壤固碳潜力随着种植年限的延长而逐渐增加,但增长速度不显著[5]。也有研究表明,紫花苜蓿土壤有机碳含量在种植5~10 年时为增长期,之后呈现降低趋势[6]。目前对于苜蓿地土壤碳库的研究主要集中在分析土壤总有机碳含量的变化上[3,6],而对土壤活性有机碳组分变化的分析相对较少。土壤活性有机碳(可溶性有机碳、易氧化有机碳和微生物生物量碳)是土壤有机碳库中最为活跃的组分,其含量较少,但受植物、微生物、土壤环境等影响强烈,降解速率较快,常被认为是评价农田管理措施的早期敏感指标[7],对于研究土壤质量变化及碳循环具有重要意义。
自养微生物广泛分布在农田生态系统中,具有同化固定CO2并将其转化为土壤活性有机碳的潜力[8-9]。卡尔文循环是自养微生物固定大气CO2的主要途径[7,10],1, 5-二磷酸核酮糖羧化酶/加氧酶(RubisCO)是该循环的限速酶和关键酶[11-13],cbbL基因是RubisCO 酶的编码基因[14]。RubisCO 酶及其编码基因cbbL已被许多研究者在环境样品和光合细菌中进行了大量研究[15-17]。近年来,其在农田生态系统中的研究已成为热点课题[18]。研究表明,不同的土壤类型[19]、植被类型[9]和施肥方式[20]会影响土壤cbbL基因丰度和多样性,并且RubisCO 酶活性可以作为衡量土壤自养微生物碳同化潜力的指标[21]。王蕊等[22]研究发现,林地转型耕地会使土壤cbbL基因丰度降低,并导致土壤cbbL细菌群落结构发生改变。曹煦彬等[13]研究表明,土壤微生物参与了固碳过程,而且RubisCO 酶及cbbL基因与土壤碳组分具有密切的关系。刘琼等[18]在稻田土壤中发现,不同稻田土壤碳同化微生物群落结构存在显著差异,有机碳是功能基因cbbL群落组成的显著影响因素。另外,Stevenson[23]研究发现,农田土壤有机质降解缓慢,其变化也存在一定的滞后性,因而并不利于短期研究。依托设置在陇中黄土高原雨养区的长期定位试验,罗珠珠等[2]前期已初步开展了不同年限苜蓿地土壤碳组分的相关研究,结果表明,紫花苜蓿对土壤表层有机碳组分的提高只有达到一定种植年限之后才会表现出明显的累积效果,但未能深入到土壤微生物层面揭示相关固碳机理。因此,本研究基于固碳微生物视角,量化分析土壤固碳细菌丰度和土壤活性有机碳组分变化特征,探讨土壤固碳功能基因cbbL丰度与活性有机碳组分及RubisCO 酶活性之间的关系,并耦合土壤理化因子解析影响cbbL基因丰度和土壤活性有机碳组分的关键因子,揭示雨养农业区土壤自养微生物碳同化的机制,以期为深入了解苜蓿地土壤碳循环过程、增加土壤固碳潜力提供数据支撑。
1 材料与方法
1.1 试验地概况
试验区位于黄土高原半干旱丘陵沟壑区的定西市安定区李家堡镇麻子川村(35°28′ N,104°44′ E)。该区属中温带半干旱区,平均海拔2 000 m,年均日照时数2 476.6 h,年均太阳辐射592.9 kJ·cm-2,年均气温6.4 ℃,≥ 0 ℃年积温2 933.5 ℃·d,≥ 10 ℃年积温2 239.1 ℃·d;无霜期140 d,年均降水量390.9 mm,年蒸发量1 531 mm,为典型的雨养农业区。土壤为典型的黄绵土,土质疏松,土层分布均匀深厚。
1.2 试验设计
试验以2003 年(18 年,T1)、2005 年(16 年,T2)、2012 年(9 年,T3)、2019 年(2 年,T4)建植的紫花苜蓿草地为研究对象,以农田作为对照(CK),共设5 个处理,每个处理3 次重复,小区面积为3 m × 7 m。苜蓿所选品种均为当地传统种植品种陇东苜蓿,播量18 kg·hm-2,行距20 cm。农田为当地主栽作物玉米(Zea mays)地,自2013 年开始连续每年播种玉米,参试品种为先玉335,种植密度为5.25 万株·hm-2,施纯氮200 kg·hm-2,纯P2O5105 kg·hm-2,所有肥料在播种时一次施入,生育期不进行追肥。苜蓿草地建植时施纯氮105 kg·hm-2,纯P2O5105 kg·hm-2,后期均未进行施肥、灌水。
1.3 样品采集与指标测定
于2020 年6 月下旬(苜蓿第1 茬盛花期和玉米拔节期)进行采样,每个试验小区采用五点取样法,首先将0 - 5 cm 的表层土壤去除(去除地表枯枝落叶层),再取耕层5 - 20 cm 根区土壤,待5 个采样点全部取完后充分混合,剔除其中可见的石块、根和动植物残体。将土样分为3 份,一份装入灭菌的离心管中,在田间放入有冰袋的泡沫盒中带回实验室置于-80 ℃冰箱中保存,用于DNA 提取;一份土样放入4 ℃冰箱用于土壤活性有机碳组分和RubisCO酶活性测定;剩余一份土样待风干后分别过2、1 和0.149 mm 筛用于土壤理化性质的测定。
土壤pH 采用土水比1 ∶ 2.5 电位法测定[24];土壤含水率用烘干法测定[24];土壤总有机碳采用重铬酸钾-浓硫酸外加热法测定[24];土壤可溶性碳采用0.5 mol·L-1K2SO4浸提(土水比1 ∶ 4)土样,浸提液经0.45 μm 滤膜过滤后,滤液上碳氮联合分析仪(Jena multi N/C 2100s, Germany)进行测定[25];土壤易氧化有机碳采用333 mmol·L-1高锰酸钾氧化法测定[26];土壤微生物量碳采用氯仿熏蒸,0.5 mol·L-1K2SO4浸提(土水比1 ∶ 4),碳氮联合分析仪测定[27];全氮采用H2SO4消煮-凯氏定氮法测定[24];全磷采用H2SO4-HClO4酸消煮,钼锑抗比色法测定[24];速效磷采用0.5 mol·L-1NaHCO3浸提,钼锑抗比色法测定[24];硝态氮采用2 mol·L-1KCl 溶液浸提(土水比1 ∶ 10),半自动化学间断分析仪(Smart Chem AST-6500S)测定[28]。
土壤中RubsiCO 酶活性测定采用超声波破碎法提取土壤中的蛋白质,用紫外分光光度计在340 nm波长下进行测定[13]。
土壤固碳基因cbbL定量分析:土壤总DNA 采用FAST DNA(116560-200, MP Biomedicals)提取试剂盒提取,所提取的DNA 纯度用1.0%琼脂糖凝胶电泳跑胶,再用凝胶成像仪(JY04S-3C,北京君意东方电泳设备有限公司)测定。通过实时荧光定量PCR 仪(博日,LineGene9600plus)对cbbL基因数量进行定量分析,所采用引物为K2F( ACCAYCAAG CCSAAGCTSGG),V2R(GCCTTCSAGCTTGCCSACC RC)。反应条件:95 ℃预变性3 min;95 ℃变性30 s;60 ℃退火30 s;72 ℃延伸40 s,35 个循环。反应体系(20 μL):10 μL,上游和下游引物(5 μmol·L-1)各0.4 μL,DNA 模板2 μL,无菌水补充至20 μL。
1.4 数据处理
采用Excel 2010 和Sigmaplot 12.5 软件分别进行数据处理和作图,采用SPSS 19.0 软件中的单因素方差分析(One-way ANOVA)检验不同处理下土壤基本理化性质、RubisCO 酶活性、固碳基因cbbL丰度及土壤活性有机碳组分的显著性,用邓肯法(Duncan)法在P< 0.05 水平进行不同处理间上述数据的差异显著性比较;采用皮尔逊(Pearson)法和逐步回归分析法分析cbbL基因丰度与环境因子(土壤基本理化性质、土壤活性有机碳组分和RubisCO 酶活性)之间的关系;用Canoco 5.0 软件冗余分析(redundancy analysis, RDA)模块分析土壤总有机碳和活性有机碳组分与环境因子(土壤基本理化性质和RubisCO 酶活性)之间的关系。
2 结果与分析
2.1 种植年限对苜蓿地土壤基本理化性质的影响
不同处理土壤基本理化性质(表1)显示,土壤水分的变化范围为14.24%~20.49%,各年限苜蓿处理的土壤水分均显著低于农田(P< 0.05),但不同种植年限对苜蓿地土壤水分无显著影响(P> 0.05)。土壤全氮在0.96~1.28 g·kg-1,除了2 年苜蓿地外其余种植年限苜蓿地土壤全氮均显著高于农田(P<0.05);研究同时发现,土壤全氮呈现出随苜蓿种植年限延长而增加的趋势,表现为18 年显著高于其他年限(P< 0.05),较2、9 和16 年分别显著增加了33.33%、13.27%和11.30%。土壤全磷和速效磷均表现为苜蓿地土壤显著低于农田(P< 0.05),2、9、16和18 年苜蓿地土壤全磷较农田分别降低了9.76%、7.32%、13.41%和12.20%,土壤速效磷较农田分别降低了40.40%、47.05%、48.47%和47.80%;就不同年限苜蓿处理之间而言,全磷含量以9 年苜蓿地最高,16 年苜蓿地最低;速效磷含量表现为2 年苜蓿地显著高于其余年限(P< 0.05)。土壤硝态氮变化范围为11.42~17.41 mg·kg-1,表现为各年限苜蓿地土壤均显著低于农田(P< 0.05),2、9、16 和18 年苜蓿地土壤较农田分别降低了33.66%、34.41%、24.64%和19.93%,且其含量随着苜蓿种植年限的延长而增加。土壤pH 表现为各处理间差异不显著(P> 0.05)。
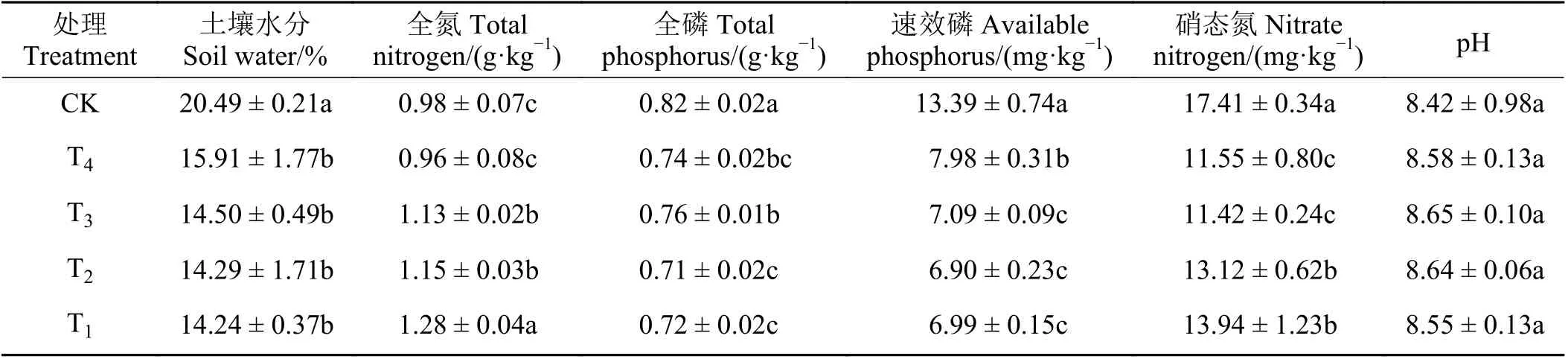
表1 不同处理土壤基本理化性质Table 1 Basic physicochemical properties of soil in different treatments
2.2 种植年限对土壤RubisCO 酶活性及固碳基因cbbL 丰度的影响
不同处理土壤RubisCO 酶活性结果(图1)显示,2 年苜蓿地土壤RubisCO 酶活性显著高于其余处理(P< 0.05),而18 年苜蓿地土壤RubisCO 酶活性显著低于其余处理(P< 0.05),随着苜蓿种植年限的延长RubisCO 酶活性呈降低趋势。
以基因拷贝数作为碳同化功能基因cbbL的绝对丰度(图1),苜蓿地土壤cbbL基因丰度显著高于农田土壤(P< 0.05),且随着种植年限的延长呈增加趋势。土壤干土cbbL基因丰度在(1.12 × 108)~(1.96 × 108)copies·g-1,种植年限为2、9、16 和18 年的苜蓿地土壤cbbL基因丰度较农田土壤分别增加了19.64%、48.21%、47.32%和75.00%。就不同种植年限苜蓿地而言,表现为2 和18 年苜蓿地土壤cbbL基因丰度间存在差异显著(P< 0.05),其余年限间均无显著差异(P> 0.05)。
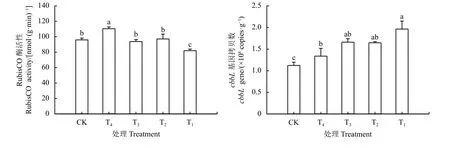
图1 不同处理土壤RubisCO 酶活性与cbbL 基因丰度Figure 1 RubisCO enzyme activity and the abundance of cbbL gene in soil with different treatments
2.3 种植年限对苜蓿地土壤总有机碳和活性有机碳组分的影响
各处理土壤总有机碳变化范围为9.79~11.65 g·kg-1,其中18 和16 年苜蓿地土壤总有机碳显著高于其余处理(P< 0.05),较9、2 年苜蓿地、农田分别增加了11.16%和7.82%、19.00%和15.42%、18.15%和14.60% (图2)。土壤易氧化有机碳含量以18 年的苜蓿地最高(3.22 g·kg-1),农田最低(1.40 g·kg-1),且18 年苜蓿地与其他处理之间差异显著 (P< 0.05),较16、9、2 年苜蓿地和农田分别增加了30.36%、76.92%、98.77%和130.00%,16 年苜蓿地较9、2 年苜蓿地和农田分别显著增加了35.71%、52.47%和76.43% (P< 0.05)。不同处理土壤可溶性有机碳含量介于109.59~134.65 mg·kg-1,18 年苜蓿地与其他处理之间差异显著 (P< 0.05),且较16、9、2 年苜蓿地和农田分别增加了10.52%、12.63%、13.19%和22.87%。土壤微生物量碳变化范围为107.29~250.51 mg·kg-1,各年限苜蓿地土壤微生物量碳均显著高于农田 (P<0.05),不同年限苜蓿处理之间表现为2 年苜蓿地土壤微生物量碳显著低于其余年限 (P< 0.05),较9、16 和18 年苜蓿地分别降低了27.17%、32.26%和30.34%。
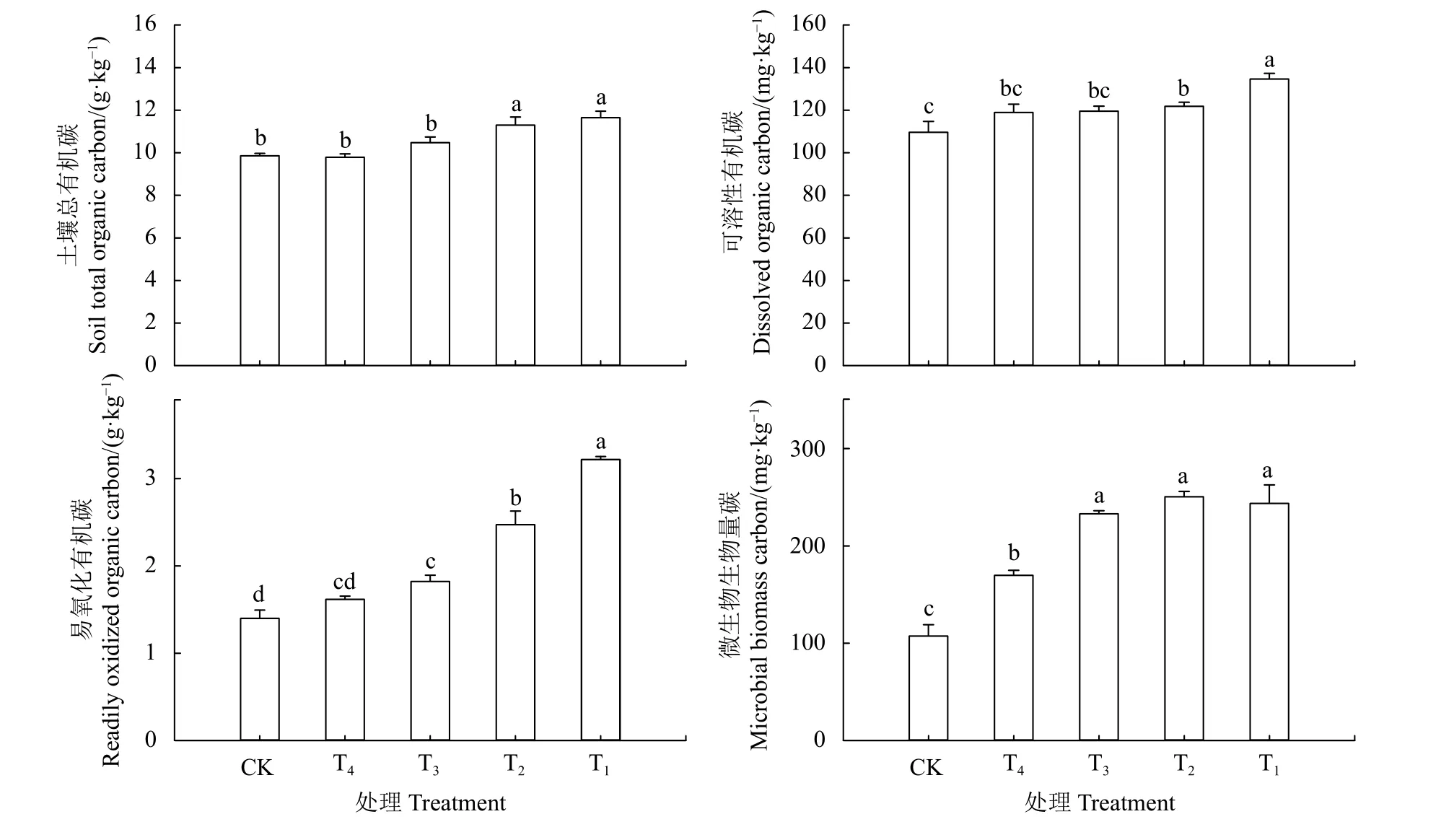
图2 不同处理土壤总有机碳和活性有机碳组分Figure 2 Soil total organic carbon and labile organic carbon fractions in different treatments
2.4 土壤cbbL 基因丰度及活性有机碳组分与环境因子间的关系
2.4.1cbbL基因丰度与土壤理化性质相关分析
对cbbL基因拷贝数与环境因子进行Pearson 相关分析(表2)发现,土壤cbbL基因丰度与pH 呈显著正相关关系(P= 0.012),与土壤总有机碳(P=0.009)、易氧化有机碳(P= 0.001)、可溶性有机碳(P=0.002)、土壤微生物量碳(P= 0.006)和全氮(P= 0.001)呈极显著正相关关系,与土壤水分(P= 0.012)、全磷(P= 0.010)和RubisCO 酶活性(P= 0.024)呈显著负相关关系,与土壤速效磷呈极显著负相关关系(P=0.004)。然而,分析表明,土壤C、N、P 之间存在较强的共线性(表1、表2、图2),于是以cbbL基因拷贝数为因变量,以环境因子为自变量进行逐步回归分析,所得逐步回归方程为cbbL= 0.639TN + 0.345pH(R2= 0.675,F= 12.468,P< 0.01),由此表明,土壤全氮和pH 是固碳功能基因cbbL丰度变化的主要影响因子,二者可以共同解释cbbL基因丰度变化的67.50%。
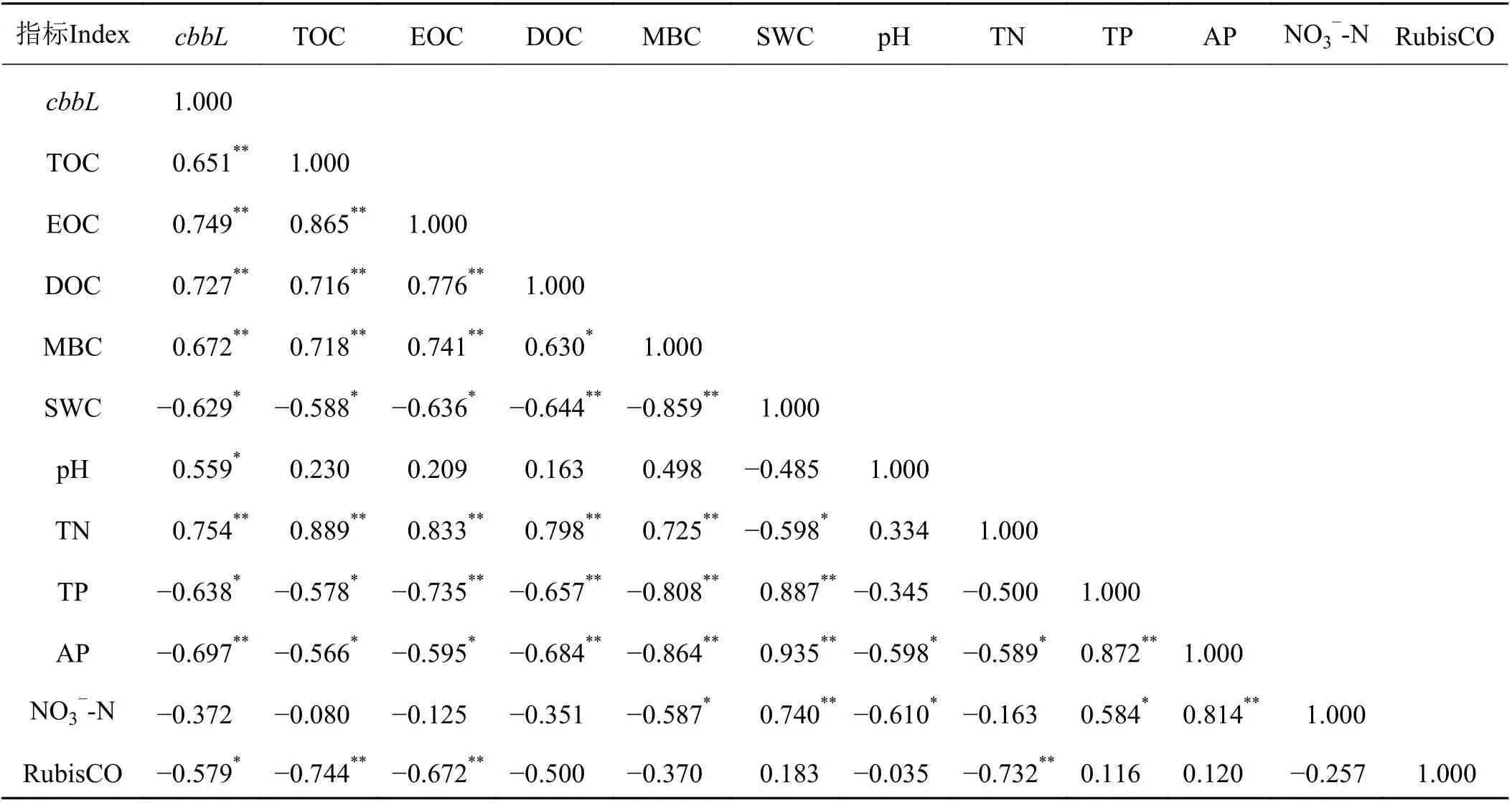
表2 cbbL 基因丰度与环境因子的相关分析Table 2 Correlation analysis between the abundance of cbbL gene and environmental factors
2.4.2 土壤总有机碳和活性有机碳组分与环境因子之间的关系
土壤总有机碳和活性有机碳组分与环境因子RDA 分析(图3)结果显示,环境因子对土壤总有机碳和活性有机碳组分的解释率为89.1%,第一排序轴解释率为80.51%,第二排序轴解释率为7.58%。土壤总有机碳及活性有机碳组分与土壤全氮和pH呈正相关关系,与土壤水分、全磷、速效磷、硝态氮和RubisCO 酶活性均呈负相关关系。土壤水分是影响土壤总有机碳和活性有机碳组分变化的最重要因子,其对方差的解释率为67.3%;全氮对土壤总有机碳和活性有碳组分变化的影响次之,其对方差的解释率为11.8%。
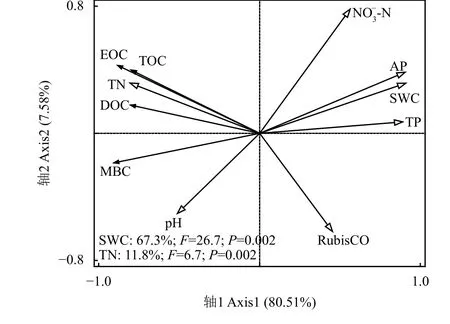
图3 土壤总有机碳和活性有机碳组分与环境因子冗余分析Figure 3 Redundancy analysis (RDA) of soil total organic carbon, labile organic carbon fractions,and environmental factors
3 讨论
3.1 不同种植年限苜蓿地土壤固碳基因cbbL 变化特征
不同生态系统下土壤环境因子的巨大差异会导致土壤固碳细菌丰度差异[29]。本研究中不同种植年限苜蓿地和农田土壤均发育于同一母质,土壤基础理化性质一致,但由于农田和苜蓿地的施肥制度、根系分泌物以及各年限苜蓿的固氮效应不同进而造成土壤理化性质存在一定差异,农田在播种时一次性施入氮肥和磷肥,而苜蓿地只在草地建植初期施肥而后期均不施肥,这使得苜蓿地土壤磷素含量低于农田,但由于苜蓿的固氮作用使其土壤氮含量高于农田,再加上紫花苜蓿是高耗水量作物,连续种植多年后使其土壤水分含量显著低于农田,因而会影响到土壤固碳细菌丰度。本研究中,土壤cbbL基因丰度表现为在苜蓿地均显著高于农田,表明苜蓿地土壤具有较强的固碳潜力,对土壤碳汇贡献较大,这归因于多年生苜蓿极其发达的地下根系、丰富的根系分泌物以及易降解凋落物等为土壤补充了大量碳源和养分。有研究认为,土壤有机碳含量是影响固碳细菌丰度的重要因素[18,30]。本研究表明,土壤cbbL基因拷贝数与土壤总有机碳、易氧化有机碳、可溶性有机碳和微生物量碳均呈极显著正相关关系,因为土壤有机碳的降解能为微生物提供各类无机元素等营养物质和能量,同时其降解过程中释放的大量CO2可以为固碳微生物提供碳源,较高的土壤养分更有利于微生物的生长和繁殖。但刘彩霞等[11]通过研究毛竹(Phyllostachy pubescens)林集约经营对土壤固碳细菌丰度的影响发现,土壤固碳功能基因cbbL丰度与土壤有机碳无显著相关性。这可能由于植被种类、气候条件和土壤类型等不同影响固碳微生物活性,进而影响了土壤有机碳的转化与分配。本研究中土壤cbbL基因丰度虽然随着苜蓿种植年限的延长而增加,但9、16 和18 年苜蓿地之间并无显著差异,结合16 和18 年苜蓿地土壤总有机碳和微生物生物量碳均无明显差异这一现象,可以推测紫花苜蓿种植超过一定年限后土壤固碳量不再增加。土壤理化性质对土壤固碳基因丰度的影响比较复杂[11],有时候几种因子的作用可能会相互抵消从而掩盖某一种或几种土壤因子与固碳基因丰度的关系。因此,不同研究者由于选择的区域不同,难以获得驱动土壤固碳细菌变化因子的一致性规律。本研究相关性分析结果显示,cbbL基因丰度与土壤C、N 和pH 呈正相关关系,与土壤水分和磷素呈负相关关系;进一步逐步回归分析发现,土壤全氮和pH 是影响固碳细菌cbbL丰度的主要因子,这与王蕊等[22]通过研究林地转型耕地对cbbL细菌群落丰度的影响所得结果基本一致。
土壤RubisCO 酶是自养微生物通过卡尔文循环进行CO2同化的关键酶和限速酶,可以用来指示自养微生物固碳潜力的强弱[13]。本研究结果表明,RubisCO 酶活性随着苜蓿种植年限的延长而降低,其中2 年苜蓿地土壤RubisCO 酶活性显著高于农田;相关分析发现RubisCO 酶活性与cbbL基因丰度呈负相关关系,这与Zhou 等[31]的研究结果一致。但Lynn 等[19]研究认为,土壤RubisCO 酶活性与cbbL基因丰度呈正相关关系。这是因为本研究中cbbL基因丰度是在DNA 水平上测定的,通常在DNA 水平上检测到基因的存在并不意味着该基因得到了表达,而在RNA 水平上检测到基因的存在能在很大程度上表明微生物基因处于活性状态[21]。所以,在今后的研究中需要从RNA 水平上对cbbL基因丰度进行研究,还有待进一步验证土壤cbbL丰度与RubisCO 酶活性间的关系。
3.2 不同种植年限苜蓿地土壤活性有机碳组分变化特征
土壤活性有机碳是土壤有机碳库最为活跃的组分,其不仅具有稳定性差、移动性较强的特点,而且易被氧化分解和矿化,能够强烈地制约植物的生长发育,并对土壤微生物活动产生较大的影响[32-34]。虽然其在总有机碳中所占比例并不高,但是在调节土壤养分循环方面发挥着重要的作用[35-36]。苜蓿种植可以提高土壤碳固存,但土壤固碳效应出现峰值的年限因研究区域不同而异。黄土高原半湿润区苜蓿地土壤有机碳从种植5 年到种植10 年为增长期,之后开始降低[6];干旱区沙地过渡带生长4 年的栽培苜蓿草地碳含量最高,并且土壤还出现了“表聚”现象[37]。马其东等[38]研究认为,苜蓿地土壤有机质含量均随种植年限的延长而逐渐增加,但是其增长速率随着生长年限的增加而降低。本研究结果表明,与农田相比,种植苜蓿可以提高土壤有机碳含量,其中种植16 和18 年苜蓿显著提高了土壤总有机碳和3 种活性有机碳组分(易氧化有机碳、可溶性有机碳和微生物生物量碳)含量,种植9 年苜蓿提高了3 种活性有机碳组分,而种植2 年苜蓿仅提高了土壤活性有机碳组分中的微生物量碳含量,这表明紫花苜蓿对土壤有机碳的累积作用受到种植年限的影响,只有达到一定的种植年限后才表现出明显的累积效果,其原因是苜蓿在生长初期为了满足地上部分生长发育对养分的需求,其地下部分就会消耗大量的土壤养分,而此时期其根系几乎不固氮,随着苜蓿种植年限的增加和其生长发育的进行,大量的苜蓿枯枝落叶物归还土壤,且其根部会形成大量的根瘤菌,能够固定空气中的氮素,同时苜蓿根系也会释放一些有机分泌物以及部分根系会死亡腐烂,可以使土壤中的有机碳含量增加[2,39-41]。值得注意的是,本研究发现种植16 和18 年苜蓿土壤总有机碳和微生物生物量碳均无明显差异,说明紫花苜蓿种植超过16 年之后土壤有机碳会维持在一定水平而不再持续增加。但常书娟和张英俊[42]研究发现,苜蓿种植年限越长越有利于土壤固碳,这种研究结果的差异可能与不同研究区域的气候类型、土壤类型等环境因子有关。另外,由于本研究所涉及的苜蓿地最长年限只有18 年,后续延长紫花苜蓿种植年限的固碳效应还有待进一步研究。RDA 分析结果显示,土壤水分和全氮是影响土壤总有机碳和活性有机碳组分的主要因子,主要原因是土壤含水量作为土壤的主要理化性质,对土壤通透性以及微生物活性具有一定影响,进而会影响土壤有机碳的分解速率;另外,土壤全氮和有机碳的消长趋势一致[43],土壤氮素在一定程度上决定了有机碳的含量,而土壤对碳的固持常常受土壤氮水平的制约。
4 结论
在黄土高原雨养区种植苜蓿较农田显著提高了土壤固碳细菌cbbL基因丰度,且cbbL丰度随苜蓿种植年限的延长而增加,RubisCO 酶活性随苜蓿种植年限的延长而降低。与农田相比,种植16 和18 年苜蓿显著提高了土壤总有机碳和3 种活性有机碳组分,种植9 年苜蓿提高了3 种活性有机碳组分,而种植2 年苜蓿仅显著提高了微生物量碳含量,表明紫花苜蓿对土壤有机碳组分的累积作用受到种植年限的影响。逐步回归分析表明,土壤全氮和pH 是cbbL基因丰度的主要影响因素,而土壤活性有机碳组分主要受土壤全氮和水分影响,这对进一步揭示陇中黄土高原雨养区土壤固碳的微生物机制具有重要的参考意义。
