BMP-2对BMSCs放射损伤的保护作用及机制的初步研究
2021-07-28唐子豪宗春琳张维文赵路田磊李德超
唐子豪 宗春琳 张维文 赵路 田磊 李德超
大约75%头颈癌患者需行放射治疗[1],在头颈部放疗并发症中,放射性颌骨骨坏死(ORNJ)是最难治的远期并发症之一。ORNJ可导致皮肤和黏膜溃烂、死骨暴露等,给患者带来巨大痛苦。目前ORNJ发病机制不清、仍缺乏有效的预防及治疗方法。针对ORNJ发病机制,寻找有效的预防及治疗方法,具有重要意义。
自2004年Delanian等[2]提出放射诱导组织萎缩观点后,近些年来,越来越多学者认同ORNJ是一种放射诱导的纤维化疾病[3]。大量文献及本课题前期研究发现,放疗后颌骨局部骨髓间充质干细胞(BMSCs)受损,导致其成骨分化能力下降,并出现肌成纤维细胞(MFB)表型、向成纤维化方向分化,这有可能是导致ORNJ的重要发病机制之一[4-6]。
BMP-2的成骨能力得到广泛公认[7],放射线可抑制BMP-2的表达[8],外源性使用BMP-2可增强放射性颌骨骨坏死的成骨能力[9]。在胰腺等其他器官纤维化疾病的研究中,发现BMP-2有减轻纤维化的作用并且这一作用可能与抑制TGFβ1/Smads通路的表达有关[10],但是在 ORNJ中,BMP-2是否可以抑制放射损伤后BMSCs向成纤维方向分化,尚未见报道。本研究通过检测放射损伤的BMSCs使用BMP-2干预后,成纤维相关蛋白分子的变化情况,探究BMP-2对放射线损伤的 BMSCs的保护作用,并初步探讨 TGFβ1/Smad通路在其中的作用。
1 材料与方法
1.1 大鼠BMSCs来源与培养
BMSCs原代细胞取自于2~3周龄的SD大鼠,麻醉后,无菌条件取出胫骨,使用含有10%胎牛血清α-MEM培养液冲洗骨髓,于培养皿中培养至3~6代用于实验。
1.2 大鼠BMSCs鉴定
成骨与成脂分化诱导:培养细胞加入成骨诱导液诱导21 d后,进行茜素红染色。培养细胞加入成脂诱导液诱导18 d后,进行油红O染色。
细胞表面抗体检测:选取长势良好、形态均一的P4代 BMSCs,加入 CD29-PerCP、CD45-FITC、CD90-PE-CyTM7单克隆抗体,制成单细胞悬液后使用流式细胞仪检测。
1.3 细胞模型建立
采用课题组前期的建模方法进行[11]。使用放射线对BMSCs进行照射,放射源为咸阳第二一五医院放疗科CX576型放射治疗机(VARIAN,美国),射线性质为高能X射线,设置射线能量为6 MeV,剂量率为4 Gy/min,单次剂量为 4 Gy。
1.4 细胞的分组、诱导
为选出BMP-2最佳剂量,对放射后BMSCs分别使用25、50、100、250 ng/mL的 BMP-2,作用 7 d,并使用 Western blot检测其 α-SMA的表达[12]。
将BMSCs分为对照组、放射组、BMP-2组、BMP-2+头蛋白(Noggin)组。对照组不接受放射线照射;放射组使用4 Gy放射线照射;BMP-2组在使用4 Gy放射线照射后使用100 ng/mL BMP-2作用7 d;BMP-2+Noggin组在BMP-2组基础上增加200 ng/mL的BMP-2拮抗剂Noggin(PrimeGene,上海)。使用Western Blot检测各组α-平滑肌肌动蛋白(α-SMA)、Col-Ⅲ、TGF-β1、Smad2/3、pSmad2/3的表达;使用免疫荧光检测Col-Ⅰ、Col-Ⅲ的表达;使用RT-PCR检测α-SMA的表达。
1.5 统计学方法
用GraphPad Prism进行数据分析,student-t检验进行统计学分析,P<0.05为差异具有统计学意义。
2 结 果
2.1 BMSCs的鉴定
培养的BMSCs(图1A),成脂诱导后脂肪细胞形成,累计脂滴呈串珠状,油红O染色呈鲜红色(图1B);成骨诱导后可见茜素红染色矿化结节呈红色(图1C);流式细胞仪检测结果显示BMSCs中CD29、CD90表达阳性率分别为100%、99.9%,而 CD45阳性率0.8%(图1D)。

A:BMSCs形态(×40);B:油红O染色(×200);C:茜素红染色(×40);D:流式细胞仪检测图1 体外培养的BMSCs的鉴定A:BMSCs morphology(×40);B:Oil red O staining(×200);C:Alizarin red staining(×40);D:Flow cytometry analysisFig 1 Identification of in vitro cultured BMSCs
2.2 BMP-2作用剂量测定
Western blot检测不同浓度BMP-2作用后放射损伤BMSCs中α-SMA的表达,发现100 ng/mL的BMP-2作用后,α-SMA表达量最低,且与对照组相比,P<0.05(图 2)。

图2 BMP-2对BMSCs中α-SMA表达的影响Fig 2 The effect of BMP-2 on α-SMA expression in BMSCs
2.3 成纤维相关蛋白分子的表达变化
Western blot结果表明,放射组BMSCs中α-SMA、Col-Ⅲ表达量高于对照组,BMP-2组表达量与放射组相比显著降低(P<0.05);BMP-2+Noggin组表达量与放射组无统计学差异(图3)。

图3 Western blot检测各组细胞中α-SMA和Col-Ⅲ的表达Fig 3 Western blot analysis of α-SMA and col-Ⅲ expression in BMSCs of the groups
免疫荧光方法检测各组Col-Ⅰ、Col-Ⅲ的表达,结果显示放射组Col-Ⅰ和Col-Ⅲ的表达均显著高于对照组(P<0.01),BMP-2组 Col-Ⅰ和 Col-Ⅲ的表达显著低于放射组(P<0.01)、与对照组相比无统计学差异(P>0.05),BMP-2+NOGGIN组Col-Ⅰ和 Col-Ⅲ的水平显著高于BMP-2组(P<0.01)、而与放射组相比无统计学差异(P>0.05)(图 4)。

图4 免疫荧光法测量Col-Ⅰ和Col-ⅢFig 4 Immunofluorescence for measuring Col-Ⅰ and Col-Ⅲ expression in BMSCs of the groups
RT-PCR结果表明,放射后 α-SMA扩增倍数升高,BMP-2组α-SMA扩增倍数较放射组显著降低(P<0.05),BMP-2+NOGGIN组 α-SMA扩增倍数高于BMP-2组(图 5)。
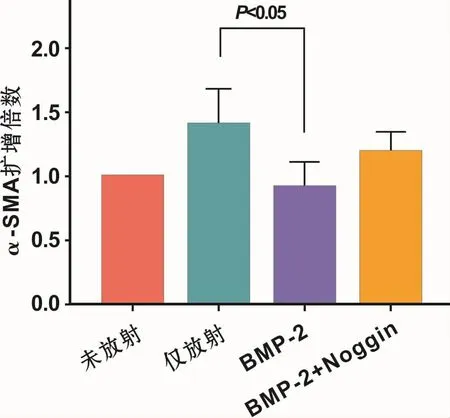
图5 RT-PCR法测量各组BMSCs中α-SMA的表达Fig 5 α-SMA expression in BMSCs of the groups examined by RT-PCR
2.4 TGF-β1/Smad通路的表达变化
Western blot检测结果表明,如图6所示,BMP-2组中TGF-β1、p-Smad2、p-Smad3表达量均较放射组降低(P<0.05),BMP-2+Noggin组中 TGF-β1、p-Smad2、p-Smad3表达量与放射组无统计学差异(P>0.05)(图6)。

图6 Western blot法检测各组BMSCs中TGF-β1/Smad相关蛋白表达量Fig 6 Western blot analysis of TGF-β1/Smad pathway related protein expression in BMSCs of the groups
3 讨 论
ORNJ是头颈癌患者放疗后常见的一种远期并发症,治疗棘手、发病机制不清,目前大量的研究认为,ORNJ是一种放射诱导的纤维化疾病,与放射损伤后局部组织内干细胞受损、成骨能力下降以及纤维化基质堆积有关。有研究表明,应用BMP-2对ORNJ具有一定的治疗作用并且与促进ORNJ病变组织内成骨分化有关,而BMP-2在一些其他纤维化疾病如胰腺纤维化等中,可抑制纤维化的形成,从而对纤维化疾病具有一定的治疗作用[10]。但是,BMP-2对ORNJ的治疗是否与抑制纤维化有关,目前尚未见研究报道。因此,本研究通过建立BMSCs放射损伤模型,检测BMP-2作用后纤维化相关分子以及TGF-β1/Smads通路的表达变化情况,以明确BMP-2对放射损伤BMSCs成纤维分化的抑制作用,并初步探讨其可能的机制。
BMP-2在肺等其他组织纤维化疾病中能够抑制α-SMA的表达,减轻纤维化[13]。本研究发现,使用BMP-2作用于放射后 BMSCs,可显著降低 α-SMA、Col-Ⅰ、Col-Ⅲ的表达,表明BMP-2可抑制放射损伤BMSCs向成纤维化分化、减少放射后细胞外基质的堆积,这可能是BMP-2治疗ORNJ的重要机制之一。
近年越来越多的研究表明,TGF-β1在纤维化进程中起到重要作用,已成为公认的器官纤维化治疗靶标[14]。有研究表明,在肾的炎症、纤维化反应中,BMP-2可通过抑制Smad2/3磷酸化而拮抗TGF-β1的作用,最终抑制肾脏纤维化[15]。本研究发现,BMP-2可明显抑制放射损伤BMSCs中TGF-β1及p-Smad2/3的表达,表明BMP-2抑制放射损伤BMSCs的成纤维化能力,可能与TGF-β1/Smad途径相关。
通过本研究,发现BMP-2可抑制放射损伤BMSCs中的纤维化相关分子、TGF-β1及其下游分子的表达。由此推测,BMP-2除了可增强放射损伤后BMSCs的成骨分化能力,还可能通过抑制TGF-β1/Smad信号通路从而减轻其向成纤维方向分化。本研究进一步阐明了BMP-2在ORNJ治疗中的机制,可为提高BMP-2对ORNJ的治疗效果提供理论依据。仅管BMP-2在体外培养的放射损伤BMSCs中具有抗纤维化作用,但BMP-2在ORNJ组织中抗纤维化的具体机制并不清楚,还需要通过更多的体内外实验进一步研究BMP-2在ORNJ中的抗纤维化作用。
