长链非编码RNA LINC01197调节胃癌进展的机制研究
2021-07-28查全斌束永前田声望
马 佩,方 圆,查全斌,束永前,田声望*
1江苏大学附属金坛医院肿瘤科,江苏 常州 213200;2南京医科大学第一附属医院肿瘤科,江苏 南京 210029
胃癌是当前严重威胁人类健康的恶性肿瘤之一。2018 年全球胃癌新发病例1 810 万,居恶性肿瘤第5 位;新发死亡病例960 万,居恶性肿瘤第3位。东亚地区是全世界胃癌发病率最高的地区,远远超过第2 位。而我国作为东亚地区最大的国家,胃癌防控形势严峻。据《中国肿瘤登记年报2018》报道,2014 年全国胃癌发病率为19.8/10 万,居恶性肿瘤第2 位;死亡率为13.5/10 万,居恶性肿瘤第3位。国家癌症中心预测2020 年我国胃癌发病率将高达24.3/10万[1]。
近年来,随着分子生物学、消化内镜和医学影像、医学病理等技术的发展和健康意识的提升,早期胃癌的诊断和治疗有了很大的改善,但是,靶向药物、免疫检查点抑制剂等新型药物的临床应用并未明显改善进展期胃癌的总体预后,进展期胃癌的诊治仍是一个难点。侵袭和转移是导致晚期胃癌患者死亡的主要原因[2]。因此,研究胃癌的发生及侵袭、转移机制有助于胃癌的早期诊断、靶向治疗及改善预后,从而提高患者生存率。
长链非编码RNA(long non-coding RNA,lncRNA)是长度超过200 bp 的非编码RNA。近来研究发现它们能通过调控基因转录、RNA的剪接等方式参与肿瘤等多种重大疾病进展[3-7]。LINC01197 是被发现的lncRNA 之一,其位于15q26.2,长度为1 445 个碱基。研究发现,LINC01197与胰腺癌进展相关,其低表达提示胰腺癌患者预后差,并且LINC01197 的低表达可通过Wnt/β-catenin 信号通路调控抑制胰腺癌细胞增殖[8-9]。那么,LINC001197 在胃癌等其他消化系统肿瘤中有什么作用?本研究通过生物信息学分析发现LINC01197 在胃癌组织中高表达,并通过敲低胃癌细胞中LINC01197 的表达,进一步探讨LINC01197 对胃癌细胞增殖、侵袭与转移能力的影响,并对可能的分子机制进行初步探究。
1 材料和方法
1.1 材料
BLAB/c 裸鼠购自北京维通利华。本研究经江苏大学附属金坛医院伦理委员会批准(编号2020001)。RPMI 1640细胞培养基、PBS、胰酶、青链霉素、胎牛血清(Gibco 公司,美国),二甲基亚砜、甲醇、吐温-20、氯仿、异丙醇、无水乙醇(Sigma-Alrich公司,美国),Cell Counting Kit 8(CCK-8)细胞增殖检测试剂盒、PMSF、BCA 蛋白定量试剂盒、结晶紫染液、DEPC水(上海Beyotime生物技术有限公司),ECL显影液(苏州新赛美生物科技有限公司),PAGE凝胶快速制备试剂盒(上海雅酶生物科技有限公司),Lipofectamine 3000(Termo Fisher 公司,美国),LINC01197 干扰RNA(shLINC01197)及阴性对照(NC)序列由上海吉玛公司合成。
1.2 方法
1.2.1 生物信息学分析
GEPIA 数据库(Gene Expression Profiling Interactive Analysis,http://gepia.cancer-pku.cn/)是一个研究人类各种类型肿瘤及正常组织RNA 测序数据的数据库,其整合了TCGA(The Cancer Genome Atlas)和GTEx(The Genotype-Tissue Expression)等数据库,可以对肿瘤的基因表达、病理类型、患者生存期等各方面进行高效、专业的分析[10]。基于GEPIA数据库,我们选取408个胃癌组织样本和211个正常胃部组织样本,分析LINC01197在胃癌组织中的表达情况,同时,按照Kaplan-Meier Plotter(KM plotter)数据库(http://kmplot.com/analysis/index.php?p=service&cancer=gastric)中LINC00197的表达量中位数,将胃癌患者分为高表达组和低表达组,进行预后研究。
1.2.2 细胞培养
人胃癌细胞株SGC-7901、BGC-823、MGC-803、AGS及人胃黏膜上皮细胞GES-1均购自中国科学院典型培养物保藏委员会细胞库,传代培养于低糖生长液RPMI1640中,生长于提供37 ℃和5%CO2环境的培养箱。取对数生长的细胞用于后续实验。
1.2.3 RNA提取和实时荧光定量PCR(qPCR)
用TRIzol 提取RNA,使用Prime Script RT Master Mix 反转录试剂盒将RNA 逆转成cDNA,并按照qPCR反应体系配制反应溶液,加入荧光定量用384孔板中,ABI 7900HT Real-Time PCR System 7900 高通量快速实时荧光定量PCR 仪收纳384 板进行PCR。程序包括预变性和循环。收集并处理数据,结果用2-ΔΔCt法计算。qPCR引物见表1。

表1 PCR引物序列Table 1 Primer sequences for PCR
1.2.4 细胞转染
取生长活跃的细胞2×105~4×105个接种至6 孔板中,生长24 h。按照Lipofectamine 3000 说明书进行转染,6 h 后换液。干扰片段序列如下:阴性对照(NC)5′-GTTCTCCGAACGTGTCACGT-3′,干扰片段1(shLINC01197-1)5′-GGTCGTACTTCTCCATGTTCT-3′,干 扰 片 段2(shLINC01197-2)5′-GGACATAAAGTTCCTGGTTGA-3′。
1.2.5 细胞增殖实验
取对数生长期细胞1×105个,制成单细胞悬液,接种于96孔培养板,每孔200 μL细胞悬液,分别置于培养箱培养24~120 h 后,吸去培养液,每孔加入提前配制的10% CCK-8 溶液100 μL,1~2 h 后于波长450 nm 测各孔吸光度值(每组设5 个平行孔,独立重复3 次)。每日加CCK-8 和加液后测吸光度时间相同,重复5 d后绘制增殖曲线。
1.2.6 Transwell侵袭实验
取出Transwell侵袭小室置于24孔板中,小室上层加入无血清RPMI1640 200 μL,下层加入有血清RPMI1640 600 μL。消化目的细胞后计数,取4×104个细胞滴入小室上层,置于培养箱孵育24 h,取出小室,4%多聚甲醛固定20 min,用棉签擦去上层细胞,结晶紫染色15 min,蒸馏水轻轻冲洗,在显微镜下计数5 个高倍镜视野下的穿膜细胞数,计算穿膜细胞平均值,评估细胞侵袭能力。
1.2.7 克隆形成实验
取对数生长期1×105个细胞,制成单细胞悬液,每孔100 μL加入6孔板,3 d换1次液,培养10~14 d后,用结晶紫粉末和甲醛配成0.5%结晶紫染色液染色15~30 min,PBS冲洗后拍照。
1.2.8 裸鼠皮下成瘤实验
于4周BALB/C裸鼠皮下分别注射BGC-823 NC和BGC-823 shLINC01197细胞,每只接种细胞5×106个,每3 d观察肿瘤大小,2周后取出肿瘤并称重、测量大小。包埋肿瘤并做免疫组化切片。
1.2.9 蛋白免疫印迹实验
当胃癌细胞状态良好时,吸取培养液,PBS漂洗2遍。加入细胞裂解液,低温离心5 min,取上清,并进行蛋白定量。蛋白行聚丙烯酰胺凝胶电泳(SDSPAGE),湿转法转膜,并用5%脱脂奶粉溶液封闭后,分别孵育β-actin、SERPINA1 抗体过夜,次日用PBST 洗膜,常温孵育二抗2 h,PBST 漂洗后用ECL法显影并拍照。
1.3 统计学方法
应用SPSS 20.0进行数据的统计分析,计量资料采用均数±标准差()描述,两组间均数比较采用t检验,多组计量资料比较先采用单因素方差分析再以LSD检验进行两两比较,CCK-8实验结果采用重复测量的方差分析,生存数据采用Kaplan-Meier 方法分析,P<0.05 为差异有统计学意义。
2 结果
2.1 LINC01197 在胃癌组织中表达增高且与胃癌患者预后差相关
对GEPIA 数据库中408 个胃癌组织样本和211个正常胃部组织样本的分析结果表明,LINC01197在胃癌组织中的表达量明显增高(图1A)。分析发现LINC01197低表达的患者总生存期(中位时间:低表达组75.5个月,高表达组40.0个月)、首次进展时间(中位时间:低表达组50.0 个月,高表达组24.3 个月)和进展后生存期(中位时间:低表达组13.8 个月,高表达组9.7 个月)均显著长于高表达患者,且差异均具有统计学意义(图1B~D)。选取21对胃癌和匹配的癌旁组织,通过qPCR实验证实LINC01197在胃癌组织中的表达量明显高于癌旁组织(图1E)。最后,我们分析了LINC01197 在胃癌细胞内的表达水平,结果显示LINC01197在人胃黏膜上皮细胞GES-1中的表达显著低于人胃癌细胞株SGC-7901、BGC-823、MGC-803和AGS(图1F)。
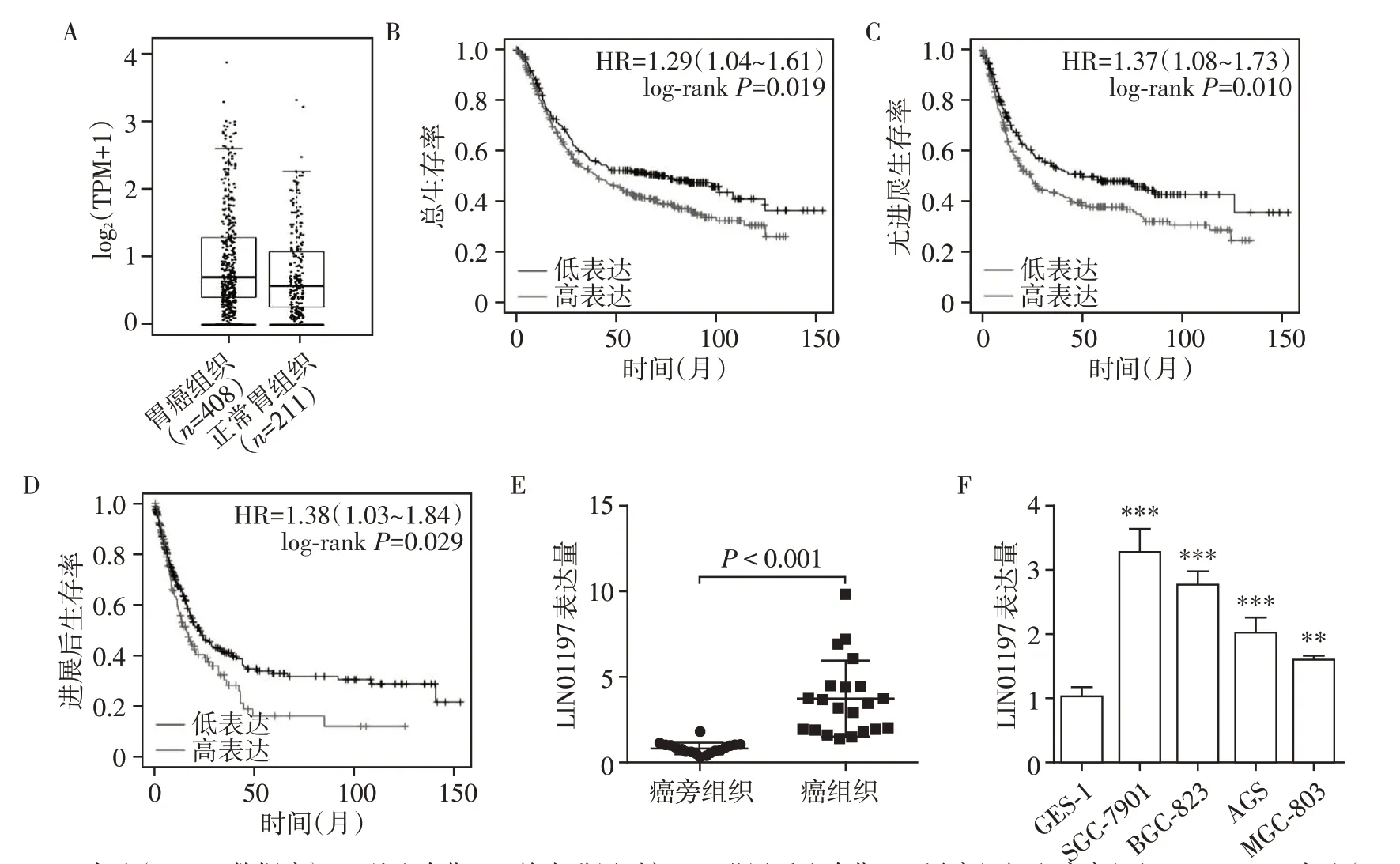
图1 lncRNA LIN01197的表达与胃癌预后的关联分析Figure 1 Analysis of the association between lncRNA LIN01197 and prognosis in gastric cancer
2.2 在体外和体内实验中敲减LINC01197 能抑制胃癌细胞的增殖、侵袭和迁移
为了研究LINC01197 在胃癌细胞中的作用,我们在SGC-7901 和BGC-823 细胞系中通过短发夹RNA(short hairpin RNA,shRNA)敲减了LINC01197的表达(图2A)。相比较NC 组,shLINC01197 组胃癌细胞增殖减缓(图2B)。克隆形成实验的结果进一步证明了这一现象(图2C)。与此同时,Transwell实验的结果表明敲减LINC01197也抑制了胃癌细胞SGC-7901和BGC-823的侵袭及迁移能力(图2D)。
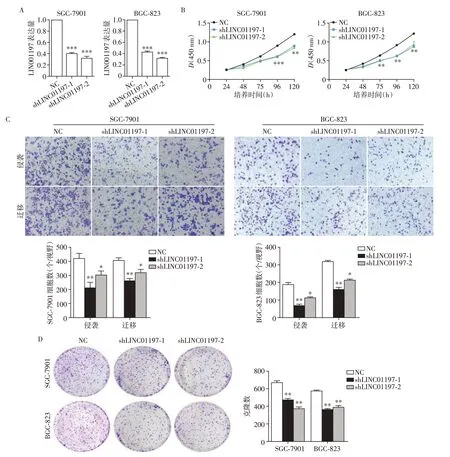
图2 体外敲减LINC01197抑制胃癌细胞增殖和侵袭、迁移Figure 2 Knockdown of LINC01197 inhibits cell proliferation,invasion and migration in vitro in gastric cancer cells
为了进一步验证LINC01197 在胃癌中的功能,我们研究了LINC01197在动物体内肿瘤形成中的作用。敲减了LINC01197 后的BGC-823 shLINC01197细胞及阴性对照BGC-823 NC 细胞分别被注射到裸鼠皮下,定期测量肿瘤生长变化,2周后将皮下肿瘤取出测量并进行了Ki-67 免疫组化分析。结果显示,相比较NC 组,shLINC01197 组胃癌细胞体内增殖速度减缓(图3A、B),在皮下荷瘤15 d后最终成瘤的体积和重量也较小(图3C)。免疫组化结果也显示,实验组Ki-67 的表达水平显著下降(图3D)。这些结果都证实了敲减LINC01197在体内和体外均可以抑制胃癌的发生和发展。
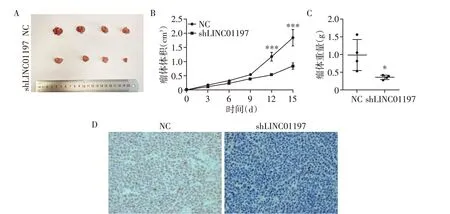
图3 体内敲减LINC01197抑制胃癌细胞增殖Figure 3 Knockdown of LINC01197 inhibits cell proliferation in vivo in gastric cancer cells
2.3 LINC01197 在胃癌细胞中促进下游分子SERPINA1的表达
为了深入探索LINC01197促进胃癌发生发展的机制,首先我们对LINC01197 的亚细胞定位进行了检测,发现LINC01197在SGC-7901和BGC-823两株胃癌细胞中均主要分布于细胞核内(图4A),提示其可能通过转录水平调控发挥功能。对敲减了LINC01197 后的BGC-823 shLINC01197 细胞及阴性对照BGC-823 NC细胞进行转录组高通量测序(highthroughout transcriptome sequencing of mRNA,mRNA-seq)以寻找差异表达基因。差异基因结果分析表明,在敲减LINC01197 后,5 个基因表达上调,95 个基因表达下调。qPCR 实验验证了在敲减LINC01197 后,SERPINA1、APOA2、IGF2 的表达水平明显下降,其中SERPINA1 最为明显(图4B)。蛋白免疫印迹实验也证明了在SGC-7901 和BGC-823两个细胞系中,敲减LINC01197 后会降低SERPINA1 蛋白的表达(图4C)。这些结果表明,LINC01197 有可能是通过影响SERPINA1 的表达水平,从而进一步影响胃癌的进展。
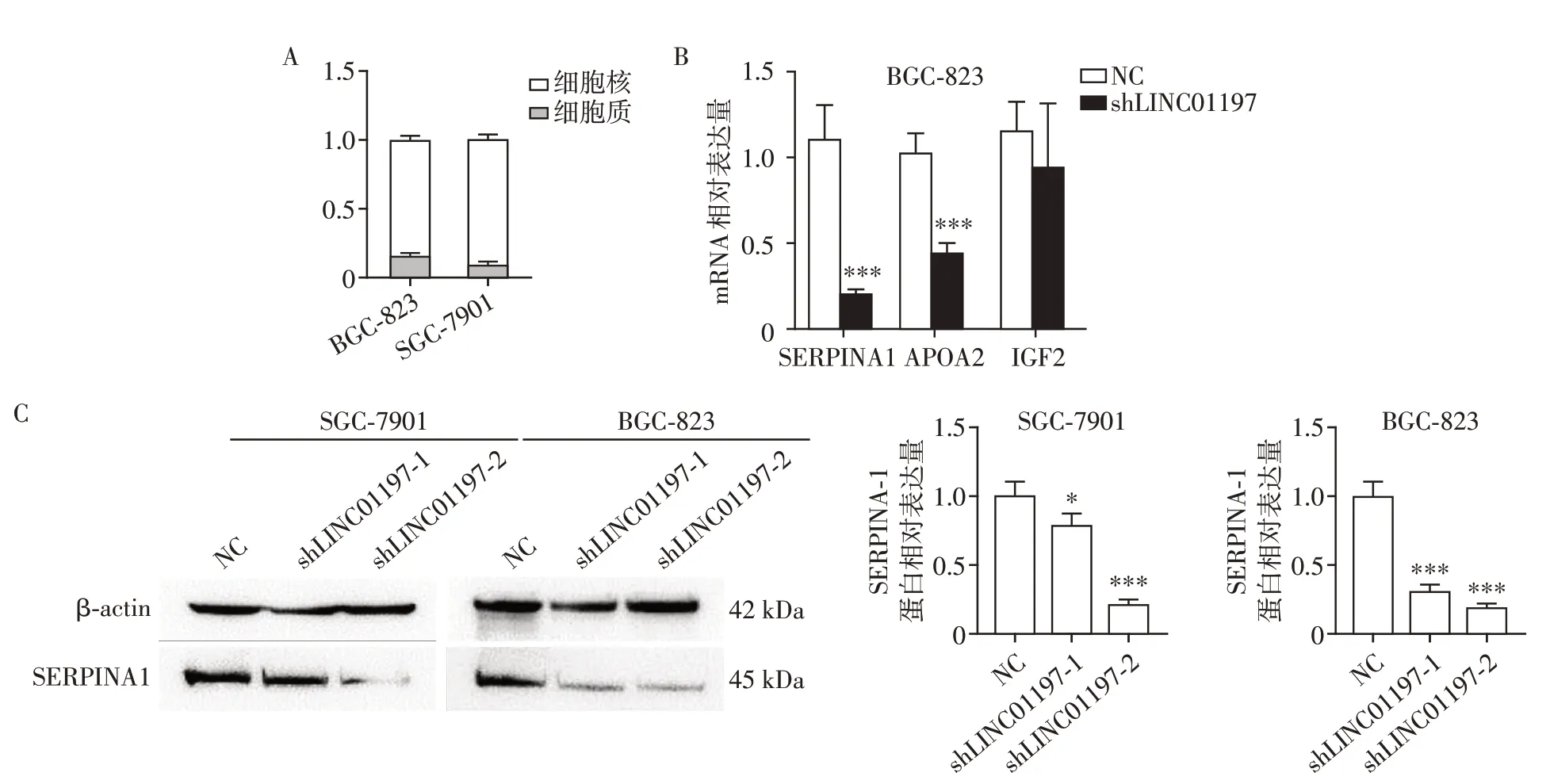
图4 敲减LINC01197降低SERPINA1的表达Figure 4 Knockdown of LINC01197 decreased the expression of SERPINA1
2.4 LINC01197通过调节SERPINA1表达促进胃癌进展
为进一步探究LINC01197促进胃癌进展是否是通过调节SERPINA1 实现的,我们在已经稳定转染shLINC01197 的SGC-7901 和BGC-823 两株胃癌细胞株中再转染SERPINA1 过表达质粒。相较于NC组和shLINC01197组,CCK-8实验表明shLINC01197组胃癌细胞再过表达SERPINA1 可恢复胃癌细胞部分增殖能力(图5A)。Transwell 实验也表明稳转shLINC01197 的胃癌细胞再过表达SERPINA1 可恢复部分胃癌细胞侵袭迁移能力(图5B)。上述结果表明,LINC01197 促进胃癌细胞增殖和侵袭转移的实现部分是通过调节SERPINA1表达而实现的。
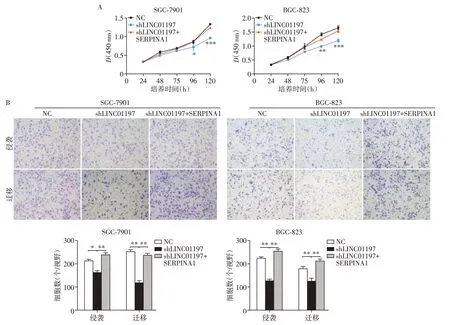
图5 LIN01197通过调节SERPINA1表达促进胃癌细胞增殖和侵袭迁移Figure 5 LINC01197 promotes cell proliferation and invasion via regulating SERPINA1 expression
3 讨论
越来越多的实验表明,lncRNA在恶性肿瘤的发生发展发挥了很多作用,然而造成它们在肿瘤细胞中异常表达的靶标和通路机制还未完全阐明[11-14]。本研究发现,LINC01197在胃癌细胞中呈高表达,且与胃癌的不良预后正相关。体外和体内实验均证实,敲减LINC01197 基因后,胃癌细胞的增殖、侵袭和迁移均会受到抑制,这说明LINC01197 能促进胃癌的发生发展。然而,Ling[8]和Jia[9]的研究证实了LINC01197 在胰腺癌细胞和组织中呈低表达,会抑制胰腺癌的发生发展。这些实验结果提示了LINC01197在特定种类的肿瘤细胞中可以发挥不同的功能。本研究首次明确了LINC01197在胃癌中的作用,其肿瘤异质性还有待进一步研究。
丝氨酸蛋白酶抑制剂(SERPINS)属于蛋白酶抑制剂家族,可被分类为位于细胞外的SERPINA和位于细胞内的SERPINB[15]。SERPINA1也被称为1-蛋白酶抑制剂或1-抗胰蛋白酶(AAT)。SERPINA1 主要在肝脏合成,也在某些细胞,如胃癌、结肠癌以及肺癌细胞[16]中产生。肿瘤细胞不仅能合成和释放原生形式的SERPINA1,也能生成各种裂解或降解形式的SERPINA1[17]。这些蛋白酶抑制剂在生理和病理过程均能起重要作用,如血管生成、血管内纤维蛋白溶解、伤口愈合和肿瘤侵袭和转移等[18]。据报道,SERPINA1的表达在肺癌、结肠癌和鳞状细胞癌中与肿瘤转移和预后不良相关[16]。SERPINA1在胃癌中也被发现表达增高,以及与高分化腺癌预后差密切相关[19]。然而,SERPINA1 在胃癌进展和转移中的作用机制仍然未知,与胃癌各种临床特征之间的相关性也没有清晰阐明。本研究证实了长非编码RNA LINC01197 可能通过促进下游分子SERPINA1 的表达促进胃癌的发生发展。今后将通过实验进一步研究和证实LINC01197调控SERPINA1表达的具体机制。
综上所述,我们发现lncRNA LINC01197在胃癌组织和细胞中表达增高,并与胃癌患者的预后不良相关。我们在胃癌细胞系中进行了体外实验,并构建了裸鼠成瘤模型进行体内实验,结果均证实LINC01197可以促进胃癌细胞的增殖、侵袭和迁移,从而促进胃癌的发生发展。通过mRNA-seq 测序、后续的qPCR 和蛋白免疫印迹实验,我们发现LINC01197 通过影响下游分子SERPINA1 的表达促进胃癌进展,提示了胃癌发生中可能存在新的信号机制。本实验结果表明,LINC01197可能成为全新的胃癌诊断标志物,并且也将成为胃癌治疗的新靶标。
