PINK1/Parkin通路介导的线粒体自噬在十溴联苯醚诱导肉鸡肾脏损伤中的作用
2021-07-28孙诗谣饶钦雄程琳杨俊花赵志辉
孙诗谣,饶钦雄,程琳,杨俊花*,赵志辉
(1.上海海洋大学食品学院,上海 201306;2.上海市农业科学院农产品质量标准与检测技术研究所,上海 201403)
十溴联苯醚(BDE-209)是目前最具代表性且使用最为广泛的一种溴代阻燃剂,常被添加于纺织品、电子产品及高分子材料等[1]。其化学分子式为C12Br10O,具有亲脂疏水、难降解、易沉积、易迁移等特性。BDE-209已在不同环境介质中被检出,并且可降解为具有较强毒性的低溴联苯醚、甲基化或羟基化代谢产物[2-3]。除暴露环境外,BDE-209还可通过食物链进入人和动物机体,并已在人的皮肤、头发、指甲及母乳内检出其残留[4-6]。随着BDE-209在生物体内的不断富集,极易引起神经、免疫和生殖毒性以及癌症等[7-8]。目前,BDE-209对环境及生物安全均造成严重的威胁,其危害与防控也成为研究的热点。
在中国,禽肉是仅次于猪肉的第二大肉类消费品,预测至2030年鸡肉的人均消费量每年将达11.22 kg[9]。然而,有资料显示在家禽饲料、鸡蛋、鸡肉以及鸡的皮肤、肝脏、脾脏、肾脏等组织器官内均检测出 BDE-209 残留[10-12],不仅威胁消费者健康,也给家禽养殖业造成巨大的损失。目前,有关BDE-209对家禽的毒理学研究报道较少,深入探索BDE-209对肉鸡的毒性作用,不仅可以揭示BDE-209对家禽的危害,对精准防控可持续污染物的危害也具有重要意义。
肾脏是机体重要的器官,不仅可以通过生成尿液的方式清除体内的代谢产物和废弃物,还可通过重吸收以保留水分及其他营养物质,对保障机体内环境稳定,促使新陈代谢具有重要作用。有证据揭示,肾脏也是多溴联苯醚(polybrominated diphenyl ethers,PBDE)重要的靶器官之一,其中BDE-209在209种多溴联苯醚同系物中使用最为广泛。以100 mg·kg-1·d-1BDE-209灌胃饲养小鼠20 d后,出现严重的肾水肿[13]。其他研究也表明,血清尿素氮(CRE)和肌酐(BUN)含量在BDE-209暴露下也明显升高,小鼠肾脏抗氧化能力下降和脂质过氧化程度增加[14-15]。此外,BDE-209诱导大鼠肾上腺髓质嗜铬细胞瘤细胞株PC12线粒体自噬空泡增多[16]。然而,BDE-209导致肾脏损伤是否与组织氧化应激和线粒体自噬有关还未见报道。本研究以AA肉鸡为试验动物,探索不同浓度BDE-209饲喂对血清及肾脏损伤相关指标、氧化应激与自噬水平的影响,旨在为揭示BDE-209的肾脏毒性及作用机制提供理论依据。
1 材料与方法
1.1 试剂与仪器设备
BDE-209,白色粉末,纯度大于98%,购自中国上海麦克劳林生物有限公司。Real-time PCR所用试剂TB GreenTMPremixEXTaq、ROX Reference Dye Ⅱ、RNase-free H2O及Prime-Script RT-PCR试剂盒为大连TaKaRa公司产品。兔抗p62、LC3、Parkin抗体和鼠抗β-actin抗体,辣根过氧化物酶(HRP)标记的山羊抗兔IgG,HRP标记的山羊抗鼠IgG,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI),抗荧光淬灭封片剂,自发荧光淬灭剂,BSA(牛血清白蛋白),20×柠檬酸抗原修复液,RIPA(radio immunoprecipitation assay)裂解液以及磷酸化蛋白酶抑制剂均为Servicebio公司产品。兔抗PINK1抗体为Abcam公司产品。总抗氧化能力(total antioxidant capacity,T-AOC)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性和丙二醛(malondialdehyde,MDA)含量等检测试剂盒均购自南京建成生物工程研究所。线粒体膜电位检测试剂盒(JC-1)购自上海碧云天生物技术有限公司。无水乙醇、二甲苯等试剂均为国产分析纯,购自国药(上海)集团化学试剂有限公司。
仪器:台式冷冻离心机(Eppendorf);AU5800全自动生化分析仪(Beckman);高速组织研磨仪(Servicebio);多功能荧光酶标仪(Multiskan Sky,Thermo);全景组织切片扫描仪(3D Histech Pannoramic 250);正置荧光显微镜(Nikon Eclipse C1)及显微镜相机控制器(Nikon DS-U3);微量紫外分光光度计(Quawell Q3000);荧光定量PCR仪(QuantStudio 5);电泳凝胶成像系统(Kodak 1D)。
1.2 动物饲养与试验设计
150只体况良好的1日龄雄性AA白羽肉鸡,购自江苏广大畜禽有限公司,随机分为5组,每组设置 6个重复,每个重复5只。分别在5个试验组基础日粮中添加0、0.004、0.04、0.4和4.0 g·kg-1BDE-209。光照处理:1~3 d,每天光照24 h;4~28 d,每天光照23 h;29~42 d,每天光照5 h后黑暗饲养1 h,每天4次循环。饲养第1周,鸡舍温度保持35 ℃,随后每周降低3 ℃直至第5周。维持相对湿度40%~50%。试验在上海市农业科学院肉鸡养殖场进行。试验开始前,按所设剂量分别将BDE-209逐级稀释后均匀拌入饲料中,每天提供干净水源及所配饲料供肉鸡自由采食。日粮配置依据《中国肉鸡的饲养标准:NT/T 33—2004》及已有配方参考配制(表1)[17-18]。另外,基础日粮中BDE-209及PBDE含量采用气相色谱-高分辨率质谱仪(Thermo Fisher)检测,其浓度均低于0.000 2 mg·kg-1。

表1 肉鸡基础日粮组成和营养组成Table 1 Ingredients composition and nutrient composition of basal diet feed to broilers
1.3 样品采集及检测方法
1.3.1 血清BUN及CRE浓度检测试验结束时,每只鸡用真空管翅静脉采血5 mL,3 000 r·min-1离心15 min,分离收集上层血清,全自动血液生化分析仪检测BUN和CRE浓度。
1.3.2 肾脏样品采集及氧化应激指标检测每个试验组每个重复随机选取3只,共90只进行宰杀,手术剖解迅速分离肾脏,一部分切取1.0 cm×1.0 cm×0.5 cm 组织块,固定于体积分数为4%的福尔马林溶液,用于石蜡切片分析;另一部分加入OCT包埋剂,-20 ℃保存用于冰冻切片,剩余组织置于1.5 mL离心管中,-80 ℃保存。
取0.1 g低温冷冻肾脏组织,加入900 μL无菌生理盐水,冰浴匀浆,3 000 r·min-1离心15 min,取上清液,依据试剂盒操作说明检测T-AOC、SOD、GSH-Px活性和MDA含量。
1.3.3 肾脏组织病理学检测固定后常规取材,脱水透明,石蜡包埋,制成4 μm石蜡切片,二甲苯及梯度乙醇脱蜡,脱水,依据苏木精-伊红(HE)染色程序依次染色,封片,使用全景组织切片扫描仪(3D Histech Pannoramic 250)拍照观察。
1.3.4 肾脏线粒体膜电位(JC-1)检测取冰冻组织,常规切片,室温复温,控水滴加JC-1稀释液,1∶500稀释,37 ℃孵育20 min,PBS(pH7.4)洗涤3次,封片,于荧光显微镜下观察及采集图像。
1.3.5 自噬蛋白p62与LC3的免疫荧光组化检测将石蜡切片依次经二甲苯、梯度乙醇脱蜡至水;抗原修复后,50 g·L-1脱脂奶粉封闭;分别加入一抗(兔抗p62,1∶300;兔抗LC3,1∶300),湿盒4 ℃孵育过夜;加入二抗(HRP标记的山羊抗兔IgG,1∶400),室温避光孵育50 min;自发荧光淬灭后使用DAPI复染细胞核;封片,在荧光显微镜下观察并采集图像。
1.3.6 RT-qPCR检测自噬关键基因的表达Trizol一步法提取肾脏总RNA,微量紫外分光光度计测定RNA的浓度及纯度。采用Prime-Script RT-PCR试剂盒完成反转录后将cDNA进行qPCR检测。qPCR反应体系(20 μL):cDNA 1 μL,TB GreenTMPremixEXTaq10 μL,ROX Reference Dye Ⅱ 0.4 μL,引物0.4 μL,RNase-free H2O 7.8 μL。反应条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 20 s,60 ℃ 1 min,95 ℃ 15 s,40个循环。引物参照已有序列,并选用鸡GAPDH作为内参基因[19-20],由上海派森诺生物科技有限公司合成(表2)。

表2 引物序列Table 2 Primer sequences
1.3.7 Western blot检测自噬关键蛋白准确称取0.1 g肾脏组织于匀浆管中,置于高速组织研磨仪中匀浆,12 000 r·min-1离心10 min,收集上清液,BCA试剂盒检测总蛋白浓度。100 g·L-1SDS-PAGE分离蛋白,转膜,用50 g·L-1脱脂奶粉(0.5% TBST溶解)室温封闭1 h。分别加一抗(鼠抗β-actin,1∶4 000;兔抗p62,1∶1 000;兔抗LC3,1∶1 000;兔抗PINK1,1∶1 000;兔抗Parkin,1∶750),4 ℃孵育过夜。TBST洗涤后分别加二抗(HRP标记的山羊抗鼠IgG,1∶3 000;HRP标记的山羊抗兔IgG,1∶3 000),室温孵育30 min。TBST洗涤后加入ECL化学发光剂,凝胶电泳成像系统(Kodak 1D)显影,Image J软件分析条带灰度值。
1.4 数据分析

2 结果与分析
2.1 不同剂量BDE-209对肉鸡血清BUN及CRE浓度的影响
由表3可见:与对照组相比,BDE-209处理组BUN和CRE浓度均升高,其中0.04、0.4和4.0 g·kg-1BDE-209组具有显著性差异(P<0.05),且呈剂量依赖效应。其中,0.4和4.0 g·kg-1BDE-209组还分别显著高于0.004和0.04 g·kg-1BDE-209组(P<0.05),但0.4和4.0 g·kg-1BDE-209组间无显著差异(P>0.05)。

表3 不同剂量BDE-209对肉鸡血清尿素氮(BUN)及肌酐(CRE)浓度的影响Table 3 Effects of different doses of BDE-209 exposed to broilers on the concentration of serum blood urea nitrogen(BUN)and creatinine(CRE)
2.2 不同剂量BDE-209对肉鸡肾脏氧化应激指标的影响
由表4可见:与对照组相比,BDE-209各处理组T-AOC活性无显著变化(P>0.05)。0.4和4.0 g·kg-1BDE-209组SOD活性均显著低于对照和0.004和0.04 g·kg-1BDE-209组(P<0.05);0.04、0.40和4.0 g·kg-1BDE-209组GSH-Px活性也均显著低于对照和0.004 g·kg-1BDE-209组(P<0.05),且0.4和4.0 g·kg-1BDE-209组均显著低于0.04 g·kg-1BDE-209组(P<0.05),但0.4和4.0 g·kg-1BDE-209组之间无显著差异(P>0.05)。与之相反,0.04、0.4和4.0 g·kg-1BDE-209组MDA含量均显著上升(P<0.05),且0.4和 4.0 g·kg-1BDE-209组也均显著高于0.04 g·kg-1BDE-209组(P<0.05),但二者之间无显著差异(P>0.05)。

表4 不同剂量BDE-209对肉鸡肾脏氧化应激指标的影响Table 4 Effects of different doses of BDE-209 exposed to broilers on kidney oxidative stress indexes
2.3 不同剂量BDE-209对肉鸡肾脏组织结构的影响
HE染色结果(图1)显示:对照组肾小球、肾小管形态结构正常,肾间质与皮质间无炎性细胞浸润,未见肾小管上皮细胞脱落等病理现象。0.004 g·kg-1BDE-209组肾小球内细胞数量增多,肾小球体积增大(红色箭头);0.04 g·kg-1BDE-209组肾小球肥大,体积增大(红色箭头),且见轻度肾小管正常结构消失(黄色箭头);0.4 g·kg-1BDE-209组肾小球内容物增多(红色箭头),且肾小管上皮细胞水肿,胞质疏松(黄色箭头);4.0 g·kg-1BDE-209组肾脏组织内肾小球体积增大且基底膜增厚,伴随细胞成分增多(红色箭头),多见肾小管上皮细胞中度水肿,胞质疏松淡染(黄色箭头),局部肾小管正常结构消失并伴有大量炎性细胞浸润(黑色箭头)。

图1 不同剂量BDE-209处理的肉鸡肾脏组织病理学变化Fig.1 Renal histopathological changes of broilers treated with different doses of BDE-209
2.4 不同剂量BDE-209对肉鸡肾脏线粒体膜电位的影响
线粒体膜电位(JC-1)检测结果(图2)显示:经不同浓度BDE-209饲喂42 d后,肾脏线粒体呈受损状态,线粒体膜电位下降,JC-1不能聚集于线粒体基质中,JC-1单体增多至绿色荧光增强,且随BDE-209浓度的增加,绿色荧光逐渐增强。

图2 不同剂量BDE-209对肉鸡肾脏线粒体膜电位的影响(JC-1)Fig.2 Effects of different doses of BDE-209 exposed to broilers on renal mitochondrial membrane potential(JC-1)
2.5 不同剂量BDE-209对肉鸡肾脏自噬蛋白p62和LC3定位表达的影响
免疫荧光染色结果(图3、图4)显示,不同剂量BDE-209饲喂肉鸡42 d后,自噬蛋白p62和LC3在肉鸡肾脏内均被激活,其中红色荧光染色(图3)显示p62蛋白为阳性,绿色荧光染色(图4)显示LC3为阳性,均呈现浓度依赖性增强。进一步统计结果显示:与对照组相比,0.004和0.04 g·kg-1BDE-209组p62表达量均增加,但无显著性差异(P>0.05),0.4和4.0 g·kg-1BDE-209组p62蛋白表达量均显著上升(P<0.05)(图5-A)。此外,与对照组相比,添加BDE-209组LC3蛋白的表达均显著升高(P<0.05)(图5-B)。

图3 不同剂量BDE-209处理的肉鸡肾脏p62蛋白免疫组化分析Fig.3 Immunohistochemical analysis of p62 in kidney of broilers exposed to different doses of BDE-209蓝色荧光表示细胞核;红色荧光表示p62蛋白阳性表达。Blue fluorescence shows nucleus;red fluorescence shows the positive expression of p62 protein.

图4 不同剂量BDE-209处理的肉鸡肾脏LC3蛋白免疫组化分析Fig.4 Immunohistochemical analysis of LC3 in kidney of broilers exposed to different doses of BDE-209蓝色荧光表示细胞核;绿色荧光表示LC3蛋白阳性表达。Blue fluorescence shows nucleus;green fluorescence shows the positive expression of LC3 protein.

图5 不同剂量BDE-209处理的肉鸡肾脏p62(A)与LC3(B)蛋白表达免疫组化相对荧光值统计Fig.5 Relative fluorescence values statistics of p62(A)and LC3(B)proteins expression in kidney of broilers exposed to different doses of BDE-209不同字母表示差异显著(P<0.05)。下同。Different letters indicate significant difference(P<0.05). The same as follows.
2.6 不同剂量BDE-209对肉鸡肾脏自噬水平的影响
转录水平结果(图6)显示:与对照组相比,0.04、0.4和4.0 g·kg-1BDE-209组肉鸡肾脏p62转录水平均显著升高,且3组间均存在显著性差异(图6-A);此外,0.04、0.4和4.0 g·kg-1BDE-209组LC3-Ⅱ/LC3-Ⅰ值均显著高于对照组(P<0.05),其中4.0 g·kg-1BDE-209组显著高于0.04 g·kg-1BDE-209组(P<0.05),0.004 g·kg-1BDE-209组与对照组、0.04与0.4 g·kg-1BDE-209组、0.4与4.0 g·kg-1BDE-209组无显著性差异(P>0.05)(图6-B);同时,与对照组相比,0.04、0.4和4.0 g·kg-1BDE-209组PINKI转录水平均显著上升(P<0.05),0.004 g·kg-1BDE-209组无显著变化(P>0.05)(图6-C);各组间Parkin转录水平无显著变化(P>0.05)(图6-D)。

图6 不同剂量BDE-209对肉鸡肾脏p62(A)、LC3-Ⅱ/LC3-Ⅱ(B)、PINK1(C)和Parkin(D)mRNA表达的影响Fig.6 Effects of different doses of BDE-209 exposed to broilers on the mRNA levels ofp62(A),LC3-Ⅱ/LC3-Ⅰ(B),PINK1(C)and Parkin(D)in kidney

图7 不同剂量BDE-209对肉鸡肾脏p62(A)蛋白表达和LC3-Ⅱ/LC3-Ⅰ(B)蛋白表达比值的影响Fig.7 Effects of different doses of BDE-209 exposed to broilers on the expression of p62(A) and the ratio of LC3-Ⅱ/LC3-Ⅰ(B)proteins in kidney
Western blot结果(图7、图8)显示:BDE-209作用42 d后,与对照组相比,0.004、0.04、0.4和4.0 g·kg-1BDE-209组p62蛋白表达水平均显著上升(P<0.05),呈梯度依赖增加效应(P<0.05)(图7-A);BDE-209处理组LC3-Ⅱ/LC3-Ⅰ值显著高于对照组(P<0.05),0.04、0.4和4.0 g·kg-1BDE-209组也均显著高于0.004 g·kg-1BDE-209组(P<0.05)(图7-B)。BDE-209处理后,0.04、0.4和4.0 g·kg-1BDE-209组PINK1蛋白的表达水平均显著高于对照组和0.004 g·kg-1BDE-209组(P<0.05),但这3组之间无显著差异(P>0.05);0.004 g·kg-1BDE-209组的PINK1蛋白表达低于对照组(P<0.05)(图8-A)。线粒体自噬关键蛋白Parkin表达水平各组之间没有差异(P>0.05),与转录水平结果一致(图8-B)。
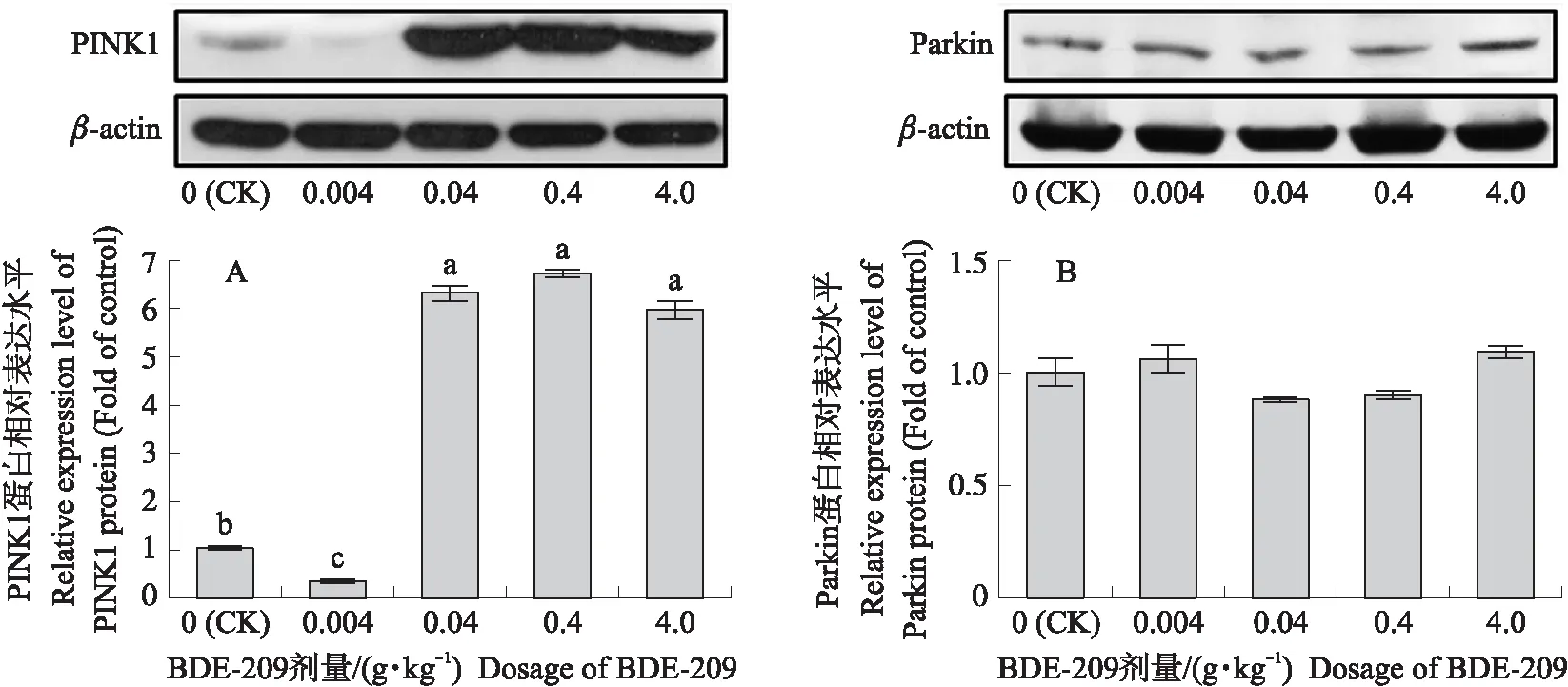
图8 不同剂量BDE-209对肉鸡肾脏PINK1(A)和Parkin(B)蛋白表达的影响Fig.8 Effects of different doses of BDE-209 exposed to broilers on the expression of PINK1(A)and Parkin(B)proteins in kidney
3 讨论
肾脏是机体排出废物及毒素的主要器官之一,BUN和CRE是表征肾脏功能的重要指标。本试验中,肉鸡饲喂BDE-209后,血清BUN和CRE浓度呈剂量依赖性增高。Milovanovic等[14]发现,大鼠灌胃31.25和62.5 mg·kg-1·d-1BDE-209 28 d后,血清BUN和CRE浓度均显著升高,与本试验结果契合。Yang等[13]也发现,经BDE-209暴露的大鼠,尿液CRE含量升高。可见,BDE-209会引起肉鸡肾脏损伤。组织病理学也呈现一致的结果,BDE-209导致肉鸡肾脏肾小球肿大、内容物增多并伴随炎性细胞浸润、局部肾小管结构肿胀、肾小管上皮细胞脱落至管腔等现象。已有研究表明,BDE-209可引起SD大鼠肾脏水肿[13]。Feng等[21]给C57BL/6大鼠灌胃BDE-209,引起肾小管变性及扩张,炎性细胞浸润。结果提示:BDE-209能破坏肾小球和肾小管的组织结构,从而影响肾脏正常的过滤和重吸收功能,导致血清BUN和CRE积累,因此推测肾脏也是BDE-209毒性作用的一个重要靶器官。
氧化应激是机体抵御外界有毒有害物质入侵及自我保护的一种方式,同时也是一个复杂的诱导与毒性效应调控过程。PBDE可引起动物肾脏组织抗氧化状态发生改变[14-15]。本试验肉鸡饲喂BDE-209后,抗氧化酶SOD和GSH-Px活性降低,脂质过氧化物MDA含量显著上升,表明BDE-209破坏了肉鸡肾脏组织的氧化平衡。BDE-209能引起小鼠肾脏组织的急性氧化应激和脂质过氧化反应[15];Wistar大鼠暴露BDE-209后,GSH-Px酶活性较对照组显著降低[14],本试验结果与之一致。此外,BDE-209可使PC12细胞活性氧(reactive oxygen species,ROS)积累[16];多溴联苯醚同系物之一四溴联苯醚(4-bromodiphenyl ether,BDE-47)也可激发细胞氧化应激,显著抑制GSH-Px活性,导致ROS过量积累,诱导肾脏毒性效应[22-23]。可见,BDE-209暴露能降低肉鸡肾脏的抗氧化酶活性,促进MDA含量升高,表明氧化应激在BDE-209诱导的肾脏损伤中发挥重要作用。
自噬是真核细胞中普遍存在的一种动态分解代谢过程,对于维持机体内环境的稳态,参与细胞生长发育、成熟分化及程序性死亡具有重要调控作用[24]。同时,自噬还是细胞氧化还原信号的关键传感器,过度的氧化应激可直接激活自噬,干扰自噬正常程序的发生,反之自噬也可为保持氧化还原稳态提供能量或减缓损伤[25]。微管相关蛋白1轻链3(LC3)通常以LC3-Ⅰ的形式溶解于细胞质中,当自噬发生时,LC3-Ⅰ与磷脂酰乙醇胺共价连接形成LC3-Ⅱ定位于自噬体上,然后通过N端与泛素化蛋白p62一同在溶酶体内降解,激发自噬[26]。因此,当发生自噬时,p62会在细胞质内不断降解;反之当自噬功能受损或减弱时,p62蛋白会积累于细胞质中。本试验中,免疫荧光组化、qPCR和Western blot检测结果均显示,BDE-209作用后肾脏组织中自噬蛋白p62表达和LC3-Ⅱ/LC3-Ⅰ比值均显著上调。已有研究报道BDE-47诱导PC12细胞内p62蛋白和LC3-Ⅱ蛋白表达量均上升,预示BDE-47促进PC12细胞自噬体形成,但p62的表达量增加,阻碍了自噬体的降解[27]。此外,人肝母细胞瘤HepG2细胞暴露BDE-100后,p62蛋白表达量和LC3-Ⅱ/LC3-Ⅰ蛋白表达的比值均上升[28],与本试验结果一致。这些数据表明BDE-209促进肉鸡肾脏LC3-Ⅰ蛋白向LC3-Ⅱ蛋白转换,激发自噬体的形成,但p62蛋白积累,使得自噬溶酶体降解过程受阻,无法清除受损细胞,造成肾脏自噬修复功能降低,引起组织器官损伤。
线粒体是产生氧化应激的主要场所,自噬对受损线粒体的清除、维持线粒体数量和质量及能量平衡具有重要作用。PINK1/Parkin通路是调控线粒体自噬的经典上游途径,PINK1是一种丝氨酸/苏氨酸蛋白激酶,正常状态下,以较低水平附着于线粒体内膜,当线粒体受损时,线粒体膜电位下降,激活及泛素化细胞质中的E3泛素化蛋白Parkin,最终自噬蛋白p62结合线粒体膜上的泛素化蛋白,同时配合LC3形成自噬体后被溶酶体降解[29]。本试验结果显示,BDE-209暴露后,肉鸡肾脏线粒体膜电位下降,肾脏PINK1转录水平和蛋白表达水平增加,表明肾脏线粒体损伤自噬被激活。然而各组Parkin转录及蛋白表达水平均无显著差异。董理鑫[27]推测BDE-47促使PC12细胞线粒体受损且膜电位下降,同时BDE-47通过下调Parkin表达阻碍受损线粒体自噬,加剧线粒体损伤,本试验结果与之一致。目前仍没有BDE-209对PINK1/Parkin通路的研究,但其他环境污染物如重金属镉可通过氧化应激介导PINK1/Parkin途径,促进PINK1过度表达,破坏线粒体功能而引起小鼠肾脏损伤[30-31]。肌红蛋白通过促进PINK1蛋白表达和抑制Parkin蛋白表达促使大鼠肾小管上皮细胞凋亡[32]。据此,笔者推测BDE-209在引起氧化水平失衡后,诱导PINK1蛋白过表达;Parkin蛋白缺乏使得PINK1蛋白在线粒体内膜积累,导致线粒体自噬平衡紊乱,线粒体损伤;p62蛋白过度积累,自噬溶酶体途径受阻,损伤线粒体无法自噬清除,逐渐积累最终导致肾脏损伤。
综上所述,BDE-209暴露引起肉鸡肾脏氧化失衡,导致氧化应激,激活PINK1/Parkin信号途径,肾脏线粒体发生损伤,进而诱导LC3-Ⅰ蛋白向LC3-Ⅱ蛋白转化,上调p62蛋白阻碍自噬体降解,使肉鸡肾脏产生不可逆的组织损伤。这些结果不仅阐述BDE-209致肉鸡肾脏毒性的作用机制,为污染物BDE-209诱导肉鸡毒性效应的相关研究提供数据支撑,而且对有效持久防控有机污染物措施的提出具有重要意义。
