外施吲哚乙酸对棉铃蔗糖代谢及产量性状的影响
2021-07-28殷梦瑶罗海华彭金剑袁长凯汤飞宇
殷梦瑶 陈 功 罗海华 彭金剑 高 欣 袁长凯 汤飞宇
(江西农业大学农学院/作物生理生态与遗传育种教育部重点实验室,江西南昌 330045)
我国是棉花主要生产国和消费国,且棉花是经济价值较高的作物,提高棉花的产量对增加棉农收入、促进我国纺织业持续健康发展具有十分重要的意义[1]。植物生长调节物质(激素和生长调节剂)是调控棉花优质高产的主要技术手段。激素与棉花生长发育关系密切,植物激素影响棉花花芽分化[2]、叶片衰老[3]、侧根形成[4]、纤维发育[5]等,从而广泛参与到棉花的生长发育、形态建成、生理生化代谢和逆境响应等各方面。研究发现较高的赤霉素(gibberellic acid,GA3)、脱落酸(abscisic acid,ABA) 含量及GA3/吲哚乙酸(indoleacetic acid,IAA)、ABA/IAA 比值,均有利于棉花的发芽分化[6-7]。水杨酸(salicylic acid,SA)、缩节胺(mepiquat chloride,DPC)、乙烯利等多种植物生长调节剂在棉花生产上也得到了广泛的使用,如应用于缓解非生物胁迫[8]、化学封顶[9-10]、催熟脱叶[11]、株型控制[12]等。
棉花是世界上最重要的纤维作物。棉纤维由胚珠外表皮细胞分化发育形成,其发育过程可分为起始、伸长、次生壁增厚和脱水成熟4 个时期[13]。研究表明,IAA 参与了棉纤维的早期发育,在开花当天幼嫩的棉胚珠和纤维中IAA 水平高,而随后8 d 急剧下降[14-15];且IAA 在棉花开花当天的纤维起始细胞中有高浓度的积累,在纤维细胞起始期提高胚珠外表皮内源IAA 的水平能够增加纤维细胞的数量[16]。棉纤维组分中纤维素的占比达90%以上,而蔗糖是纤维素合成的最初底物,蔗糖代谢是棉铃发育的重要代谢过程[17-18];另外,棉籽的成分以脂肪和蛋白质为主,二者的合成均需要蔗糖代谢提供碳骨架和能量来源[19]。目前已有研究表明,蔗糖代谢关键酶可通过参与棉纤维发育进而影响纤维品质的形成[20-22],但有关其对棉胚珠发育的影响及与棉籽性状形成关系的研究相对较少。研究发现细胞壁酸性转化酶可通过催化蔗糖分解产生的葡萄糖驱动种胚早期的核分裂,而蔗糖合成酶(sucrose synthase,SS)可通过提供尿苷二磷酸葡萄糖(uridine diphosphate glucose,UDPG)促进种胚细胞壁的合成[23-24]。适度晚播导致开花后5 d 棉胚珠酸性转化酶活性和随后己糖浓度的升高,促进细胞分裂,有利于棉籽增大[25]。尽管内源IAA 参与了棉铃或棉纤维早期的发育过程[16,26-27],但有关外源IAA 处理对棉花重要产量因子单铃重和衣分等的影响以及IAA 如何通过调控棉铃蔗糖代谢而影响棉铃产量性状的机理尚不明确。本研究以陆地棉品系A201 为材料,利用IAA涂抹发育初期的棉铃,研究对棉花胚珠纤维细胞的启动、棉铃蔗糖代谢及产量性状的影响,旨在为IAA 调控棉花产量形成提供参考依据。
1 材料与方法
1.1 试验材料与试验地概况
试验材料为江西农业大学棉花课题组自育的陆地棉品系A201,长期自交保纯,遗传性状稳定。试验于2017年在江西农业大学农业科技园进行,供试土壤为红壤旱地,pH 值5.6、有机质23.0 g·kg-1、水解氮85.8 g·kg-1、有效磷58.6 g·kg-1、速效钾170.4 g·kg-1,冬季空闲。
1.2 试验设计
参照Seagull 等[27]确定IAA 处理的浓度为0.1 mg·L-1。于棉花开花结铃盛期挂牌标记中部果枝内围果节开花前1 d 的花苞,在花萼处轻轻缠绕吸水纸以便液体被吸收,每朵花滴0.1 mg·L-1IAA 工作液10 滴,连续滴至开花后2 d(计4 d),并以滴去离子水作为对照。每小区处理100 朵花。田间试验随机区组排列,小区面积30.8 m2,3 次重复,4 行区,行长7.7 m,行距1.0 m,株距0.3 m。四周设置保护行,试验采用营养钵育苗移栽。全生育期施纯N:276 kg·hm-2、P2O5:105 kg·hm-2、K2O:247.5 kg·hm-2。按常规高产栽培措施进行管理,合理灌溉和施肥,及时防除病虫草害。
IAA 处理后,每小区分别于开花后10、20、30、40 d取无病虫害且发育正常的棉铃10 个,用冰盒带回室内,经液氮速冻后在冰块上将棉铃迅速分离成铃壳、纤维和种子,种皮和种胚的分离是从开花后20 d 开始。分离的纤维、种皮和种胚一部分作鲜样及时保存于-80℃超低温冰箱中,用于测定蔗糖代谢关键酶:SS、蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)、液泡转化酶(vacuole invertase,VIN)和细胞壁转化酶(cell wall invertase,CWIN)的活性;另一部分将其杀青烘干至恒重,烘干样品研磨后过20 目筛用于非结构性碳水化合物(葡萄糖、果糖、蔗糖和淀粉)含量的测定。为了解IAA 处理对棉花胚珠外表皮细胞突起的影响,取开花当天下午的棉花胚珠观察球状突起(纤维原始细胞)数量并计算其密度。
1.3 测定项目与方法
1.3.1 葡萄糖、果糖和蔗糖含量测定 葡萄糖、果糖和蔗糖的提取采用陈功等[28]的方法。葡萄糖含量的测定采用酶比色法[29],蔗糖、果糖含量的测定采用间苯二酚法[30]。
1.3.2 淀粉含量测定 将1.3.1 经乙醇溶液提取后的残渣烘干至恒重,用于淀粉提取[28],采用蒽酮法测定淀粉含量[30]。
1.3.3 蔗糖代谢关键酶活性测定 粗酶液的提取参照陈功等[28]的方法。采用UDPG 和果糖比色法测定SS 和SPS 活性[30],采用二硝基水杨酸(dinitrosalicylic acid,DNS)比色法测定VIN 和CWIN 活性[22]。
1.3.4 棉胚珠外表皮纤维细胞突起的观察和计数参照Taliercio 等[31]和Romano 等[32]的方法并作改进。用镊子小心取出棉铃的完整胚珠,在解剖显微镜下沿种脊纵切成两半,暂时放在含有0.01 mol·L-1磷酸盐缓冲液(phosphate buffer saline,PBS,pH 值7.2)的1.5 mL 离心管(4℃存放)中;统一将纵切后的胚珠转移至含有12.5 μg·mL-13,3’-二己基含氧碳菁碘化物[3,3′-Dihexyloxacarbocyanin iodide,DiOC6(3)]的0.01 mol·L-1PBS 缓冲液中,摇匀后在室温黑暗条件下染色30 min。之后使用PBS 缓冲液冲洗3 次,放置于载玻片上,滴加1 ∶1混合液(甘油∶PBS 缓冲液)没过样品,在荧光显微镜下观察。取胚珠4 个代表性部位(脊突、合点端、胚珠中部、近珠孔1/4 处)截矩形图框计数,重复3 次,以4 个部位纤维细胞密度的平均值作为胚珠表面纤维突起的平均密度:

式中,FD 为纤维密度,个·mm-2,X 为矩形框内纤维细胞数;Y 为矩形框面积;M 为比例尺代表的实际长度;N 为比例尺长度。
1.3.5 考种计产 棉铃成熟吐絮后,于9月中下旬集中收获剩余的处理和对照棉铃30 个,将其晒干进行室内考种。室内考种主要考察单铃重、衣分、衣指、子指、单铃纤维重、单铃铃壳重等。
1.4 数据处理
采用独立样本t测验检测IAA 处理与对照各指标平均值的差异。试验数据经Excel 2010 整理,采用SPSS 20.0 统计分析,使用Origin 8.5 进行制图。
2 结果与分析
2.1 IAA 处理对棉铃产量性状的影响
由表1可知,与对照(去离子水处理)相比,用0.1 mg·L-1IAA 处理陆地棉A201 后,显著提高了单铃重,处理组衣分、单铃纤维重和单铃种子重高于对照,子指和衣指略低于对照,但均未达到显著差异水平。

表1 IAA 对棉铃产量性状的影响Table 1 The effect of IAA application on within-boll yield components
2.2 IAA 处理对棉铃开花当天纤维原始细胞突起密度的影响
如图1所示,经IAA 处理后,开花当日棉铃胚珠外表皮突起的纤维细胞密度为3 430.56 个·mm-2,而对照仅为3 133.89 个·mm-2,两者差异达到显著水平(P<0.05)。表明吲哚乙酸对纤维细胞的起始分化具有促进作用。

图1 开花当天棉花胚珠外表皮的纤维细胞突起Fig.1 Fiber initials on cotton ovule epidermis on the flowering day
2.3 IAA 处理对棉铃不同部位的碳水化合物的影响
2.3.1 IAA 处理对纤维中碳水化合物的影响 IAA处理下纤维中蔗糖浓度随棉铃发育呈先下降后升高再下降的趋势,且与对照均无显著差异(图2-A)。纤维中非结构性碳水化合物以己糖为主,随棉铃发育其浓度呈下降趋势,在开花后30 d 时IAA 处理极显著高于对照,其他取样时期无显著差异(图2-B)。IAA 处理下纤维中淀粉浓度随棉铃发育呈先上升后下降的趋势,除开花后10 d,总体高于对照,并在开花后30 d 时极显著高于对照(图2-C)。可见,在开花后30 d 时,IAA 处理后纤维中蔗糖、己糖、淀粉浓度均高于对照,且己糖和淀粉浓度均极显著高于对照。表明IAA 处理后增加了纤维中碳水化合物的浓度。

图2 IAA 对纤维中蔗糖(A)、己糖(B)和淀粉(C)浓度的影响Fig.2 Effect of IAA application on the concentrations of sucrose (A),hexose (B) and starch (C) in cotton fibers
2.3.2 IAA 处理对种胚中碳水化合物的影响 IAA处理后,种胚中蔗糖浓度随棉铃发育总体呈上升趋势,20~40 d 时,IAA 处理高于对照,且开花后30 d 时达到显著差异(图3-A)。种胚中己糖浓度随棉铃发育总体呈下降趋势,IAA 处理与对照无显著差异(图3-B)。种胚中淀粉浓度随棉铃发育呈先下降(开花后10~20 d)后上升(开花后30~40 d)的变化趋势,且在开花后30 和40 d 时,IAA 处理显著高于对照(图3-C)。表明IAA 处理能够促进种胚成熟时淀粉的积累。

图3 IAA 对种胚中蔗糖(A)、己糖(B)和淀粉(C)浓度的影响Fig.3 Effect of IAA application on the concentrations of sucrose (A),hexose (B) and starch (C) in cotton embryos
2.3.3 IAA 处理对种皮中碳水化合物的影响 由图4可知,种皮中蔗糖、己糖、淀粉浓度总体均随棉铃发育呈下降趋势。两处理种皮中蔗糖、己糖浓度无显著差异;而IAA 处理种皮中淀粉浓度则均显著或极显著高于对照(图4-C)。表明IAA 处理能够促进种皮中淀粉的积累。
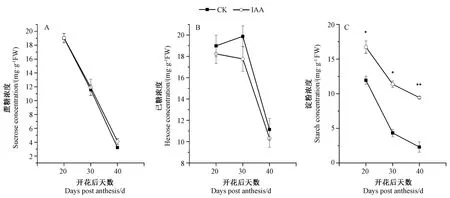
图4 IAA 处理对种皮中蔗糖(A)、己糖(B)和淀粉(C)浓度的影响Fig.4 Effect of IAA application on the concentrations of sucrose (A),hexose (B) and starch (C) in cotton seed coats
2.4 IAA 处理对棉铃不同部位的蔗糖代谢关键酶活性的影响
2.4.1 IAA 处理对棉铃不同部位的蔗糖合成酶(SS)活性的影响 IAA 处理后,纤维中SS 活性在纤维发育早期(开花后10~20 d,纤维伸长阶段)呈下降趋势且明显低于对照,在开花后20 d 时达到极显著差异,此后与对照无显著差异(图5-A)。种胚中IAA 处理和对照的SS 活性均随棉铃发育呈上升趋势,在开花后10 d时IAA 处理略低于对照,之后均高于对照,并在种胚临近成熟阶段(开花后30~40 d)显著或极显著高于对照(图5-B)。种皮中的SS 活性随棉铃发育呈先上升后下降的趋势,且IAA 处理高于对照,并在种皮生长早中期(开花后20~30 d)显著或极显著高于对照(图5-C)。上述结果表明IAA 处理能够提高种胚和种皮的SS 活性。

图5 IAA 对棉花纤维(A)、种胚(B)和种皮(C)SS 活性的影响Fig.5 Effect of IAA application on sucrose synthase (SS) activities in cotton fibers (A),embryos (B) and seed coats (C)
2.4.2 IAA 处理对棉铃磷酸蔗糖合成酶(SPS)活性的影响 随棉铃发育,IAA 处理与对照纤维中SPS 活性无明显变化,且两者间无显著差异(图6-A);种胚中的SPS 活性呈先下降后上升的趋势,开花后30 d 时IAA 处理的SPS 活性显著高于对照(图6-B);种皮中的SPS 活性总体呈下降趋势,开花后30 d 时IAA 处理的SPS 活性显著低于对照(图6-C)。

图6 IAA 处理对棉花纤维(A)、种胚(B)和种皮(C)SPS 活性的影响Fig.6 Effect of IAA application on sucrose phosphate synthase (SPS) activities in cotton fibers (A),embryos (B) and seed coats (C)
2.4.3 IAA 处理对棉铃液泡转化酶(VIN)活性的影响 在棉铃3 个组分中(纤维、种胚、种皮),以纤维的VIN 活性最强,但随纤维发育呈下降趋势,在开花后30 d,IAA 处理的VIN 活性显著低于对照(图7-A);两处理种皮和种胚的VIN 活性随棉铃发育表现趋势一致,无显著差异(图7-B、C)。

图7 IAA 处理对棉花纤维(A)、种胚(B)和种皮(C)VIN 活性的影响Fig.7 Effect of IAA application on vacuole invertase (VIN) activities in cotton fibers (A),embryos (B) and seed coats (C)
2.4.4 IAA 处理对棉铃细胞壁转化酶(CWIN)活性的影响 棉铃发育初期CWIN 活性以纤维最高,并随纤维发育呈下降趋势,两处理间无显著差异(图8-A);种胚中的CWIN 活性随棉铃发育呈先下降后上升的趋势,且开花后30 d 时IAA 处理极显著高于对照(图8-B);而种皮中两处理CWIN 活性无显著差异(图8-C)。

图8 IAA 处理对棉花纤维(A)、种胚(B)和种皮(C)CWIN 活性的影响Fig.8 The effect of IAA application on CWIN activities in cotton fibers (A),embryos (B) and seed coats (C)b
3 讨论
3.1 IAA 处理棉铃对胚珠外表皮纤维原始细胞突起的影响
单个胚珠着生纤维数因棉花不同亚种和品种而异,受遗传和生理因素的影响。棉花纤维由胚珠外珠被上的部分表皮细胞经分化发育而成,可分化发育的表皮细胞比例约为10%至25%[33-34],因而,增加胚珠外表皮细胞分化为纤维细胞的比例,是提高棉花衣分和纤维产量的重要途径[35]。前人观察到陆地棉胚珠外表皮纤维细胞的启动发育始于开花当天[32,36-37],但Graves 等[38]发现在开花前若干日内部相关的生化变化就已发生。本研究发现施加IAA 使纤维原始细胞启动密度在开花当天显著增加(图1)。Gialvalis 等[26]观察到IAA 可以促进开花前后胚珠外表皮细胞分化为纤维细胞的数量,其中开花前施用的提高效果好于开花后。本研究发现,经IAA 处理后棉铃衣分略有提高,可能与IAA 促进胚珠外表皮纤维原始细胞的启动有关。Zhang 等[16]将IAA 生物合成基因iaaM与纤维特异性表达启动子FBP7 相连转入棉花后,引起胚珠表皮细胞IAA 水平的升高,促进纤维原始细胞的启动,转基因株系衣分显著提高,同时子指下降。Li等[39]报道开花当天单位面积胚珠纤维细胞突起的密度和开花后1 d 纤维伸长的密度与衣分呈高度正相关。但Romano 等[32]认为纤维启动密度不宜用于预测未来衣分的高低。
3.2 IAA 处理棉铃对胚珠和纤维蔗糖代谢关键酶活性和非结构性碳水化合物浓度的影响
蔗糖作为植物体内碳水化合物运输的主要形式,在棉铃种皮维管束末端卸载后,被分解成己糖分子或其衍生物,用于合成大分子贮藏物质,如纤维中的纤维素,种皮的淀粉及种胚的脂肪等[40]。因此,库器官蔗糖浓度高,表明大分子物质合成的底物丰富,有利于库器官物质合成。本研究检测到棉铃开花后20~40 d,相对于对照,IAA 处理的种胚含有更多的蔗糖,其中在开花后30 d 差异达到显著水平(图3-A);同时,IAA 处理种胚中SPS 活性在开花后30 d 也显著高于对照(图6-B),该酶主要催化UDPG 和6-磷酸果糖合成蔗糖,蔗糖浓度的升高对于种胚脂肪的合成有利。SS 是反映棉花种子库和纤维库强度一个重要的生化标记,酶活性高意味着库器官贮藏物质合成活性强[40-41]。SS作为库器官物质合成阶段催化蔗糖分解的主要酶,活性强有利于库端蔗糖的卸载,加强蔗糖向库端的输出[23,42-43]。Xu 等[43]报道增加棉花胚珠SS 活性可促进早期种子发育,提高结子率。本研究表明,开花后30~40 d,IAA 处理种胚SS 活性显著高于对照(图5-B)。与SS 和SPS 活性在开花后30 d 的表现相同,IAA 处理的种胚CWIN 活性也显著提高(图8-B)。CWIN 能够促进种子充实,可能通过调控蔗糖卸载,建立和维持库强起作用[24]。
棉花种皮富含的淀粉是种皮中非结构性碳水化合物的主要存在形式[40]。本研究发现经IAA 处理后,种皮在开花后20~40 d(图4-C),种胚在开花后30~40 d(图3-C),淀粉浓度均显著或极显著高于对照,表明IAA 处理显著增强了种胚和种皮合成淀粉的能力。种皮中的淀粉可以被分解成己糖,转运到胚中,在棉花胚珠发育中期阶段是一种重要的碳代谢中间产物,可以用于种胚脂肪和蛋白质的合成[42]。IAA 处理的种皮SS 活性在开花后20~30 d 呈显著或极显著提高(图5-C),进一步证实IAA 处理可增强种皮的物质合成能力。
IAA 处理后,在开花后30 d 检测到纤维中己糖和淀粉浓度较对照有极显著提高(图2-B、C)。己糖是棉纤维含量最高的非结构性碳水化合物形式[44],也是最重要的渗透调节物质之一,对驱动纤维伸长具有重要作用[21]。纤维伸长主要发生在棉铃开花后20 d内[19]。因此开花后30 d 检测到的高浓度己糖对纤维伸长可能没有贡献。本研究也观察到经IAA 处理的棉铃纤维长度与对照无显著差异(数据未列出)。与纤维中碳水化合物的表现不同,IAA 处理的棉纤维蔗糖代谢关键酶活性与对照相似或低于对照,如开花后20 d 的SS 活性(图5-A)和开花后30 d 的VIN(图6-A)活性,均显著或极显著低于对照。VIN 催化蔗糖不可逆分解为葡萄糖和果糖(己糖),SS 负责催化蔗糖可逆分解为UDPG 和磷酸果糖[23-24]。经IAA 处理的棉纤维在开花后20~30 d 表现出较低的VIN 和SS 活性,预计会产生较少的己糖分子,而这与开花后30 d棉纤维较高的己糖浓度相悖。其原因还需要进一步探讨。
4 结论
结果表明,IAA 涂抹棉铃后,可促进开花当日棉花胚珠外表皮产生更多的纤维细胞突起,其可能是导致IAA 处理衣分更高的原因。与对照相比,IAA 处理提高了种胚开花后30~40 d 蔗糖合成酶活性,开花后30 d 磷酸蔗糖合成酶活性及种皮开花后20~30 d 蔗糖合成酶活性,相应增加了蔗糖和淀粉等非结构性碳水化合物的浓度,增强了种子库的物质合成能力,有利于种子增大。这可能是导致单铃重增加的一个重要原因。本研究初步揭示了IAA 影响棉铃产量性状形成的蔗糖代谢机理,为IAA 在棉花生产上的应用,促进棉花高产稳产提供了技术思路。
