盐胁迫下燕麦光合及叶绿素代谢变化研究
2021-07-27马祥贾志峰刘勇
马祥,贾志峰,刘勇
(1.青海大学畜牧兽医学院,西宁 810016;2.青海省青藏高原优良牧草种质资源利用重点实验室,西宁810016)
盐碱地是制约我国农业生产的重要因素,据报道,我国约有9.913×107hm2盐碱地,其中已开垦种植面积5.77×106hm2[1]。碱性土壤的形成通常是由NaHCO3和Na2CO3积累造成[2]。盐碱含量过高通常导致土壤板结、肥力下降、植物生长抑制[3]。客土法和淋洗法是缓解土壤盐碱胁迫的重要措施,但其成本高、工作量大且不能从根本上解决盐碱地问题[1]。因此,探究植物适应盐碱胁迫机制,培育盐碱耐受型作物对农业生产和生态环境均具有积极意义。
通常认为,土壤中离子浓度过高一方面导致植物受到渗透胁迫,不利于自身水分保持;另一方面,盐离子进入植物体造成膜质损伤,不利于植物生长发育[4,5]。同时,盐胁迫下土壤pH变高,破坏根部细胞结构,影响根系正常生理功能[6,7]。此外,pH可导致土壤中部分离子溶解度降低或导致离子自由度降低,影响植物对离子的吸收[8]。离子代谢稳态的改变和组织pH平衡破坏通常导致植物萎蔫和发黄[6,9]。植物有多种途径抵御盐胁迫,例如根系抗盐性[10]、叶片泌盐[11]以及Na+在液泡中的区隔化[12]。除此之外,植物还可通过调节自身渗透调节物质如:游离脯氨酸、甜菜碱、可溶性糖等适应胁迫环境[13,14]。
盐胁迫下,植物光合作用减弱,过量的光照导致光和系统Ⅱ(PSⅡ)和光和系统Ι(PSΙ)活性减弱,光合速率下降,造成活性氧(Reactive Oxygen Species,ROS)爆发,引起氧化胁迫[15]。PSⅡ和PSΙ是光合色素蛋白复合物,PSⅡ介导从水到质体醌的非循环电子传递,藻胆蛋白作为PSⅡ的主要捕光天线附着在类囊体膜基质表面,盐胁迫下,藻胆蛋白含量降低,阻断了能量从藻胆蛋白到PSⅡ的传递[16]。众多研究表明,盐胁迫下植物叶绿素含量、净光合速率、蒸腾速率、气孔导度降低,胞间二氧化碳浓度升高[17-19]。有效的光保护机制可以提高植物的抗逆性,植物可通过D1蛋白的快速周转[20]、提高抗氧化酶活性[15]、PSΙ系统中的电子流循环[21]、光呼吸和叶黄素循环[15,20]等途径适应胁迫条件下的光抑制。植物根系感受到盐胁迫信号后,由脱落酸(Abscisic Acid,ABA)传递至地上部分,导致气孔关闭[22]。有研究指出,光合作用通路上的基因和蛋白一般与胁迫相关性较小[23],而与胁迫后的恢复相关性较大[24]。尽管以上研究揭示了大量光合作用相关机制,但光合作用在盐胁迫条件下的分子机制尚不明确。
燕麦是我国重要的牧草资源,主要在我国北方地区种植,具有适口性好、营养丰富、草产量高、抗逆性强等优点[25]。我国北方地区土壤盐碱化严重,给牧草种植繁育和生态环境带来严重危害。通过探究燕麦在盐胁迫条件下的适应机制,改善作物本身对盐碱胁迫的适应能力,对缓解盐碱胁迫对燕麦生产造成的不良影响及改善生态环境均具有重要的实践意义。
1 材料与方法
1.1 试验材料
采用由青海畜牧兽医科学院提供的燕麦 “青燕一号”为试验材料。试验在青海省畜牧兽医科学院实施。
1.2 试验设计与处理
选取颗粒饱满、大小一致的燕麦种子若干,用蒸馏水冲洗干净,70%酒精浸泡1min,20%次氯酸钠浸泡15min,蒸馏水冲洗5~6次,晾干后均匀栽种至填装蛭石的育苗钵(10cm×10cm)中,每钵25株,每天喷洒蒸馏水至种子萌发后用Hoagland营养液预培养14d后施加处理。
将碳酸氢钠(NaHCO3)溶解至Hoagland营养液中模拟盐胁迫,NaHCO3浓度为200mmol/L,以不施加处理且仅添加Hoagland营养液的燕麦幼苗为对照(CK),分别在处理后1d、3d、5d、7d时测定其各项指标。
1.3 测定指标
叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(TChl):采用95%乙醇浸泡法[26]。
净光合速率(Pn)、蒸腾速率(Tr)、胞间二氧化碳浓度(Ci)、气孔导度(Gs):采用GSF-3000光合仪测定,选择标准叶室面积8cm2,设置光照强度1400 μmol m-2s-1,测定各项指标,每个处理3次重复。
原卟啉(IX)、镁—原卟啉(Mg-IX)、原叶绿素酸酯(PChl):参照牛奎举[20]的方法。
基因表达量:采用实时荧光定量(qRT-PCR)的方法,在LightCycler 96实时荧光定量仪(Roche,瑞士)中执行qRT-PCR分析,采用的试剂盒为SYBR RPremix DimerEraserTMKit (TaKaRa,日本),反应体系20 μL,每个处理三个重复,内参基因为Asactin[27],采用2-△△CT法计算基因相对表达量。使用Primer3(version 0.4.0)(http://bioinfo.ut.ee/primer3-0.4.0/)进行引物设计。基因特异性引物序列如下表。
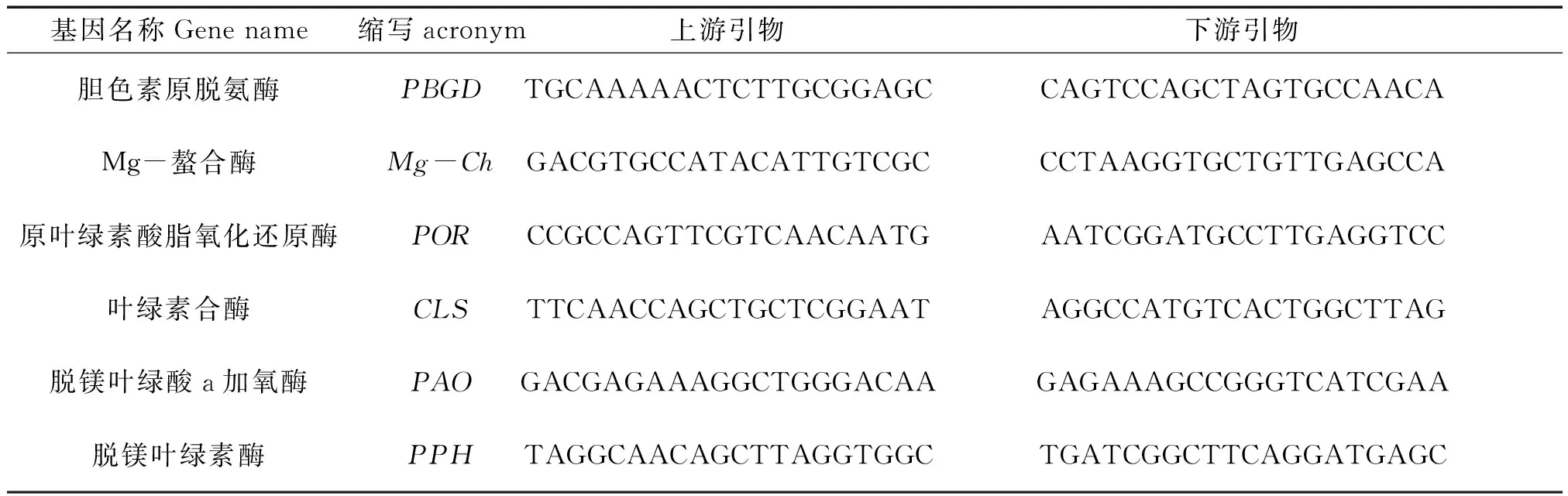
表1 基因列表及其引物序列
2 结果与分析
2.1 盐胁迫对燕麦叶绿素和Protocol IX、Mg-IX 、PChl含量的影响
图1显示,盐胁迫下燕麦叶片 Chla、Chlb、TChl、Proto IX、Mg-Proto IX、PChl含量均随处理天数增加而显著下降(P<0.05)。Chlb和PChl含量在处理1d时,与CK相比差异不显著(P>0.05);处理第7d时,Chlb降幅最大,比CK降低73.54%,差异极显著(P<0.001)。PChl在处理后7d时含量比CK降低22.68%,降幅最小。相对于盐胁迫对Proto IX、Mg-Proto IX、PChl含量的影响而言,盐胁迫下Chla、Chlb、TChl下降趋势更为明显。
2.2 盐胁迫对燕麦光和、蒸腾和呼吸特性的影响
图2显示,盐胁迫下,燕麦叶片Pn、Tr、Gs均呈显著降低趋势(P<0.05),胞间二氧化碳浓度增加。在胁迫后1d时,燕麦叶片Pn、Tr、Ci变化相对Gs而言较小,而处理1d即可对燕麦叶片Gs产生极显著抑制作用(P<0.001)。处理至第7d时,燕麦叶片Pn、Tr、Gs与CK相比均产生极显著差异(P<0.001),分别比CK降低67.29%、70.07%、66.87%。而Ci随着处理天数增加,也依次增加,依次比CK增加2.25%、11.42%、23.48%、28.29%,相对Pn、Tr、Gs而言,盐胁迫对燕麦叶片Ci影响较小。
2.3 盐胁迫对燕麦叶绿素合成途径基因表达的影响
图3显示,盐胁迫下,处理时间为1d时,Mg-Ch基因上调表达,而PBGD、PRO和CLS基因均下调表达,随着处理时间增加至3d以后,PBGD、PRO、Mg-Ch和CLS基因均下调表达。PRO基因和CLS基因均在处理3d时即显著下调,此后,随着处理时间增加,PRO基因和CLS基因均显著下调。PBGD基因在第7d时相对表达量显著下调,而Mg-Ch基因在处理第5d和第7d时均显著下调。
2.4 盐胁迫对燕麦叶绿素降解途径基因表达的影响
盐胁迫显著诱导燕麦叶片叶绿素降解途径PAO和PPH基因上调表达(图4),随着处理天数增加,PAO基因和PPH基因上调表达量亦随之增加。处理第5 d时PAO基因相对表达量最高,比CK高45.70倍,盐胁迫诱导的PAO基因表达变化比PPH基因更加明显。
3 讨论
叶绿素是植物进行光合作用的主要色素,通常认为,叶绿素合成分为四个阶段,第一阶段为来自谷氨酸或α-酮戊二酸经δ-氨基酮戊酸合成的PBG;进入第二阶段,PBG作为底物,聚合形成Proto IX,Proto IX进一步结合Mg形成Mg-ProtoIX;在第三阶段,PChl在NADPH和光照条件下进行还原反应,生成叶绿酸酯a作为第四阶段生成叶绿素的前体物质;进入第四阶段后,加叶醇尾巴形成Chla,Chla的甲基被醛基取代形成Chlb,至此Chla和Chlb合成[13,20,23]。本研究中,盐胁迫导致燕麦叶片Proto IX、Mg-Proto IX、PChl含量显著降低,抑制Chla和Chlb合成,同时,Chla、Chlb、TChl含量显著降低,可能是因为一方面,盐胁迫抑制叶绿素从头合成,另一方面,盐胁迫破坏叶绿素结构,导致叶绿素含量降低。类似的结果还出现在关于番茄(SolanumlycopersicumL.)[28],玉米(ZeamaysL.)[29],甜瓜(CucumismeloL.)[30]等植物中。
叶绿素合成需要一系列的酶促反应参与,PBGD基因是叶绿素合成通路上游的重要酶,土豆(SolanumlycopersicumL.)在盐胁迫下PBGD基因显著下调表达,抑制叶绿素合成[31]〗,本研究中,盐胁迫也导致燕麦叶片PBDG基因显著下调,说明盐胁迫可通过抑制PBDG基因表达而抑制燕麦叶片中的叶绿素合成。在关于蚕豆(ViciafabaL.)的研究中发现了一种ABA受体蛋白,被命名为ABAR(Putativeabscisicacidreceptor)。此基因作为ABA特定的受体蛋白接收ABA信号并调控气孔关闭,而Mg-Ch基因可以与ABAR基因特异性结合,介导ABA信号在质体与细胞核信号之间的传递。除此之外,Mg-Ch基因在叶绿素合成中叶具有核心作用[32-34]。在我们的研究中,盐胁迫导致Mg-Ch基因在第1d时上调表达,随后下调表达,可能是因为第1d时植物感受到盐胁迫信号后产生的防御反应,而随着处理时长增加,盐胁迫抑制Mg-Ch基因表达。通常认为POR基因在植物发育中具有关键作用,POR基因催化叶绿素合成的最后步骤合成叶绿素酸酯,在生物环境中,这种酶催化的光反应引发了植物形态发育的显著,在超微结构水平上表现为对质膜的修饰和重组[35,36]。本研究中,盐胁迫导致燕麦叶片POR基因显著下调,结果显示了盐胁迫对燕麦叶片叶绿素合成的抑制作用。CLS基因已被证明参与热胁迫下拟南芥叶绿素周转中的叶绿素再利用过程[37],叶绿素合酶活性的降低可导致δ-氨基酮戊酸含量减少和Mg、Fe螯合酶活性降低,而CLS基因表达可增强δ-氨基酮戊酸合成并增加螯合酶活性[38]。本研究中,盐胁迫导致CLS基因显著下调,这可能是导致叶绿素代谢抑制的重要原因。通过分析PBGD基因、Mg-Ch基因、POR基因、CLS基因在盐胁迫下的表达模式,证明盐胁迫对叶绿素关键合成酶具有明显抑制作用,影响叶绿素合成,但Mg-Ch基因在第1d时上调表达,可能是燕麦相应盐胁迫的候选基因。
叶绿素在胁迫条件下或衰老过程中的分解是植物发育过程中必不可少的一部分,叶绿素降解导致无色分解代谢产物的积累。脱镁叶绿酸a加氧酶和叶红素分解还原酶参与脱镁叶绿酸卟啉环的氧解,PAO基因表达只在叶片衰老过程中增加其活性。因此认为,PAO基因是叶绿素分解代谢的关键调节因子[39,40]。本研究发现,盐胁迫下PAO基因显著上调表达,因此认为,盐胁迫可能导致叶绿素降解加快。PPH基因是广泛分布于藻类和陆地植物中于叶绿体中的由衰老诱导的基因,在拟南芥中PPH基因特异性分解脱镁叶绿素并生成脱镁叶绿酸,而拟南芥PPH基因突变体pph-1在叶片衰老时叶绿素在叶片积累,拥有保持绿色的表型性状[41]。盐胁迫下,燕麦叶片PPH基因显著上调,这可能是叶绿素降解的另一重要原因。因此,盐胁迫导致燕麦叶绿素降解关键基因上调是其叶绿素代谢失衡的重要原因。且PAO基因表达量变化更加显著,证明其在叶绿素降解途径具有更关键的作用。
净光合速率是植物光合作用积累有机物效率的重要指标,王宁[42]等研究发现,盐胁迫导致酸浆(PhysalispubescensL.)净光合速率先增后降,在低浓度下促进光合,而高浓度盐胁迫导致净光合速率下降,抑制光合作用。植物蒸腾作用不仅受外界环境条件的影响,也受到自身条件的影响,盐胁迫导致植物体内渗透势变化已被广泛报道[43-45]。同时,气孔导度是影响光合作用、蒸腾作用和呼吸作用的主要因素,影响氧气和二氧化碳及水分在植物体内的流通[17,18,30]。本研究中,盐胁迫导致燕麦叶片净光合速率、蒸腾速气孔导度显著降低,胞间二氧化碳浓度增加,可能是因为盐胁迫引起燕麦体内渗透势变化并抑制叶绿素合成,加快叶绿素降解。
4 结论
盐胁迫可抑制燕麦叶片叶绿素合成基因表达,促进叶绿素降解基因表达,抑制叶绿素前体物质的合成并减少叶绿素含量,抑制植物光合作用并降低净光合速率。同时,盐胁迫可降低燕麦叶片蒸腾速率及增强其呼吸作用。Mg-Ch基因可能是燕麦响应盐胁迫的关键基因,而PAO基因在盐胁迫下燕麦叶绿素降解中发挥关键作用。
