黄连解毒汤调控肠道菌群抗apoE-/-小鼠非酒精性脂肪性肝病和动脉粥样硬化的研究❋
2021-07-26张媛媛马雅銮
姜 楠, 薛 欣, 张媛媛, 陈 晨, 曾 辉, 马雅銮△
(1.中国中医科学院中医基础理论研究所, 北京 100700; 2.首都医科大学附属北京地坛医院传染病研究所, 北京 100015; 3.新发突发传染病研究北京市重点实验室, 北京 100015)
2019年《从我国心血管病流行趋势看胆固醇的干预策略》指出,2012年我国18岁以上人群血脂异常患病率高达40.4%,且近年来一直呈现上升趋势[1]。高脂血症与长期高脂饮食、肝脏负担加重、脂代谢障碍有关,可导致非酒精性脂肪性肝病(non-alcholic fatty liver disease,NAFLD) 和动脉粥样硬化( atherosclerosis,AS)发生[2-3]。
课题组在既往研究中发现,高脂饮食可导致载脂蛋白E基因敲除(apolipoprotein E gene knockout,apoE-/-)小鼠NAFLD和AS[4-5],黄连解毒汤干预可减轻NAFLD和AS病变[5-6],主要机制与黄连解毒汤降低单核细胞比例、减轻高脂造成的粒细胞活化、增加肝脏替代活化型M2巨噬细胞有关,且黄连解毒汤的这些作用独立于降脂作用[5-7]。
近期研究发现,高脂饮食可导致肠道菌群失衡、菌群结构发生改变。菌群失衡不仅扰乱机体胆固醇代谢,还会激活机体免疫引发炎症反应,加速高脂血症、NAFLD和AS[8]。在本研究中,探讨黄连解毒汤能否改善apoE-/-小鼠肠道菌群失衡,进一步揭示黄连解毒汤调节NAFLD和AS的作用机制。本研究符合中国中医科学院中医基础理论研究所实验动物福利伦理审查委员会标准,动物实验伦理审查编号2018-071。
1 材料与方法
1.1 动物
8周龄雌性C57BL/6及apoE-/-小鼠,体质量(20±2)g,动物合格证号1100111911050036。实验用鼠购自北京大学实验动物中心,动物许可证号SCXK(京)2016-0010,实验用鼠饲养于北京大学实验动物中心SPF动物房,采用标准饲料分笼饲养,自由饮水,室内温度( 22±2) ℃,室内湿度(45±5)%,光照时间为12 h/12 h明暗交替。
1.2 药物
黄连解毒汤组成:黄连9 g,黄芩6 g,黄柏6 g,栀子9 g,购自北京同仁堂药店(药物批号黄连20140208,黄芩20140111,黄柏109213101,栀子13121901)按煎煮取汁,浓缩成相当于0.5 g/mL生药含量;阿托伐他汀购自辉瑞制药有限公司,20 mg/片,批号为S36972。
1.3 试剂及仪器
胆固醇(cholesterol,TC,批号CH0101152)、甘油三酯(triglyceride,TG,批号CH0101151)、高密度脂蛋白(high density lipoprotein,HDL,批号CH0101161)、低密度脂蛋白(low density lipoprotein,LDL,批号CH0101162)、丙氨酸转氨酶(alanine aminotransferase,ALT,批号CH0101201)和天冬门氨酸转氨酶(aspartate transaminase,AST,批号CH0101202)试剂盒,四川Maccura公司;单胺氧化酶(monoamine oxidase,MAO)检测试剂盒(批号A034-1-1),南京建成公司;QIAampDNA Stool Mini Kit试剂盒(批号Qiagen51504),德国QIAGEN公司;Q5超保真DNA聚合酶(批号#M0494X),美国New England Biolabs公司;MiSeq Reagent Kit v2(批号MS-103-1003),美国Illumina公司;Kapa文库定量试剂盒(批号KK4824),瑞士Roche公司。
Beckman CX4全自动生化分析仪(美国贝克曼·库尔特公司);GENESYS 10 S Vis 紫外可见分光光度计(美国Thermo公司);伯乐T100型梯度PCR仪(美国Bio-Rad公司);Illumina Miseq 测序仪(美国Illumina公司)。
1.4 动物分组及干预方法
实验分5组各10只小鼠。C57BL/6普通饮食(C57BL/6+CD)为对照组;apoE-/-小鼠采用配对比较法随机分为apoE-/-普通饮食(apoE-/-+CD)、高脂饮食(apoE-/-+WD)、高脂饮食,同时给予黄连解毒汤(apoE-/-+WD+HLJDD)或阿托伐他汀(apoE-/-+WD+Atr)。高脂饲料由78.85%基础饲料、21%脂肪、0.15%胆固醇组成。每周检测体质量变化,干预组小鼠根据体质量每天给予临床等效剂量(黄连解毒汤[5 g/(kg·d)] 、阿托伐他汀[3 mg/(kg·d)]),其他小组采用等量纯净水灌胃,分别干预4周和18周。
1.5 检测指标及方法
干预4周后每组取5只小鼠。小鼠异戊烷吸入麻醉,摘眼球采血,EDTA抗凝,离心分装血浆,用于血脂和单胺氧化酶检测;处死小鼠取肝脏进行单胺氧化酶检测,取结肠内容物用于16 S rDNA测序分析。余下小鼠继续干预至18周,异戊烷吸入麻醉,取肝脏和胸腹主动脉,用于病理检测油红O染色。
1.5.1 血脂和肝功能测定 干预4周小鼠的血浆采用过氧化酶法测定血浆TC,脂肪酶/甘油磷酸酯氧化酶-过氧物酶比色法测定TG,直接法测定HDL、LDL、ALT和AST水平。
1.5.2 结肠内容物菌群检测 干预4周小鼠的结肠内容物采用QIAamp DNA Stool Mini Kit试剂盒提取DNA。采用两步PCR法,先扩增16 S rDNA V3-V4区,然后采用带有序列标签(Barcode)的接头引物进行第二次PCR反应,反应产物纯化后,采用KAPA文库定量试剂盒对测序文库进行精确定量。测序采用Illumina Miseq测序平台,测序策略为250PE,每个文库测序量100K reads,测序结果进行生物信息分析。原始reads采用QIIME软件进行拼接后,根据每个文库的 Barcode 和样品的index识别样品,将reads拆分到各个样品中。利用GreenGenes数据库(http://greengenes.secondgenome.com/)比对高质量数据,将序列相似度≥97%进行OTU划分。最后采用R(3.4.3)软件和Past 3.0软件,对数据进一步进行高级分析和可视化分析,计算样本α和β多样性。
1.5.3 MAO检测 干预4周的C57BL/6及apoE-/-小鼠的肝脏组织匀浆,提取蛋白测定蛋白浓度。采用MAO检测试剂盒分别检测血浆和提取肝组织蛋白的MAO活力。
1.5.4 病理染色 干预18周小鼠的肝脏和胸腹主动脉,用4%多聚甲醛固定,20%蔗糖脱水,肝组织病理切片,肝组织和胸腹主动脉经油红O染色、分化后镜下观察。
1.6 统计学方法

2 结果
2.1 各组小鼠体质量和血脂水平变化
表1示,与C57BL/6小鼠比较,普通饮食没有造成apoE-/-小鼠体质量明显变化。apoE-/-小鼠高脂饮食,体质量增加(P<0.05),黄连解毒汤和阿托伐他汀干预体质量没有明显改善(P>0.05)。

表1 各组小鼠体质量和血脂水平比较
血脂变化与既往研究一致,与C57BL/6小鼠比较,apoE-/-小鼠TC和LDL水平升高,HDL水平降低(P<0.001);高脂饲喂的apoE-/-小鼠TC和LDL水平进一步升高(P<0.001)。黄连解毒汤干预后,小鼠血脂水平未见明显改变(P>0.05)。
2.2 各组小鼠肝功能ALT和AST水平变化
表2示,各组小鼠干预4周,肝功能ALT和AST水平无明显变化。

表2 各组小鼠血浆ALT和AST水平比较
2.3 各组小鼠结肠菌群变化情况
2.3.1 各组小鼠结肠菌群的α多样性变化 图1示,与C57BL/6小鼠比较,apoE-/-小鼠结肠菌群α多样性虽然降低,但差异无统计学意义(P>0.05)。高脂饮食导致apoE-/-小鼠结肠菌群α多样性增加(P<0.05),黄连解毒汤降低结肠菌群α多样性(P<0.05)。
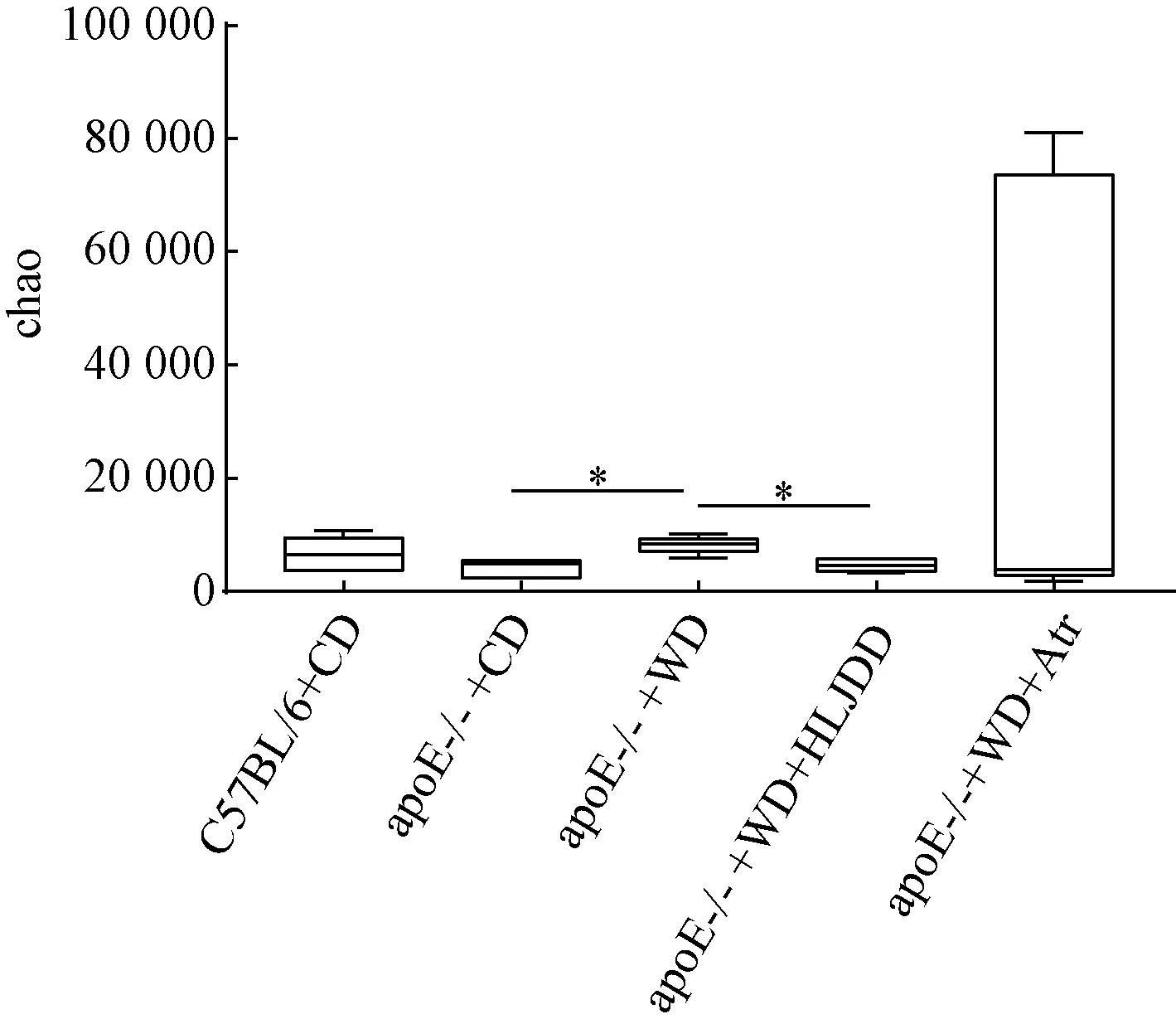
注:C57BL/6+CD为 C57BL/6普通饮食;apoE-/-+CD为apoE-/-普通饮食;apoE-/-+WD为apoE-/-高脂饮食;apoE-/-+WD+HLJDD为apoE-/-高脂饮食加黄连解毒汤;apoE-/-+WD+Atr为apoE-/-高脂饮食加阿托伐他汀。与apoE-/-+WD比较:*P<0.05
2.3.2 各组小鼠结肠菌群的β多样性变化 图2示,分析小鼠结肠菌群门水平差异发现,与C57BL/6小鼠比较,apoE-/-小鼠结肠厚壁菌门(Firmicutes)增加,疣微球菌门(Verrucomicrobia)显著减少,脱铁杆菌门(Deferribacteres)和蓝藻门(Cyanobacteria)减少;高脂饮食进一步导致apoE-/-小鼠结肠变形菌门(Proteobacteria)增加,拟杆菌门(Bacteroidetes)减少。黄连解毒汤增加拟杆菌门,尤其是显著增加疣微球菌门,减少结肠的厚壁菌门和变形菌门;阿托伐他汀进一步增加结肠的厚壁菌门,减少拟杆菌门,增加脱铁杆菌门细菌。

注:C57BL/6+CD为 C57BL/6普通饮食;apoE-/-+CD为apoE-/-普通饮食;apoE-/-+WD为apoE-/-高脂饮食;apoE-/-+WD+HLJDD为apoE-/-高脂饮食加黄连解毒汤;apoE-/-+WD+Atr为apoE-/-高脂饮食加阿托伐他汀。Bacteroidetes为拟杆菌门,Firmicutes为结肠厚壁菌门,Verrucomicrobia为疣微球菌门,Proteobacteria为变形菌门,Deferribacteres为脱铁杆菌门,Cyanobacteria为蓝藻门
2.3.3 各组小鼠结肠菌群厚壁菌门/拟杆菌门(F/B)比值的变化 表3示,与C57BL/6小鼠比较,apoE-/-小鼠结肠厚壁菌门增加(P<0.05),拟杆菌门减少,厚壁菌门/拟杆菌门(firmicutes/bacteroidetes, F/B)比值增加,但差异无统计学意义(P>0.05)。高脂饲喂apoE-/-小鼠F/B比值进一步增加,黄连解毒汤减少F/B比值。但因组间差异大,各组之间F/B比值差异无统计学意义。

表3 各组小鼠肠道菌群F/B变化比较
2.4 各组小鼠血浆和肝脏单胺氧化酶活力变化
表4示,单胺氧化酶(monoamine oxidase,MAO)活性高低能够间接反映肠道菌群失衡程度[9]。我们发现,与C57BL/6小鼠比较,apoE-/-小鼠血浆和肝脏的MAO活力无明显改变(P>0.05);高脂饲喂apoE-/-小鼠血浆和肝脏的MAO活力增加(P<0.05);黄连解毒汤减少血浆和肝脏的MAO活力(P<0.05)。阿托伐他汀减少血浆MAO活力(P<0.05),但无明显改变肝脏的MAO活力(P>0.05)。

表4 各组小鼠血浆及肝脏MAO活力变化比较
2.5 各组小鼠肝脏病理改变情况
图3示,干预18周后,普通饮食的apoE-/-小鼠肝脏油红O染色呈阳性,高脂饮食导致油红O染色阳性增强。黄连解毒汤干预明显减弱油红O染色程度,肝脏脂肪病变明显减轻;阿托伐他汀一定程度减弱肝脏油红O染色。
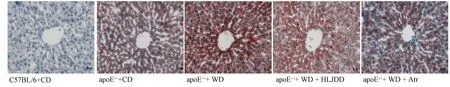
注:C57BL/6+CD为 C57BL/6普通饮食;apoE-/-+CD为apoE-/-普通饮食;apoE-/-+WD为apoE-/-高脂饮食;apoE-/-+WD+HLJDD为apoE-/-高脂饮食加黄连解毒汤;apoE-/-+WD+Atr为apoE-/-高脂饮食加阿托伐他汀
2.6 各组小鼠主动脉斑块形成情况
图4示,干预18周后,胸腹主动脉血管油红O染色可见,高脂饮食导致apoE-/-小鼠主动脉胸腹血管斑块AS病变程度严重;黄连解毒汤干预后,主动脉斑块AS病变程度减轻;阿托伐他汀一定程度减轻主动脉斑块AS病变。

注:C57BL/6+CD为 C57BL/6普通饮食;apoE-/-+CD为apoE-/-普通饮食;apoE-/-+WD为apoE-/-高脂饮食;apoE-/-+WD+HLJDD为apoE-/-高脂饮食加黄连解毒汤;apoE-/-+WD+Atr为apoE-/-高脂饮食加阿托伐他汀
3 讨论
肠道菌群失衡是NAFLD和AS独立的危险因素之一[10-11]。高脂饮食不仅导致血脂水平升高,并且由于大量的脂肪在肠道被消化吸收,引发肠道胆汁酸成分和含量的改变,影响细菌生存的环境,导致肠道菌群失衡[8,12]。失衡的肠道菌群反过来影响机体胆固醇代谢和免疫,加速高脂血症、NAFLD和AS的进展[8,10-11]。
本研究发现,高脂饮食引发的肠道菌群失衡有两个特征:一方面导致apoE-/-小鼠肠道厚壁菌门和变形菌门等条件致病菌丰度增加,厚壁菌门/拟杆菌门比升高[13];另一方面,拟杆菌门和疣微球菌门等益生菌减少或消失。已有研究表明,厚壁菌门的李斯特菌、葡萄球菌、链球菌,以及变形菌门的大肠杆菌、沙门氏菌、幽门螺杆菌等条件致病菌与肥胖、炎症和AS相关[13-15]。而拟杆菌门的拟杆菌和疣微球菌门的艾克曼菌等益生菌与炎症和代谢紊乱负相关,可防治肥胖、糖尿病和AS[13,16-18]。另外本研究还发现,与正常小鼠比较,普通饮食apoE-/-小鼠结肠菌群α多样性差异无统计学意义,高脂饲喂后α多样性增高,说明apoE基因缺失导致的高脂血症对于肠道菌群影响不大,而高脂饮食则显著增加了肠道菌群多样性,提示高脂饮食对于肠道菌群的影响及其重要作用。
进一步的研究发现,肠道菌群失衡影响机体胆固醇代谢[8,11]。菌群失衡导致分解胆碱生成三甲胺(trimethylamine,TMA)增多,TMA诱导MAO,MAO的活力可以间接反映肠道菌群失衡的程度[9]。MAO进一步氧化TMA生成氧化三甲胺(trimethylamine oxide,TMAO),TMAO与NAFLD正相关[20],而且抑制胆固醇逆向转运和促进胆固醇流入巨噬细胞,促进AS发生[8,19]。本研究发现,与肠道菌群变化一致,高脂喂饲增加了apoE-/-小鼠血浆和肝脏的MAO活力,而普通饮食apoE-/-小鼠MAO的活力没有明显改变。这一结果将高脂饮食导致的菌群失调,与高脂饮食加重apoE-/-小鼠肝脏损伤和AS进展进一步联系起来。
本课题组既往研究已证实,高脂饮食可以造成免疫损伤和炎症反应,黄连解毒汤能够纠正高脂饮食导致apoE-/-小鼠的免疫过度活化,降低单核细胞及其表面Toll样受体4(Toll like receptor 4,TLR4)的表达,增加肝脏M2巨噬细胞比例,抑制炎性因子表达等,减轻全身、血管和肝脏局部炎症反应[5-7]。本研究进一步证实,黄连解毒汤干预降低高脂引发的结肠菌群α的多样性,减少条件致病菌,增加益生菌,改善高脂引发的apoE-/-小鼠菌群失衡,降低高脂导致apoE-/-小鼠肝脏和血浆单胺氧化酶活力。虽然本研究未证明肠道菌群与炎症变化的直接关系,但已有大量研究表明,菌群失衡促进炎症反应和免疫损伤。如革兰阴性杆菌释放出的脂多糖(lipopolysaccharide,LPS),可诱导免疫细胞TLR4表达;革兰氏阳性细菌肽聚糖增强免疫反应,促进NAFLD和AS的形成[8,20-21]。在本研究干预的4周和18周范围内(结果未显示),黄连解毒汤对于血脂的影响差异无统计学意义,但黄连解毒汤通过改善长期持续高脂引发的菌群失衡和后续的免疫损伤作用于全身和局部(肝脏和主动脉),因而抑制高脂血症向NAFLD和AS发展。
综上所述,本研究发现黄连解毒汤干预可以调节肠道菌群失衡,降低MAO活性,抑制NAFLD和AS斑块的形成。课题组一系列的研究表明,黄连解毒汤对于炎性免疫反应及肠道菌群的影响,揭示了黄连解毒汤的多靶点治疗机制[5-7,22-23]。课题组今后还将进一步开展和深入相关研究,有望推动中医药在NAFLD和AS等代谢性疾病的应用。
