不同分子质量丝素蛋白的分离与表征
2021-07-26丁梦瑶戴梦男徐晶晶王建南
丁梦瑶, 戴梦男, 李 蒙, 刘 苹, 徐晶晶, 王建南,2
(1. 苏州大学 纺织与服装工程学院, 江苏 苏州 215123; 2. 苏州大学 现代丝绸国家工程实验室, 江苏 苏州 215123)
蚕丝(家蚕丝)主要由丝素蛋白和丝胶蛋白构成,其中丝素蛋白占70%~80%,由重链(H链)、轻链(L链)和糖蛋白(P25链)组成,物质的量比为6∶6∶1,分子质量分别为390、25和30 ku[1]。丝素蛋白具有无可比拟的皮肤亲和性,采用混纺、表面接枝丝素蛋白或丝素蛋白后整理可改善合成纤维的舒适性和染色性等。此外,丝素蛋白在用于细胞外基质、组织工程支架、药物载体等生物医用材料领域已取得了突破性的研究。
无论用于对传统纺织品性能的改良还是医用材料的研究,丝素蛋白分子质量的大小及其分散程度是影响丝素蛋白性能的主要因素,许多学者尝试通过调节丝素蛋白的分子质量来调控其结构与性能。再生丝素蛋白制备过程中,溶解家蚕丝素蛋白纤维的溶剂通常用含有氯化钙的三元溶液[2-3]和溴化锂溶液[4-5]。现有研究指出,调控溶解条件可有效地改变丝素蛋白溶液的分子质量分布[6]。如脱胶的丝素蛋白纤维在50 ℃三元溶液中溶解24 h,得到的丝素蛋白分子质量分布在17~63 ku之间,平均分子质量约为42 ku[7],这种低分子质量的丝素蛋白粉末能显著激活凝血级联反应的内在途径,促进止血。丝素蛋白纤维在85 ℃的三元溶液中,通过溶解不同时间可以制备出分子质量在16~450 ku范围的丝素蛋白[8]。当采用溴化锂溶液溶解时,在90 ℃溶解6 h获得的丝素蛋白分子质量分布在25~120 ku之间,在60 ℃溶解1 h的丝素蛋白分子质量分布在20~250 ku之间[9],并且较低分子质量和分子质量分布窄的丝素蛋白制备的微球形貌更好、表面更光滑。使用不同截留分子质量的透析袋也可有效调控分子质量分布的范围,当使用截留分子质量为100 ku的透析袋透析丝素蛋白溶液时,可得到分子质量高于80 ku的丝素蛋白,这种丝素蛋白具有较高的疏水性和较低的表面张力[10]。
另外有研究指出,通过不同的脱胶工艺(改变脱胶剂种类、浓度、脱胶时间等)也可改变再生丝素蛋白的分子质量[11-13]。无论是改变脱胶工艺还是调控溶解参数,获得的丝素蛋白仍是分子质量连续分布的高分散性混合物,虽然透析袋规格可控制分子质量的范围,但透析袋规格有限,难以获得各级别分子质量且分散系数较小的丝素蛋白。凝胶层析是利用被分离物质分子大小不同及固定相具有分子筛的特点,将被分离物质按分子大小分开,达到分离的目的[14],但极少用于丝素蛋白的分离[15],也没有对分离条件进行探索的报道。本文使用葡聚糖凝胶G-15对溶解的丝素蛋白脱盐后,进一步使用分离范围为5~800 ku的葡聚糖凝胶 G-200对不同分子质量的丝素蛋白进行分离,探索层析柱层流面积、丝素蛋白质量浓度及流速等因素对分离效果的影响,进一步对不同分子质量范围的丝素蛋白进行组成和结构分析。
1 实验部分
1.1 实验材料与仪器
材料:桑蚕生丝,如皋市春秋丝绸有限公司;碳酸钠、尿素、β-巯基乙醇、溴酚蓝和过硫酸铵,国药集团化学试剂有限公司;溴化锂(LiBr),合肥精汇化工研究所;葡聚糖G-15、葡聚糖G-200、四甲基乙二胺(TEMED)、考马斯亮蓝R-250、丙烯酰胺、甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)、甘氨酸,西格玛奥德里奇(上海)贸易有限公司;氨基丁三醇(Tris),Promega公司;冰醋酸、异丙醇、乙醇、丙三醇、盐酸(HCI)等,均为分析纯,由苏州大学材料中心提供。
仪器:MP-2000定量送液泵,日本Eyela东京理化器械株式会社;Christ ALPHA 2-4 LD plus冷冻干燥机,德国Marin Christ公司;Mini Protean Tetra小型垂直蛋白电泳系统,美国Bio-Rad公司;AR-2000旋转流变仪,美国TA Instruments公司;L-8800高速氨基酸分析仪,日本Hitachi有限公司;J-815圆二色光谱仪,日本Jasco公司;Zetasizer Nano ZS90纳米粒度电位仪,英国Malvern仪器有限公司;层析柱,上海之信有限公司。
1.2 实验方法
1.2.1 丝素蛋白溶液的制备
将桑蚕生丝以浴比为1∶50置于质量分数为0.06%的Na2CO3水溶液中沸煮40 min,然后在去离子水中彻底冲洗;重复2次后再沸煮30 min,彻底冲洗后置于60 ℃烘箱中干燥,得到脱胶丝素蛋白纤维。取脱胶丝素蛋白纤维以浴比为3∶20溶于9.3 mol/L的溴化锂溶液中,在(65±2) ℃搅拌溶解1 h,得到丝素蛋白溶液。
1.2.2 凝胶层析脱盐
取10.5 mg葡聚糖G-15放入50 mL灭菌去离子水中,于100 ℃水浴2 h使其充分吸水膨胀,待冷却至常温后注入层析柱(脱盐柱),在重力作用下充分沉降;再用5倍柱体积的灭菌去离子水平衡脱盐柱3次,加入丝素蛋白溶解液,使用蠕动泵调节流速并持续补充灭菌去离子水,收集丝素蛋白水溶液,旋转蒸发浓缩到质量浓度为80~100 mg/mL;最后,将脱盐柱用5倍柱体积的灭菌去离子水洗涤平衡,再次用于丝素蛋白溶液脱盐分离或密封后于4 ℃保存。
1.2.3 凝胶层析分离
葡聚糖G-200凝胶层析柱的制备与上述脱盐层析柱G-15相同,在加入足量的灭菌去离子水洗脱平衡后,将上述葡聚糖G-15脱盐后收集的丝素蛋白水溶液通过分离柱分离。调节流层面积(层析柱内径10、26、35 mm)、丝素蛋白质量浓度(10、20、30 mg/mL)和层流流速(15、30、60 mL/h),用离心管依次收集分离的丝素蛋白(1 mL/管)水溶液,依次编号为1#~21#。
1.3 测试方法
1.3.1 SDS-聚丙烯酰胺凝胶(PAGE)电泳测试
SDS-PAGE电泳测试按照文献[16]所述方法采用小型垂直蛋白电泳系统进行。按表1配方制备10%分离胶和5%浓缩胶。调节各管编号后的丝素蛋白水溶液质量浓度为5 mg/mL,取20 μL丝素蛋白水溶液与适量的含溴酚蓝标记物的蛋白上样缓冲液共混后沸水加热5 min,在13 000 r/min条件下离心10 min;用微量进样器取15 μL离心后的丝素蛋白溶液加入到5%浓缩胶的孔中,设置电压为60 V运行30 min,然后在120 V下运行至溴酚蓝指示剂抵达分离胶的下边缘;取出凝胶,采用考马斯亮蓝R-250染色液染色1 h,然后加入脱色液振荡直至脱除背景色。根据凝胶电泳的结果,对不同分子质量特征的丝素蛋白进行分组。各组保留一部分丝素蛋白新鲜水溶液用于黏度、Zeta电位与圆二色光谱测试;一部分丝素蛋白水溶液置于-80 ℃冷冻2 h,然后冷冻干燥24 h,取出密封保存于4 ℃,用于氨基酸组成测定。
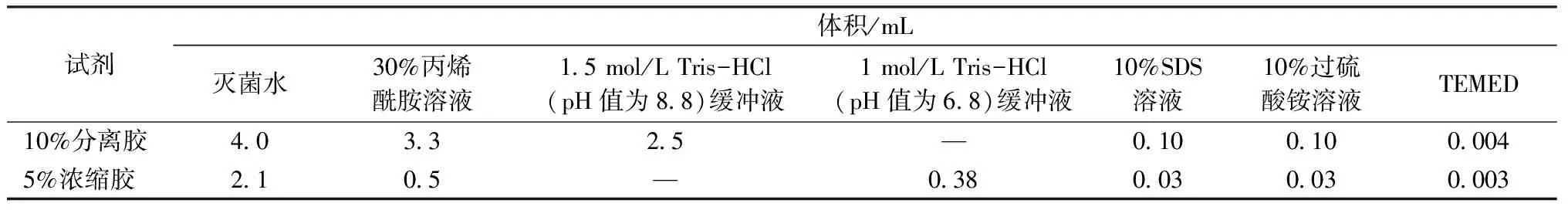
表1 10%分离胶与5%浓缩胶的配方Tab.1 Formula of 10% resolving gel and 5% stacking gel
1.3.2 Zeta电位测试
调节各组丝素蛋白水溶液质量浓度为0.5 mg/mL,使用纳米粒度电位仪测定不同pH值(1~7和7.4)下的Zeta电位,用于表征丝素蛋白表面的电荷性质。每个样品测试3次,取平均值。
1.3.3 黏度测试
调节各组丝素蛋白水溶液质量浓度为5 mg/mL,使用旋转流变仪测定丝素蛋白的黏度,获得剪切速率-黏度曲线。参数设置:Flow Ramp模式,采用直径为40 mm的1.0°钢制锥板,测试温度为25 ℃,剪切速率范围为0~100 s-1。
1.3.4 氨基酸测试
取冻干的丝素蛋白各100 mg置于18 mL盐酸中,充氮气以排除空气,110 ℃水解24 h后定容至50 mL。取定容后溶液1 mL于65 ℃烘干,再用20 mL的0.02 mol/L盐酸溶解和0.22 μm膜过滤,然后使用高速氨基酸分析仪测定氨基酸组成。
1.3.5 圆二色光谱测试
调节丝素蛋白水溶液质量浓度为0.02 mg/mL,采用超声波并设定300、500 W的功率分别处理45 s,或在37 ℃下振荡孵育8 h。使用圆二色光谱仪测试丝素蛋白的二级结构,以未经超声波处理的各组丝素蛋白新鲜水溶液作为对照。参数设置为:光径为0.5 mm的石英样品池,带宽1.0 nm,扫描速率100 nm/min,响应时间1.0 s,扫描波长范围190~250 nm。
2 结果与讨论
2.1 SDS-PAGE电泳测试结果分析
经葡聚糖凝胶对丝素蛋白分离的初步探索发现,葡聚糖凝胶G-200对丝素蛋白的分离有比较明显的效果,进一步研究了丝素蛋白质量浓度、层流速度和层流面积对分离效果的影响发现,控制层流速度对分离效果有显著的影响。图1示出用葡聚糖凝胶G-200以不同流速分离丝素蛋白的电泳结果。未分离的丝素蛋白电泳图上显示其在整个泳道呈高分散性的分布(见图1(a))。以15 mL/h的流速收集的21管丝素蛋白分子质量均出现大范围的连续分布,除最初的3管样品分子质量分布于20 ku以上,其余各泳道条带分布没有明显区别,均连续分布至15 ku及以下(见图1(b))。以60 mL/h的流速收集的21管丝素蛋白分子质量也没有明显分离出来(见图1(d))。以30 mL/h的流速收集的21管丝素蛋白呈现明显的分离效果(见图1(c)):1~3泳道的分子质量主要分布在100~150 ku之间,除了2、3泳道有隐约的25 ku的条带外,分子质量均在40 ku以上;第4泳道开始明显出现25 ku的条带及少量更小的蛋白;7~11泳道分子质量均匀分布于50~100 ku,但20 ku以下小分子质量的蛋白也有增多;12~18泳道中大分子质量的丝素蛋白减少,较均匀地分布在整个泳道;17泳道开始15 ku上下的相对较小分子质量的丝素蛋白明显增加;19~21泳道主要分布的是20 ku以下的丝素蛋白。
分离结果显示,控制流速为30 mL/h可达到明显分离出不同分子质量范围丝素蛋白的效果。另外,SDS-PAGE凝胶电泳分析发现,调控流层面积和丝素蛋白质量浓度对丝素蛋白分子质量的分离没有明显影响,本文后续使用内径为10 mm,高为50 cm的层析柱对丝素蛋白进行分离。根据SDS-PAGE凝胶电泳分布,将分离后的丝素蛋白根据前面所分析的不同分子质量特征分为4组:1~3管收集合并标记为SF1,7~10管合并标记为SF2,13~15管合并标记为SF3,19~21管合并标记为SF4,仅脱盐未分离的丝素蛋白标记为SF0。

图1 不同流速分离的丝素蛋白电泳图Fig.1 SDS-PAGE electrophoretogram of silk fibroin seperated at different laminar flow rate. (a) Unseparated silk fibroin; (b) Laminar flow rate is 15 mL/h; (c) Laminar flow rate is 30 mL/h; (d) Laminar flow rate is 60 mL/h
2.2 黏度分析
图2示出分离出来的丝素蛋白水溶液在剪切作用下的流变行为。可以看出,所有样品的变化规律相同,在较低的剪切速率下丝素蛋白溶液的黏度急剧增大,尤其是分子质量最大的SF1丝素蛋白,因丝素蛋白分子链的运动而相互纠缠,分子链越长,相互缠绕的概率越大。随着剪切速率的持续增大,各组丝素蛋白均呈现剪切变稀行为,丝素蛋白分子链之间的缠结会被逐渐打开,分子沿剪切作用力旋转方向排列,使黏度值逐渐下降。一般情况下,高分子溶液的黏度与其分子质量成正相关关系[17],也与分子质量的分散系数有关。

图2 丝素蛋白的剪切速率-黏度曲线Fig.2 Shear rate-viscosity curves of silk fibroin
表2示出不同剪切速率下的黏度值。比较相同剪切速率下样品的黏度值大小可以发现,SF1的黏度最大,SF0次之,SF4最小。这是因为SF1的分子质量最大;SF0是未经分离的丝素蛋白,存在大量的大分子质量丝素蛋白,但其分散程度很大,也含有较多小分子质量的丝素蛋白;而SF4的分子质量最小。这一结果也证明了本文研究中使用的层析柱法可有效分离不同分子质量的丝素蛋白。
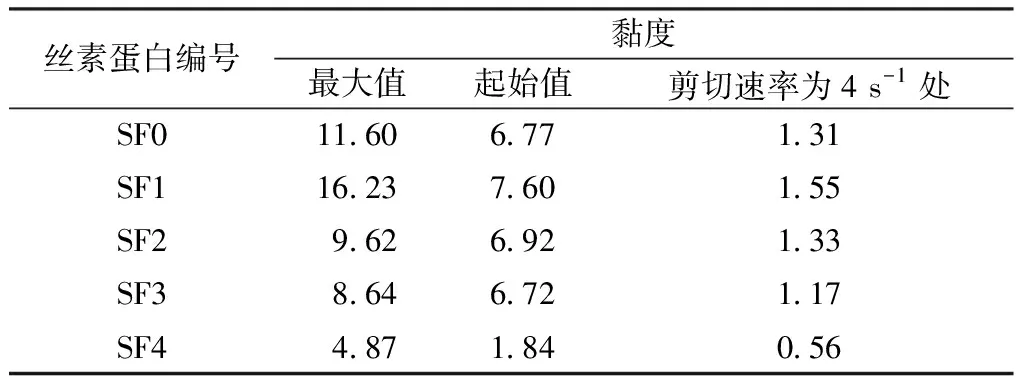
表2 不同剪切速率下的黏度值Tab.2 Viscosity of silk fibroin at different shear rates Pa·s
2.3 Zeta电位和等电点分析
丝素蛋白是天然的高分子蛋白质,由甘氨酸、丙氨酸、丝氨酸、天门冬氨酸、谷氨酸等20种氨基酸组成,在丝素肽链的氨基酸残基中,带有—COOH的氨基酸残基数目大于带有—NH2的氨基酸残基数目,这使丝素蛋白分子表面带负电荷。丝素L链和P25链上分布的酸性氨基酸和碱性氨基酸残基均较多,但酸碱2种氨基酸残基数目几乎相同(见表3中实验测试得到的各样品的氨基酸组成),因此,丝素蛋白电负性来自于主要组成部分的H链。丝素H链由高度重复的氨基酸残基(GlyAlaGlyAlaGlySer为主)的链段与高度保守的非重复氨基酸残基的链段有规律交替排列,其中非重复区链段含有3个酸性氨基酸残基和1个碱性氨基酸残基。
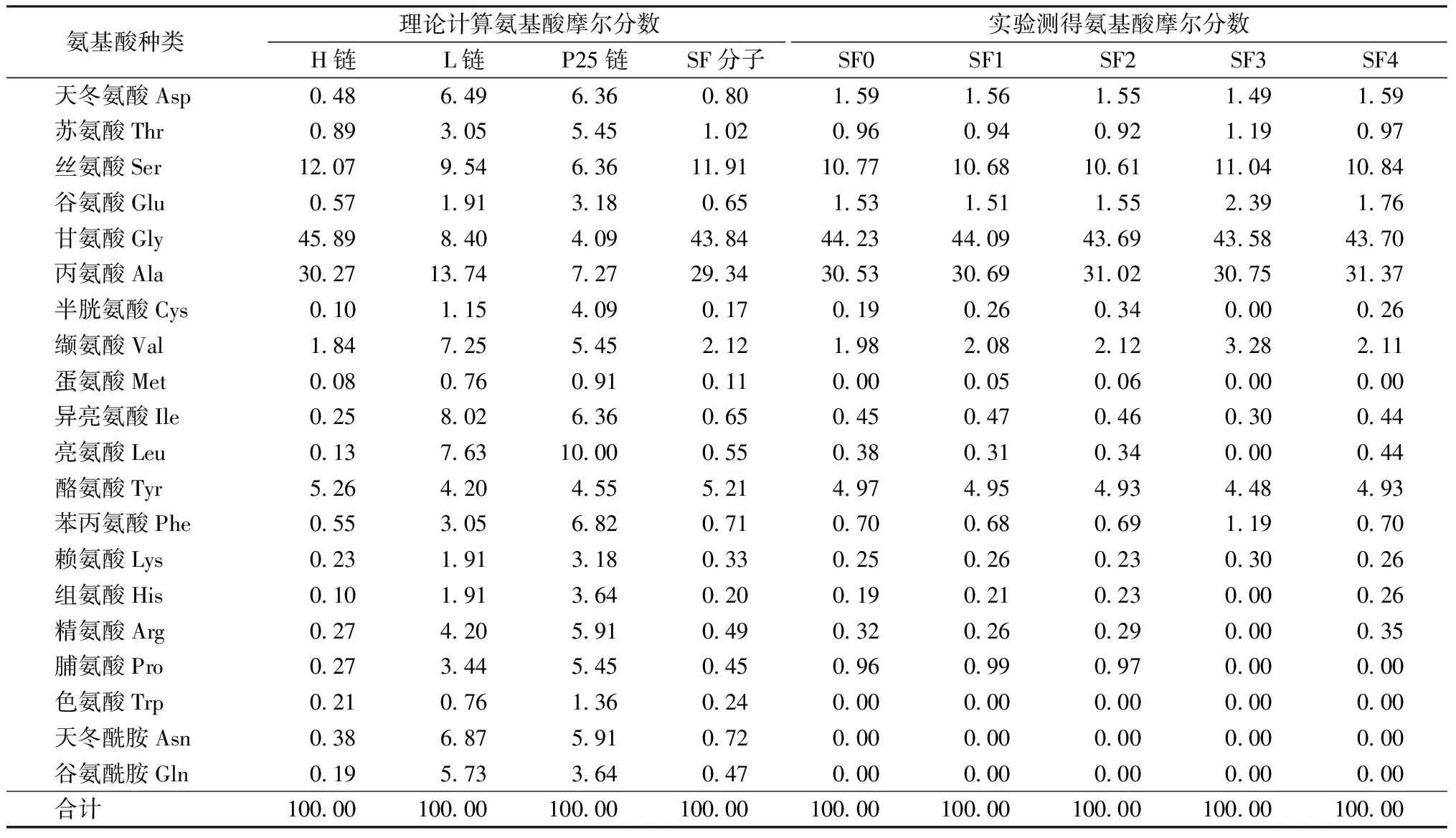
表3 丝素蛋白组成中各氨基酸理论摩尔分数与实测摩尔分数Tab.3 Mole percentage of each amino acid in silk fibroin %
图3示出不同pH值下各组丝素蛋白溶液的Zeta电位的变化。可以看出,5组丝素蛋白的等电点由大到小依次为SF1、SF0、SF2、SF3、SF4,SF0、SF1和SF2的等电点均在3.5~3.75之间。有趣的是,SF1的等电点大于对照组SF0,而SF2的等电点略小于SF0。SF3和SF4的等电点显著小于前3组样品,分别为1.75~2.0和1.5~1.75之间。
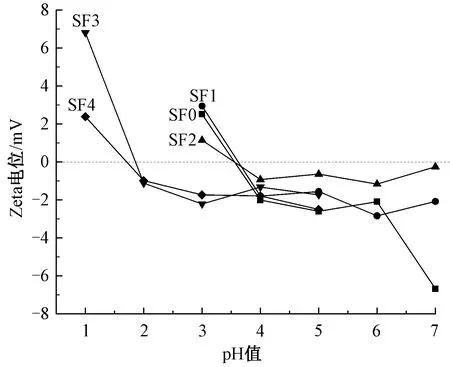
图3 丝素蛋白的电负性Fig.3 Electronegativity of silk fibroin
图4示出pH值为7.4的环境下4组分离的丝素蛋白样品的Zeta电位值与未分离SF0样品的比值。结果同样显示,SF1的电负性略小于对照组SF0。从SDS-PAGE电泳图可见,SF1的分子质量较大,这说明分离掉的小分子丝素蛋白含有的酸性 氨基酸残基占比较多。相比于对照组SF0,SF2~SF4的电负性显著增加,尤其是SF4,进一步说明小分子丝素蛋白SF4中含有的酸性氨基酸残基与碱性氨基酸残基数目的差值更大。综合电位值与等电点测定结果可知,随着层析柱分离的进行,丝素蛋白中—COOH含量多于—NH2含量的链段的相对比例是逐渐增多的。
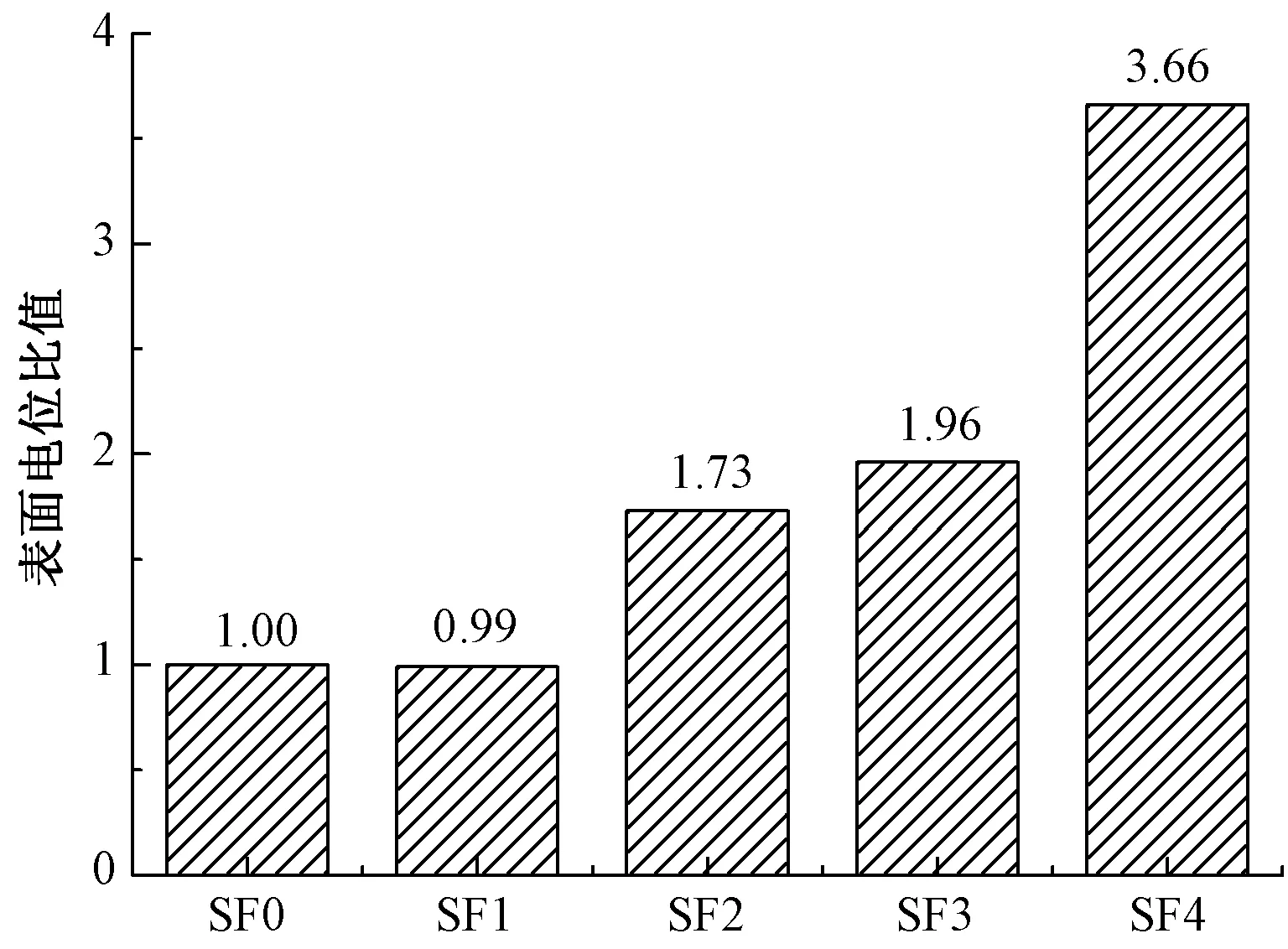
图4 分离的各组丝素蛋白与未分离 丝素蛋白的表面电位比值Fig.4 Surface potential ratios of separated and unseparated silk fibroin
2.4 氨基酸组成分析
基于Zeta电位值出现的有趣现象,进一步对各组丝素蛋白的氨基酸组成进行分析。根据丝素蛋白H链、L链和P25链的氨基酸组成[18-20],可以计算出丝素蛋白分子中所有氨基酸的理论摩尔分数,如表3所示。可以看出,SF0及分离的各组样品SF1~SF4的氨基酸组成中,含量最多的氨基酸是甘氨酸、丙氨酸和丝氨酸。SF0~SF4的甘氨酸、丙氨酸和丝氨酸之和分别占总氨基酸组成的85.53%、85.46%、85.32%、85.37%和85.91%,这3种氨基酸在H链中的摩尔分数均显著高于L链和P25链,SF1中H链的含量略高于SF2和SF3,说明SF1中主要是分子质量大的H链的链段,数据变化不大是由于H链的分子质量远远大于L链和P25链,且1个丝素分子中有6条H链、6条L链和1条P25链。缬氨酸是化学性质稳定的氨基酸。表3显示H链中缬氨酸含量显著小于L链和P25链,分离后的4组SF样品中,缬氨酸的摩尔分数增加,尤其是SF3样品。由结果可以推测,随着分离的进行,后续分离的丝素蛋白中除了小分子质量的H链仍然占主要组分外,分子质量小的L链和P25链的比例逐渐增多,尤其是SF3蛋白组。
由于色氨酸经盐酸处理后被破坏,天冬酰胺和谷氨酰胺分别转化为天冬氨酸和谷氨酸,所以表3中色氨酸、天冬酰胺和谷氨酰胺实测值为0。从谷氨酸(包含谷氨酰胺)和缬氨酸结果可以推测,SF3样品中含有的L链多于P25链;而从半胱氨酸、亮氨酸、组氨酸和精氨酸的结果推测,SF4样品中含有的P25链可能多于L链。总之,L链和P25链主要分布在SF3和SF4样品中。
从表3中SF分子组成的3种肽链可知,L链中的酸性氨基酸和碱性氨基酸数量相近,而P25链中的碱性氨基酸数目多于酸性氨基酸,这似乎无法解释SF样品的电负性随着分离的进行而增大的现象,为此进一步观察SDS-PAGE电泳图可以发现,SF4样品中稍大于15 ku附近出现了较深较宽的条带,结合甘氨酸、丙氨酸和丝氨酸3种氨基酸含量可以推测,这部分蛋白含有较多的H链被切断形成的小分子链段,同时也是富含非重复区的链段,此链段中酸性氨基酸数目多于碱性氨基酸,所以随着分离的进行,SF样品的电负性显著提高。相比于SF0和SF1样品,SF2也出现了电负性的显著增加,也是因为15 ku附近出现了较深较宽的条带,即H链非重复区链段的增加(见图1(c)7~10泳道)。
进一步分析各组样品中亲水性氨基酸的分布与含量,结果如图5所示。可知,SF3含有的亲水性氨基酸略高些,但所有组间没有显著的差异。虽然后面分离出来的P25链和L链含有更多的酸碱性氨基酸,但H链的小链段中含有更多亲水性的丝氨酸。
图5 丝素蛋白样品中亲水性氨基酸含量Fig.5 Hydrophilic amino acid content in silk fibroin sample
2.5 圆二色光谱分析
远紫外光区的圆二色光谱分析常用于蛋白质或多肽的二级结构研究,提供α-螺旋、β-折叠、β-转角和无规卷曲等分子构象的信息[21-22]。195~197(+) nm处的正科顿效应和217~218(-) nm处的负科顿效应归属于β-折叠结构;191(+) nm处的正科顿效应以及207~210(-)和221~222(-) nm处的负科顿效应归属于α-螺旋结构;193(-) nm附近、200~205(+)和227(-) nm处的特征峰归属于β-转角结构;无规卷曲的特征峰位于195~202(-)、215~218(+)和230(-) nm附近[22]。
分离的新鲜水溶液中的丝素蛋白分子没有经过外界因素的作用,分子运动较弱,主要是分子链的伸展和分子链之间较弱的次级键相互作用。图6示出未经处理的新鲜丝素蛋白SF0~SF4溶液的圆二色光谱。可以看出:在199~203 nm处均出现了强的归属于无规卷曲的负科顿效应,SF1和SF4的无规卷曲特征峰较弱;SF0和SF4(强度较弱)的圆二色光谱在195 nm附近出现了β-折叠结构的正科顿效应,SF1的圆二色光谱在215 nm附近出现了α-螺旋与β-折叠结构互变的负科顿效应。超声波处理可加速分子链的运动及分子间的碰撞,使丝素蛋白自组装形成稳定的分子构象。高强度超声波处理后(图6中每组丝素蛋白的样品D),所有样品均呈现相似的圆二色曲线,在195~198(+) nm处出现很强的β-折叠结构特征峰;除SF2在215~217(-) nm处出现了较强的β-折叠结构特征峰,SF0~SF3这4种丝素蛋白在222~223(-) nm附近出现了较强的α-螺旋特征峰,SF4的特征峰偏移至224(-) nm附近,属于α-螺旋与β-转角结构互变的负科顿效应。低强度超声波处理后样品的圆二色光谱曲线与高强度处理的相似(图6中每组丝素蛋白的样品C),仅有分子质量最小的SF4在224(-) nm处的特征峰进一步偏移至225(-) nm附近,说明存在更多的β-转角结构,这是因为部分分子链较短的H链非重复区链段不能形成稳定的α-螺旋,在氢键的作用下形成了β-转角结构。
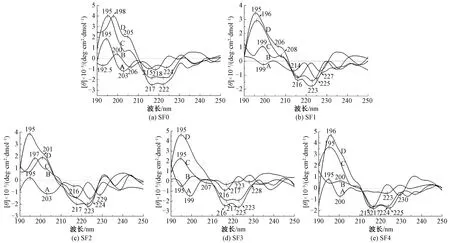
注:[θ]代表摩尔椭圆度;A为新鲜溶液;B为37 ℃孵育8 h的溶液;C为300 W超声波处理的溶液;D为500 W超声波处理的溶液。 图6 丝素蛋白样品溶液的CD光谱图Fig.6 CD spectra of silk fibroin
去除外力机械作用,在温和的37 ℃下静置(图6中每组丝素蛋白的样品B),丝素蛋白分子构象也发生着动态的转变,放置8 h后,SF1~SF4的丝素蛋白在216~218(-)nm处出现了中等强度的β-折叠结构特征峰,SF0在此处的特征峰较弱,所有样品均出现β-转角结构的特征峰;随着分子质量的减少,无规卷曲结构的含量逐渐增多。
3 结 论
丝素蛋白纤维溶解后形成了各种分子质量连续分布且分散性大的丝素蛋白溶液,本文通过凝胶层析法中葡聚糖G200的分子筛效应对不同分子质量的丝素蛋白进行了有效分离。最先收集的分子质量分布在100~150 ku之间的丝素蛋白溶液黏度最大,大于未分离的丝素蛋白。随着分离的进行,丝素蛋白溶液的黏度显著下降,电负性增加,分析可知H链非重复区链段的比例随之增大,导致无规卷曲结构的含量有所增加,证明了分子质量的变化和分离的有效性。
分离获得的不同分子质量特征或氨基酸组成不同的丝素蛋白,两性性质和结构有很大的差异,其后续应用(如对涤纶织物的优化改性)还需全面和深入研究。
