谷氨酸棒杆菌GPAT 功能基因鉴定与分析
2021-07-26刘翠翠李友元王永红
刘翠翠, 李友元, 王永红
(华东理工大学生物反应器工程国家重点实验室,上海 200237)
生物柴油是由动植物油脂、微生物油脂及一些垃圾油脂等可再生物质通过酯交换过程得到的一种环境友好型燃料[1-2]。微生物油脂具有生产周期短、可连续生产、可规模化利用自然界的丰富资源等特点,脂肪酸组成也易通过基因工程手段进行改造,因而微生物油脂成为第三代生物柴油重要的原料来源[3]。本实验室前期利用食品级安全菌株谷氨酸棒杆菌(Corynebacteriumglutamicum)通过理性的基因改造手段获得了产油菌株CT14,显示了谷氨酸棒杆菌作为微生物油脂生产菌的潜力,有必要进一步研究其作为产油微生物的宿主菌对微生物油脂的合成与调控机制[4]。
甘油-3-磷酸酰基转移酶(GPAT)催化3-磷酸甘油和脂肪酰基辅酶A 生成溶血磷脂酸(LPA),是甘油三酯和甘油磷脂合成的第一步反应且可能为限速步骤[5],在油脂的合成过程中起重要作用[6]。研究表明,在集胞藻PCC6803 中,GPAT 的编码基因被验证是该菌油脂合成的重要基因[7]。Paya 等[8]在酵母中过表达向日葵gpat9(Hagpat9)基因,使酵母三酰基甘油(TAG)总量增加,并且脂肪酸组分也发生了改变。然而,KEGG 数据库显示,在谷氨酸棒杆菌的基因组中没有明确标注的GPAT 的功能基因。Holder 等[9]通过比较谷氨酸棒杆菌与其他产油微生物的功能基因组后也指出谷氨酸棒杆菌缺少GPAT 的功能基因(EC 2.3.1.15)。但正如文献[4]中所指出的GPAT 是微生物细胞膜脂质合成途径中的重要酶,谷氨酸棒杆菌能正常生长,说明谷氨酸棒杆菌肯定存在类似GPAT功能的蛋白。为了深入理解谷氨酸棒杆菌的油脂合成途径,进一步提升产油脂性能,有必要研究谷氨酸棒杆菌中GPAT 的功能基因。
本文首先基于文献和生物信息学技术预测了CorynebacteriumglutamicumATCC13032 编码GPAT的多个候选功能基因,并选择其中之一cg2777基因进行后续验证;然后利用基因工程手段敲除及过表达谷氨酸棒杆菌的GPAT编码cg2777,结合发酵分析鉴定并研究谷氨酸棒杆菌中GPAT 的功能基因,为深入解析谷氨酸棒杆菌的油脂合成分子机制提供理论依据。
1 材料与方法
1.1 菌株、质粒和引物
本实验中所使用的菌株、质粒和引物均列于表1。

表1 本文所用菌株、质粒和引物的基因型和来源Table 1 Genotype and source of strains, plasmids and primers in this work
1.2 试剂和培养基
限制性内切酶、T4 连接酶、Gibson 组装试剂盒、Phusion 超保真DNA 聚合酶、去磷酸化酶,均购于NEB(北京)有限公司;质粒小提试剂盒、DNA 纯化回收试剂盒,购于TIANGEN 生物科技公司;X-gal、山梨醇、萘啶酮酸、硫酸卡那霉素,购于上海生工生物工程股份有限公司;牛脑心浸粉,购于美国BD 公司;其余试剂为进口或国产分析纯。
LB(Luria-Bertani)培养基、牛心浸液肉汤培养基(BHIS)、种子培养基及发酵培养基,见参考文献[4]。
1.3 谷氨酸棒杆菌的GPAT 生物信息学分析
使用KEGG 数据库和NCBI 网站进行GPAT 的编码基因的寻找;利用MEGA-X 软件进行同源序列比对分析;利用TMHMM Server 2.0 在线软件预测分析GPAT基因编码的蛋白质的跨膜区,TMHMM 软件可以区分外周膜蛋白和内在膜蛋白。
1.4 方法
1.4.1 一般操作 DNA 片段的回收、酶切、纯化、连接,大肠杆菌质粒抽提和转化,琼脂糖凝胶电泳,感受态制备与转化等分子生物学操作均参见文献[4]。
1.4.2 重组质粒pZ8-TAG4-cg2777 的构建与转化以谷氨酸棒杆菌基因组DNA 为模板,用引物对cg2777-FOR/REV 扩增基因cg2777,其片段大小为974 bp。将PstⅠ单酶切载体质粒pZ8-TAG4 和聚合酶链式反应(PCR)目的片段纯化后利用Gibson 无缝克隆试剂盒连接,获得重组质粒pZ8-TAG4-cg2777。将重组质粒pZ8-TAG4-cg2777 通过电转化方法转到谷氨酸棒杆菌CG14。在含50 μg/mL 卡那霉素的牛心浸液肉汤或琼脂平板上筛选,并通过菌落聚合酶链式反应(PCR)进行验证。
1.4.3 重组质粒pK18mobsacB-cg2777 的构建与转化
以谷氨酸棒杆菌基因组DNA 为模板,用引物对cg2777-D1/D2 扩增基因cg2777的上游片段62 bp,用引物对cg2777-D3/D4 扩增基因cg2777的下游片段547 bp。由于两段PCR 产物含有20 bp 左右的同源序列,因此将两段PCR 产物切胶回收,等量混合作为模板,以cg2777-D1/D4 为引物进行重叠PCR。最终的PCR 产物通过XbaⅠ和SbfⅠ双酶切后与相同酶切的质粒pK18mobsacB 进行连接,获得重组质粒pK18mobsacB-cg2777。基于同源重组方法对基因cg2777进行敲除[10]。通过电转化方法将敲除质粒pK18mobsacB-cg2777 转到谷氨酸棒杆菌CG14。在含50 μg/mL 卡那霉素的BHIS 平板上筛选已产生第1 次重组的卡那霉素抗性克隆。随机挑取转化子接种到LB 培养基中。30 ℃振荡培养24 h 后涂布于含10%(质量分数)蔗糖的BHIS 平板上,筛选已产生第2 次重组的克隆。将转化子分别转接到含50 μg/mL卡那霉素的平板和10%(质量分数)蔗糖的平板上,验证转化子的卡那霉素和蔗糖抗性,其中具有蔗糖抗性,且对卡那霉素敏感的克隆即为已发生了敲除的克隆,并通过菌落PCR 进行验证。
1.4.4 分析方法 采用上海仪电721G 分光光度计测定菌体浓度;用微量pH 计直接测定pH 值。菌体干重测定:取干燥不带盖子的15 mL 离心管若干称重(需要用分析天平);称取合适时间的发酵菌液5 mL并在3 500 r/min 下离心10 min 与上清液分开,在菌体中加3 mL 超纯水重悬;液氮速冻后于四环冻干仪中干燥48 h(需要提前预冷,使温度降至-50 ℃以下);用分析天平称重,减去离心管质量即为菌体干重。胞内外脂肪酸测定:采用气相色谱法测定,色谱条件:色谱柱为HP-5,柱箱温度220 ℃,检测器温度280 ℃,进样器温度250 ℃,进样口分流体积比20∶1,进样体积1 μL。
2 结果与分析
2.1 GPAT 的功能基因预测
如前文所述,来自于KEGG 数据库和其他研究者的研究发现,在谷氨酸棒杆菌ATCC13032 的基因组中没有明确标注的GPAT 的功能基因。因此,常规的同源多序列搜索未能发现有效的候选序列,必须采用其他的间接搜索方法。
首先,对模式生物大肠杆菌的GPAT 蛋白研究发现,其结合底物3-磷酸甘油可能依赖于HXXXXD序列(“X”代表任意氨基酸)。前期尝试使用一级序列进行直接预测,使用UniProt 蛋白质数据库上CorynebacteriumglutamicumATCC 13032 的蛋白质组进行分析,对所有序列进行HXXXXD 搜索,得到了接近1 100 条含有HXXXXD 的序列,由于HXXXXD单独一个模块复杂性较低,可能的序列以及错误匹配较多,工作量巨大,先行放弃这一策略。
GPAT 是微生物细胞膜脂质合成途径中的重要酶,因此我们大胆猜测GPAT 蛋白定位是在细菌内膜上。Möker 等[11]通过研究谷氨酸棒杆菌的MtrAMtrB 二元信号转导系统,发现携带有mtrAB 双缺失的谷氨酸棒杆菌突变体细胞形态发生改变,细胞变性拉长到野生型菌株的3 倍,说明缺失株可能作用在细胞壁上,导致菌株不能正常进行细胞分裂,进一步研究发现mtrAB 缺失株对作用于细胞壁的抗生素有更高的灵敏度,包括青霉素、万古霉素和溶菌酶,这表明突变体的细胞壁有损伤,除了功能明确的蛋白酶、脂酶受影响以外,还有一部分功能不明确的基因,其中假定蛋白CG2777(NCgl2434)是假定膜蛋白。Brocker 等[12]进一步考察了与MtrA-MtrB 二元转导系统有关的目标基因等信息,共发现4 种(CG0896、CG2096、CG2777、CG3254)未知功能的假定膜蛋白受影响,其中后3 种受到抑制效果的蛋白中,CG2777受抑制效果最大,因此本文选择CG2777 蛋白编码基因cg2777进行下一步分析与验证。
利用MEGA-X 软件对谷氨酸棒杆菌的cg2777基因与9 种其他来源GPAT 的基因[9]进行多序列比对分析,发现谷氨酸棒杆菌的cg2777基因序列前后缺失较长片段,在中部存在多处插入和缺失(图1),这也是常规多序列同源搜索无法找到该序列的原因。使用TMHMM 跨膜预测分析软件分析目标蛋白CG2777的跨膜结构,如图2 所示。根据预测结果分析目标蛋白为插膜蛋白,具有4 个跨膜结构域,氨基酸位置分别在92~129、130~153、186~221 和264~297。

图1 cg2777 与GPAT 的同源基因多序列比对Fig. 1 Multi-sequence comparison between cg2777 and homologous GPAT genes
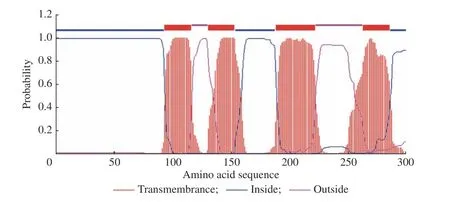
图2 目标蛋白跨膜预测Fig. 2 Target protein transmembrane prediction
2.2 重组质粒的构建
将上述重组质粒分别通过电激转化到谷氨酸棒杆菌CG14 感受态细胞得到重组菌株CT14+cg2777和CT14Δcg2777。将重组菌株在以葡萄糖为唯一碳源下进行摇瓶发酵验证,并以CG14 菌株作为对照菌株,研究菌株GPAT 功能基因改造对其生长情况、胞内外脂肪酸合成的影响。
2.2.1 质粒pZ8-TAG4-cg2777 的构建 基因cg2777过表达引物序列如表1 所示,引物中的小写字母为引物间的重叠互补序列,大写加粗部分为谷氨酸棒杆菌核糖体结合位点(RBS)序列。以Corynebacterium glutamicumATCC13032 基因组为模板,利用引物对cg2777-FOR 和cg2777-REV 扩增基因cg2777,其片段大小为974 bp。将PstⅠ单酶切载体质粒pZ8-TAG4 和PCR 目的片段纯化后利用Gibson 无缝克隆试剂盒连接转化大肠杆菌感受态,利用验证引物对PZ8-T2/T3 进行菌落PCR 验证阳性克隆,其电泳图如图3 所示,阳性克隆大小为1 244 bp,同时提取质粒送上海生工生物工程股份有限公司测序,经过序列比对分析无突变点存在。

图3 质粒pZ8-TAG4-cg2777 菌落PCR 验证Fig. 3 Identification of plasmid pZ8-TAG4-cg2777 by colony PCR
2.2.2 质粒pK18mobsacB-cg2777 的构建 基因cg2777
上下同源臂引物序列如表1 所示,引物中小写字母为引物间的重叠互补序列,用于上下游同源片段的融合,横线标示部分为引入的酶切位点且前面加有保护碱基。以Corynebacterium glutamicumATCC13032基因组为模板,用引物cg2777-D1 和c2777-D2 扩增基因cg2777的上游片段562 bp,用引物cg2777-D3和cg2777-D4 扩增基因cg2777的下游片段547 bp(见图4(a))。将上下游片段切胶回收后作为模板,再利用引物对cg2777-D1/D4 扩增上下游融合片段1 088 bp(见图4(b))。最终的PCR 产物通过XbaⅠ和SbfⅠ双酶切后与相同酶切的质粒pK18mobsacB进行连接,利用验证引物对PK18-T1/T2 进行菌落PCR 验证阳性克隆,其电泳图如图5 所示,阳性克隆大小为1 280 bp 同时提取质粒送上海生工生物工程股份有限公司测序,经过序列比对分析无突变点存在。

图4 cg2777 基因上下游同源臂融合PCRFig. 4 Fusion PCR of cg2777 gene upstream and downstream
图5 质粒pK18mobsacB-cg2777 菌落PCR 验证Fig. 5 Identification of plasmid pK18mobsacB-cg2777 by colony PCR
2.3 发酵验证
将上述重组质粒分别通过电激转化到谷氨酸棒杆菌CG14 感受态细胞得到重组菌株CT14+cg2777和CT14Δcg2777。将重组菌株在以葡萄糖为唯一碳源下进行摇瓶发酵验证,并以CT14 菌株作为对照菌株,研究菌株GPAT 功能基因改造对其生长情况、胞内外脂肪酸合成的影响。
2.3.1 GPAT 的功能基因对菌株生长情况的影响 摇瓶发酵所采用的培养基为CASO 种子培养基和CGXII发酵培养基,以40 g/L 葡萄糖作为唯一碳源。根据实验方案,菌株在种子培养基中培养12~16 h 后,在菌浓(OD600)为5 左右进行转接使二级发酵初始OD600为0.3 左右,将摇瓶置于30 ℃、220 r/min 条件下进行培养。改造株的生长状况如图6 所示,可见CT14Δcg2777菌株明显生长缓慢并且发酵上清液中有乳白色浑浊,可能是菌株细胞膜受损有脂质类物质溢出,这符合我们的预测:基因cg2777除了行使GPAT 功能外还是膜蛋白基因,因此敲除此基因会影响细胞膜生成进而影响菌株生长繁殖,同时阻断甘油三酯合成途径导致前体3-磷酸甘油和酰基辅酶A 不能大量合成油脂,而造成脂质类物质大量外溢。
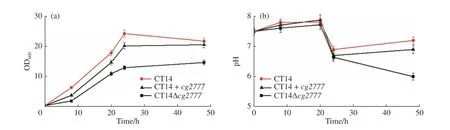
图6 不同谷氨酸棒杆菌菌株培养过程的生长曲线和pH 变化Fig. 6 Growth curve and pH change in different Corynebacterium glutamicum strains
同时,对对数生长后期的菌株CT14Δcg2777和对照菌株CT14 进行电镜扫描分析,其结果如图7 所示,可见对照菌株CT14 的细胞大小比较均一圆润,而CT14Δcg2777突变株细胞形态发生很大变化,细胞拉长变形出现不规则形状,且有很多细胞碎片存在,说明基因cg2777的缺失影响了细胞膜脂质的合成,导致细胞膜不完整且易于破裂。

图7 CT14 和CT14Δcg2777 的电镜扫描结果Fig. 7 SEM of CT14 and CT14Δcg2777
2.3.2 GPAT 的功能基因对菌株胞内外脂肪酸的影响
分析发酵48、60 h 时上述改造株总脂肪酸质量浓度和菌体脂肪酸质量分数,结果如图8 所示,其中菌体脂肪酸质量分数为胞内脂肪酸质量与菌体干重之比,同时分析发酵60 h 时上述改造株胞外脂肪酸情况(图9)。比较图8 和图9 可以看出,CT14Δcg2777突变株发酵48 h 时总脂肪酸质量浓度和菌体脂肪酸质量分数都很低,总脂肪酸质量浓度仅有对照株CT14 的1/4 左右,菌体脂肪酸质量分数是对照菌株质量分数的1/2;发酵培养延迟到60 h,对照菌株CT14 的脂肪酸变化稳定,CT14Δcg2777突变株总脂肪酸质量浓度和菌体脂肪酸质量分数只有少量增加,这符合我们的猜测:cg2777基因是一个膜蛋白基因,影响菌株细胞膜脂质的合成,进而影响菌株生长以及脂肪酸的合成。CT14+cg2777突变株与对照株CT14 相比,其脂肪酸的质量分数并没有很大变化,且胞外游离脂肪酸的质量浓度仅减少7.1%(图8(a)),由此推测,基因cg2777行使GPAT 功能,但是油脂合成是一个多酶合作的复杂体系,单一过表达GPAT的编码基因cg2777并不能明显地提高油脂的含量。
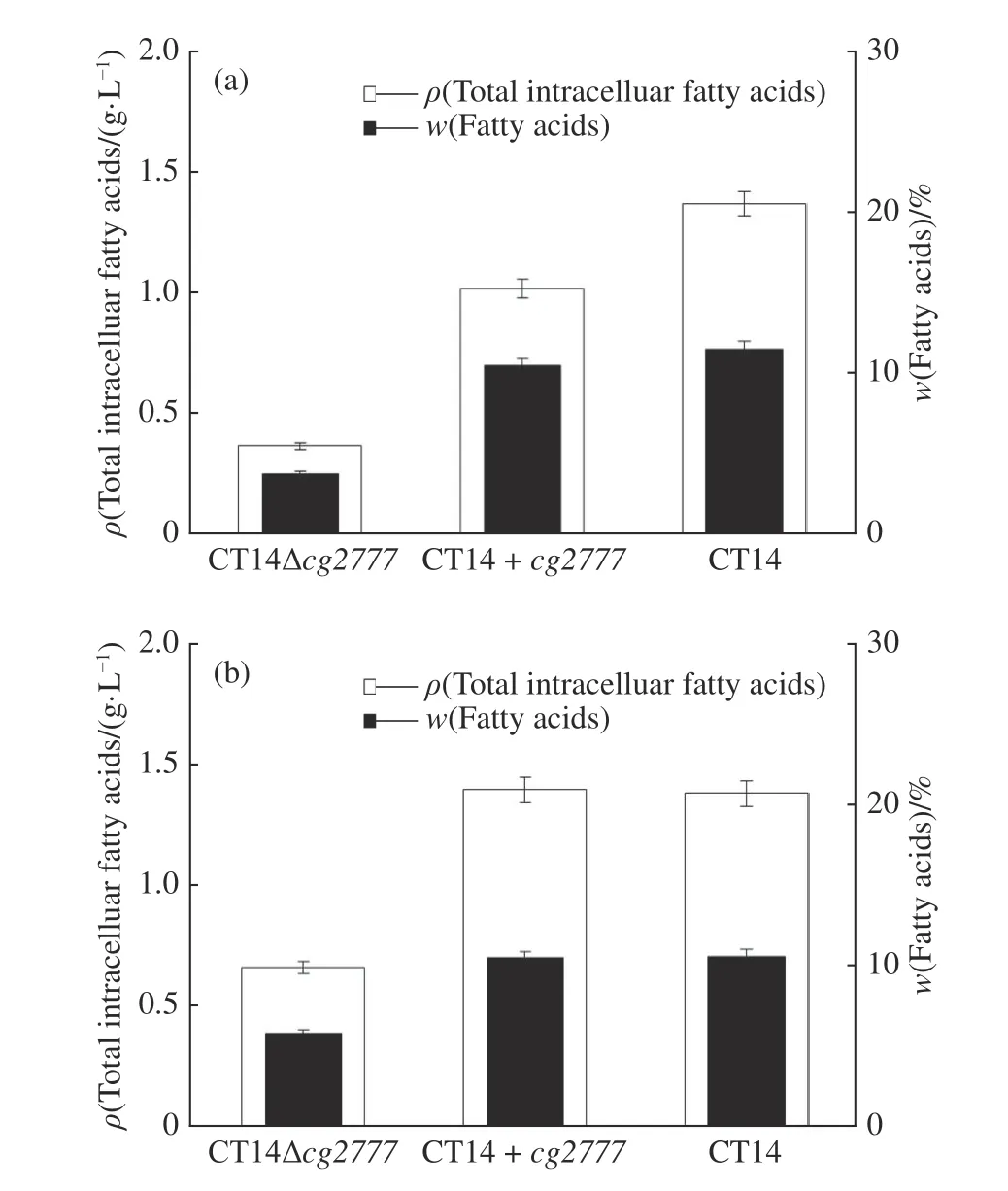
图8 不同谷氨酸棒杆菌菌株培养48 h(a)、60 h(b)的总脂肪酸质量浓度和菌体脂肪酸质量分数Fig. 8 Mass concentration of total intracellular fatty acids and mass fraction of fatty acids in different Corynebacterium glutamicum strains cultured for 48 h(a) and 60 h(b)

图9 不同谷氨酸棒杆菌菌株培养60 h 的胞外脂肪酸质量浓度Fig. 9 Mass concentration of extracellular fatty acids in different Corynebacterium glutamicum strains cultured for 60 h
3 结 论
本研究基于文献查阅和生物信息学技术预测了Corynebacterium glutamicumATCC13032 编码GPAT的多个候选功能基因,并选择其中之一cg2777基因进行后续验证。多序列比对结果表明,该基因中间的折叠区域存在大量的功能保守序列。跨膜结构分析表明,CG2777蛋白存在4 个跨膜结构域,这与AtGPAT9 蛋白存在3~4 个跨膜结构域的特征一致[13]。通过对预测的GPAT 的编码基因cg2777敲除和过表达,发现基因cg2777的敲除会严重影响菌体增值,细胞形态发生很大改变,胞外游离脂肪酸和总脂肪酸含量很低,这与罗泉[14]在集胞藻PCC6803 中关闭GPAT 的编码基因会破坏类囊体膜结构,生长缓慢的现象一致;而基因cg2777的过表达,仅使胞外游离脂肪酸微量减少,总脂肪酸含量没有变化。由此推测,基因cg2777行使GPAT 功能,但是油脂合成是一个多酶合作的复杂体系,单一过表达GPAT 的编码基因cg2777并不能明显提高油脂含量。本研究为今后利用基因工程手段提高微生物油脂含量提供了方向,同时为进一步揭示谷氨酸棒杆菌油脂合成的分子机制奠定了一定的理论基础。
