藜麦固态发酵及其产物的体外抗氧化性质研究
2021-07-25李梦瑶石俊如布合加尔克热木尼亚孜曹洪伟
李梦瑶,石俊如,布合加尔·克热木尼亚孜,曹洪伟,黄 凯,李 森,管 骁✉
(上海理工大学 医疗器械与食品学院,上海 200093)
藜麦(Chenopodium quinoa Willd)是一种原产于南美洲安第斯山脉地区的农作物,属苋科藜属的一年生双子叶植物[1],其种子颜色主要有黑、红、白几种颜色[2]。藜麦营养价值丰富,富含氨基酸、优质蛋白质以及多酚、皂苷等生物活性物质[3-5],其蛋白质氨基酸比例均衡,可调节机体的脂肪代谢,进而起到降低血脂的作用;与其他谷物相比,藜麦具有很高的抗氧化能力,可作为天然抗氧化剂的来源,也被推荐为最适合人类的完美全营养食品[6],现已被多个国家引进种植,我国在 1987年将其引进西藏地区并开始种植,自2015年更是在山西、内蒙、青海等多个地区开始种植[7]。
近年来,藜麦已经引起各类研究者、生产者及普通消费者广泛的关注,但藜麦作为有待普及和推广的新兴作物,对藜麦的理论研究和开发利用尚有待深入。固态发酵(Solid State Fermentation,SSF)是指利用不溶性固体基质来培养微生物的过程,培养基呈固态,含水丰富,但没有或几乎没有自由流动水的状态下进行的一种或多种微生物发酵过程,底物(基质)是不溶于水的聚合物,它不仅可以提供微生物所需碳源、氮源、无机盐、水及其它营养物,还是微生物生长的场所[8-9]。固态发酵是一种经济高效的绿色发酵方式[10],有文献表明固态发酵可以提高谷物营养价值[11],但目前对藜麦进行固态发酵的研究较少。
本研究以三种不同颜色种类的藜麦为原料,对其进行固态发酵,测定其发酵产物中总糖、总酸、氨基酸态氮含量,并测定其 pH值,筛选出营养价值高的藜麦品种;并研究藜麦固态发酵后发酵产物的抗氧化活性,以 1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除率和铁离子还原能力为指标,筛选抗氧化性能最优的藜麦品种,旨在全面揭示不同颜色藜麦品种之间抗氧化性质的差异,同时为藜麦食品的开发利用提供理论依据。
1 材料与方法
1.1 实验材料
黑色藜麦、红色藜麦、白色藜麦:山西五台山;麦曲、块曲:上海金枫酒业有限公司;酵母:安琪酵母股份有限公司。
亚铁氰化钾三水合物、无水硫酸铜、甲基红、亚甲基蓝、酒石酸钾钠、D-无水葡萄糖、三氯乙酸:上海维塔化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、没食子酸:上海阿拉丁生物科技股份有限公司;福林酚、氢氧化钠、盐酸、六氰合铁酸钠、二水合磷酸二氢钠、十二水合磷酸氢二钠、无水三氯化铁、甲醛:国药集团有限公司。
1.2 主要仪器与设备
霉菌培养箱:上海一恒科学仪器有限公司;Himac CR22N高速冷冻离心机:日本日立公司;L550台式低速大容量离心机:长沙湘仪离心机仪器有限公司;UV-2800A型紫外可见分光光度计:美国尤尼柯公司;WK2102T电磁炉:美的集团有限公司;IKA RO5多点磁力搅拌器:艾卡仪器设备有限公司;FE20 pH计:梅特勒–托利多仪器有限公司。
1.3 实验方法
1.3.1 藜麦预处理
将160 g藜麦在320 mL蒸馏水中浸泡1 h,沥干水分,然后放入垫有四层纱布的蒸锅上蒸煮30 min,将蒸熟的藜麦放在铁盘中平铺放开凉至温度30 ℃以下备用。
1.3.2 固态发酵
将藜麦、128 mL蒸馏水、4 g麦曲、12 g块曲、酵母液(0.16 g酵母溶于16 mL糖水中,在35 ℃水浴加热15 min)混合均匀,四层纱布封口放入霉菌培养箱中,温度设定为28 ℃。
分别取 12、24、36、48、60、72、84、96 h的发酵液。将发酵完的藜麦在4 000 r/min条件下离心30 min,并用滤纸过滤,取得原液,在4 ℃保存,备用待测。
1.3.3 总糖的测定
总糖的测定:根据国标 GB/T 13662—2018《黄酒》采用亚铁氰化钾滴定法测定。预先配好费林试剂甲、乙液,葡萄糖标准溶液(1 g/L),6 mol/L HCl溶液,200 g/L NaOH溶液,1 g/L甲基红指示液。
吸取费林甲溶液和费林乙溶液各 5 mL于100 mL锥形瓶中,加入葡萄糖标准溶液9 mL,摇匀后加入2粒沸石,置于电炉上加热,在2 min内沸腾,然后用葡萄糖标准溶液滴定,直至蓝色消失变为黄色,记作滴定终点,记录消耗的葡萄糖标准溶液的体积V1。
1.3.3.1 制样 吸取试样5 mL于100 mL容量瓶中,加入蒸馏水30 mL和HCl溶液5 mL,在70 ℃水浴中加热15 min,冷却,加入两滴甲基红指示液,用 NaOH溶液中和至红色消失。加水定容100 mL,摇匀,过滤,作为试样水解液备用。
1.3.3.2 预滴定 吸取费林甲液、乙液及试样水解液各5 mL于100 mL锥形瓶中,摇匀后加入2粒沸石置于电炉上加热至沸腾,用葡萄糖标准溶液滴定至终点,记录消耗的葡萄糖标准溶液的体积 V2。
1.3.3.3 滴定 吸取费林甲液、乙液及试样水解液各5mL于100 mL锥形瓶中,加入比预滴定少1.00 mL的葡萄糖标准溶液,摇匀后加入2粒沸石置于电炉上加热至沸腾,用葡萄糖标准溶液滴定至终点。记录消耗的葡萄糖标准溶液的体积(V3)。
试样中总糖含量X计算为:
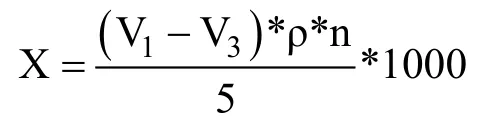
式中:
ρ——葡萄糖标准溶液的浓度,单位为g/mL;
n——试样的稀释倍数。
1.3.4 总酸和氨基酸态氮的测定
参照刘安康[12]等实验方法并调整,吸取试样10 mL于100 mL锥形瓶中,加入蒸馏水50 mL。锥形瓶中放入磁力搅拌子,置于磁力搅拌器上搅拌。用0.1 mol/L NaOH标准滴定液滴定,开始时可快速滴定至pH 7.00,此后放慢滴定速度,直至pH 8.20为终点,记录消耗NaOH标准滴定溶液的体积V1。加入甲醛溶液10 mL,继续用NaOH标准滴定溶液滴定至pH 9.20,记录消耗NaOH标准滴定溶液的体积V2。同时做空白实验,分别记录不加甲醛溶液及加入甲醛溶液时,空白实验实验所消耗NaOH标准滴定溶液的体积V3、V4。
总酸含量X1如下:
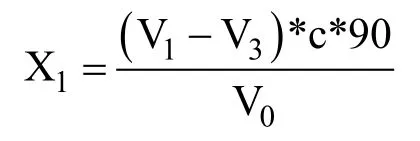
酸态氮含量X2如下:

式中:
X1——试样中总酸的含量,单位为g/L;
X2——试样中氨基酸态氮的含量,单位为g/L;
c——NaOH标准滴定溶液的浓度,单位为mol/L;
V0——吸取试样的体积,单位为mL。
1.3.5 总酚含量的测定
吸取2 mL离心发酵液上清,加入10 mL 80%甲醇溶液,45 ℃条件下水浴1 h,4 000 r/min离心10 min收集上清。采用Folin-酚试剂测定多酚含量[13],取1 mL提取液,加入0.5 mL福林酚试剂,混匀后静置 5 min,然后加入 1.5 mL 20%Na2CO3溶液,去离子水定容至10 mL,混匀后避光静置1 h,在760 nm下测定吸光度。以没食子酸为标准品绘制标准曲线。总酚含量以没食子酸当量μg GAE/mL DW表示。
1.3.6 体外抗氧化指标测定
1.3.6.1 DPPH自由基清除活性 参照 Ye等[14]方法,并进行调整。配置DPPH溶液:用无水乙醇配制0.1 mmol/L的DPPH溶液,避光保存。将1 mL测试样品溶液及1 mL DPPH溶液加入到同一试管中,摇匀,室温下暗处静置30 min后以3 000 r/min离心10 min,测定其吸光度Asample,同时测定1 mL DPPH溶液与1 mL乙醇混合后的吸光度Acontrol,以及1 mL测试样品溶液与1 mL无水乙醇混合后的吸光度Ablank。
自由基清除能力的表示:
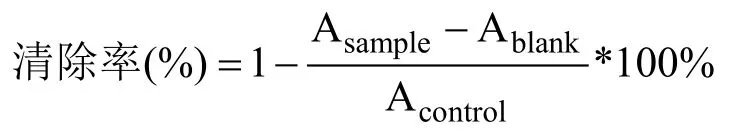
1.3.6.2 还原能力测定 参照Oyaizu[15]方法,并作调整。取 0.4 mL样品和 1 mL磷酸缓冲液(0.1 mol/L,pH 7.4)以及1 mL 1%铁氰化钾溶液混合,于50 ℃水浴中加热20 min,冷却到室温后加入1 mL 10% TCA混匀,静置15 min。取1 mL上清液,加入0.2 mL 0.1%三氯化铁溶液和1 mL水。10 min后,在700 nm处测吸光度。
1.4 数据分析
使用Excel对数据进行处理,并用Origin 2018软件进行绘图分析,采用单因素方差分析中的Duncan多重比较法分析结果间的显著差异(P<0.05表示具有显著性差异)。每组实验实验重复3次,结果以(平均值±标准差)表示。
2 结果与分析
2.1 总糖含量变化
发酵过程中黑藜、红藜、白藜总糖含量的变化见图 1,从图 1可以看出,大米在发酵过程中总糖的含量显著高于藜麦(P<0.05),这是由于大米所含碳水化合物尤其是淀粉含量相对较高所导致,藜麦中淀粉含量通常为60%[16],而大米淀粉含量可高达75%以上[17]。研究发现,藜麦与大米在发酵过程中均出现了总糖含量先升高后降低的趋势,这是因为发酵前期淀粉被霉菌及其他一些细菌分泌的淀粉酶、糖化酶等大量分解导致了总糖的升高和相应微生物的增殖,但随着总糖含量达到一定高度,酵母菌开始大量增殖且不断消耗产生的还原糖,从而导致总糖含量的降低。其中藜麦的总糖含量在发酵24 h时达到最高,而大米则需发酵36 h。藜麦的发酵随着时间的延长,在48 h总糖含量趋于稳定,且白藜的总糖含量要高于黑、红藜,大米的总糖含量则持续降低,此现象与酵母的增殖与藜麦、大米中淀粉含量相关。

图1 发酵过程中黑藜、红藜、白藜总糖含量的变化Fig.1 Changes of total sugar content of black quinoa,red quinoa and white quinoa during fermentation
2.2 总酸含量变化
发酵过程中黑藜、红藜、白藜总酸含量的变化见图 2,从图 2可以看出,大米及藜麦在发酵前期总酸含量持续上升,是整个菌群环境不断调整的结果。不适应酸性环境的菌体生长受到抑制,能够适应酸性环境的菌体开始不断增殖并形成优势菌群。结合总糖含量的变化规律,发现总酸含量在48 h时趋于稳定,与总糖含量变化趋于稳定的时间点相吻合,是弱势菌群持续产酸而优势菌群则以已产的有机酸为底物继续发酵,导致了总酸含量变化减缓。相比较于藜麦,大米总酸持续增加,是因为其淀粉含量较高,从而淀粉水解时间过长。藜麦淀粉的颗粒相对较小,粒径仅几微米甚至纳米级[18-19],而大米淀粉颗粒则高达几十微米,此因素也可能导致大米淀粉的水解时间相对延长,从而产酸持续增加。此外,藜麦发酵中总酸含量显著高于大米,有可能是发酵初期,藜麦中乳酸菌增殖相对较高。

图2 发酵过程中黑藜、红藜、白藜总酸含量的变化Fig.2 Changes of total acid content of black quinoa,red quinoa and white quinoa during fermentation
2.3 pH的变化
在发酵过程中,藜麦的 pH变化总体呈下降趋势,而大米的 pH则先降低再平稳最后略有上升的趋势,结果如图3所示。相较于大米,藜麦发酵过程中 pH的变化相对较小,由于所用发酵剂为酒曲,其中富含霉菌、酵母、乳酸菌等各类微生物,均可以产生各类酸类物质,从而可以导致 pH的降低,但相比较于藜麦,大米在发酵过程中由于淀粉含量的相对较高,发酵后期能够通过酵母的增殖不断将有机酸转化为酒精,因此,pH的变化会呈现后期相对平稳甚至上升的趋势。对于藜麦的 pH持续下降,是因为发酵后期蛋白酶对于蛋白的持续分解,由于蛋白质氨基酸组成的差异,导致游离出的氨基酸所带酸碱性差异,从而导致了大米、藜麦的pH值存在一定区别。

图3 发酵过程中黑藜、红藜、白藜pH的变化Fig.3 pH changes of black quinoa,red quinoa and white quinoa during fermentation
2.4 氨基酸态氮含量变化
氨基酸态氮是指以氨基酸形式存在的氮元素的含量,可以用来判断发酵程度。如图4所示,随着发酵的进行,藜麦发酵产物中氨基酸态氮总体变化呈上升趋势,而大米则呈现先增加后稳定的趋势。由于藜麦中蛋白质含量几乎是大米的两倍[20],因此,随着微生物分泌的蛋白酶不断酶解蛋白,藜麦的氨基酸态氮要高于大米,发酵前期,原料中的蛋白质大都被一些高产蛋白酶微生物,如霉菌类,进行分解形成低分子的肽和游离氨基酸,因此其氨基酸态氮含量上升较快。
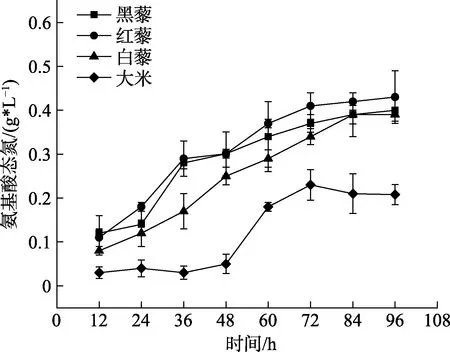
图4 发酵过程中黑藜、红藜、白藜氨基酸态氮含量的变化Fig.4 Changes of amino acid nitrogen content in black quinoa,red quinoa and white quinoa during fermentation
2.5 总酚含量变化
谷物中存在大量的多酚黄酮类抗氧化物质,主要以游离态、可溶酯化态和不溶结合态形式存在[21],但谷物中可游离出的酚类或黄酮类物质含量相对较低,Raj等[22]研究发现固态发酵(5 d)可以显著提高玉米总酚(游离酚)含量及抗氧化活性。通过微生物发酵法可有效释放谷物中与淀粉、蛋白等物质结合的酚类物质,从而能有效提升抗氧化效果。如图5所示,随着发酵时间的延长,藜麦与大米的总酚含量不断增加,但当发酵时间超过48 h,总酚含量呈下降趋势。发酵前期总酚含量的增加是蛋白酶、淀粉酶、纤维素酶等酶的不断增加,从而有效的释放结合酚的结果。但随着发酵时间的延长,微生物会消耗所产生的酚类物质,导致含量降低。此外,藜麦发酵中总酚含量显著高于大米(P<0.05),一方面,大米经加工后,大量的酚类物质随着脱壳、脱皮处理造成了流失,而藜麦未经过精细加工,从而保留了大部分的酚类物质;另一方面,藜麦本身的酚类物质含量就高于大米,从而在发酵释放过程中总酚含量也高于大米。

图5 发酵过程中黑藜、红藜、白藜总酚含量的变化Fig.5 Changes of total phenols content in black quinoa,red quinoa and white quinoa during fermentation
2.6 DPPH自由基清除率
选用三种不同颜色的藜麦,并以大米为参照,经固态发酵后,测其发酵产物的DPPH自由基清除率,结果如图6所示。可以看出在相同发酵条件下藜麦的DPPH自由基清除率要高于大米,在发酵48 h时,黑藜发酵产物的DPPH自由基清除率达到80%,这与其发酵后总酚含量在48 h含量达到最高呈现一致趋势,整体来说黑藜的 DPPH自由基清除率比其他品种高。由结果知藜麦发酵产物的DPPH自由基清除率的变化趋势与其总酚含量的变化相近,从而验证了固态发酵释放酚类物质可提高发酵产物的抗氧化性能。
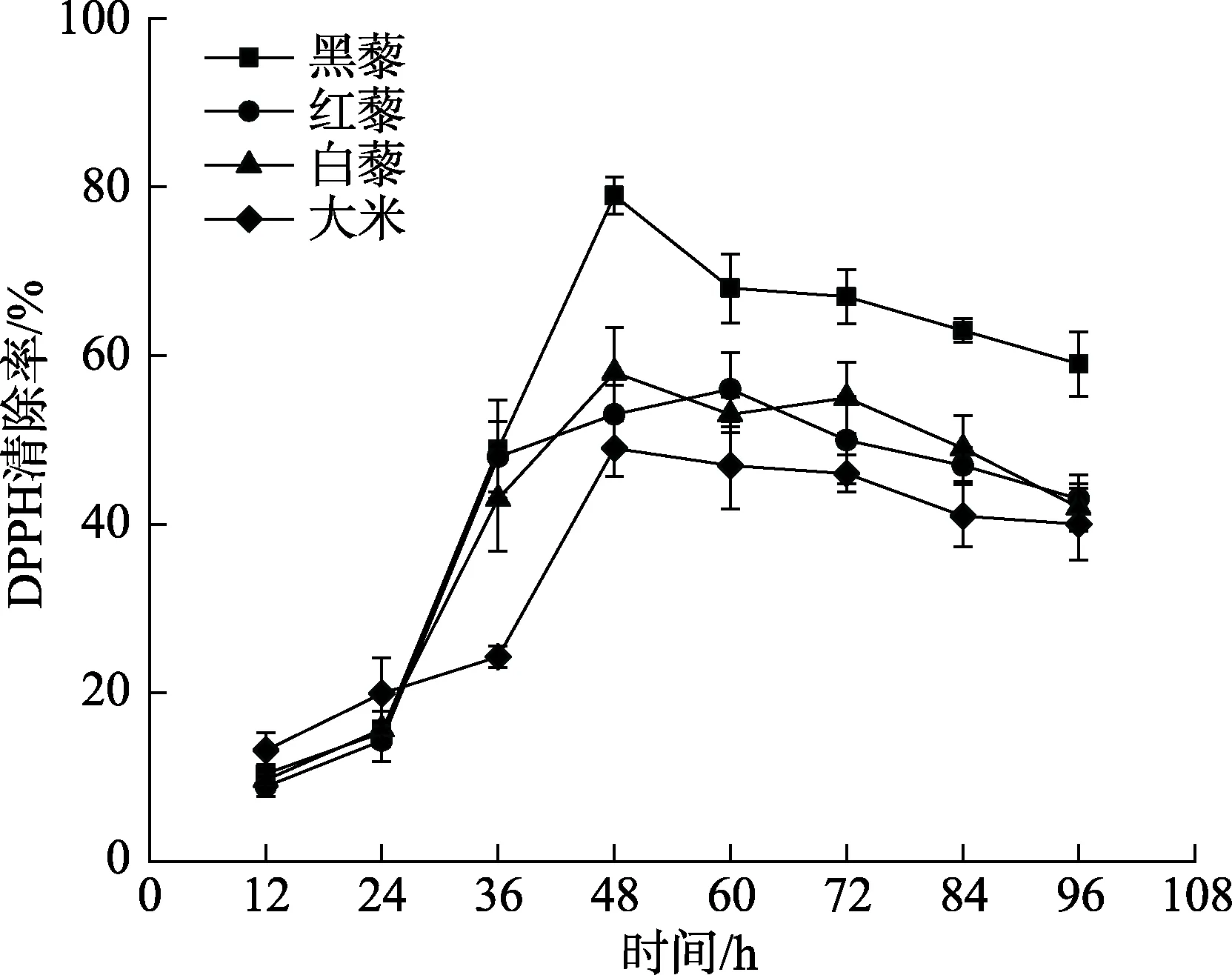
图6 发酵过程中黑藜、红藜、白藜DPPH自由基清除能力的变化Fig.6 Changes of DPPH radical scavenging ability of black quinoa,red quinoa and white quinoa during fermentation
2.7 还原能力
发酵过程中黑藜、红藜、白藜还原能力的变化见表 7,从图 7可以看出在相同发酵条件下藜麦发酵产物的还原能力要高于大米,与DPPH自由基清除能力的变化相比,藜麦和大米发酵产物的还原能力几乎都在48 h达到最高,仅有黑藜在60 h达到最高。藜麦发酵产物的还原能力变化趋势与其对DPPH自由基清除能力的变化趋势成一致性,这主要是由于其酚类物质含量的变化引起的,且黑藜的酚类含量高,故其还原能力也强。因此再一次验证了固态发酵释放酚类物质可提高发酵产物的抗氧化性能。

图7 发酵过程中黑藜、红藜、白藜还原能力的变化Fig.7 Changes of reducing ability of black quinoa,red quinoa and white quinoa during fermentation
3 结论
本研究通过对藜麦固态发酵过程中各项指标进行检测,以大米作为参照,研究藜麦发酵过程中pH、总酸、总糖、氨基酸态氮含量的变化,这些变化与藜麦中淀粉、蛋白质含量有关并与发酵过程中微生物种群类别、数量息息相关,从实验结果来看,黑藜与红藜相较于白藜营养价值更高。研究发现,在发酵过程中,48 h时藜麦的总酚含量达到最高,且发酵产物的抗氧化能力与酚类物质含量高低呈现一致性,其中黑藜通过固态发酵的效果最好,其 DPPH自由基清除率最高达到80%,可知通过固态发酵技术,能有效释放藜麦中的结合酚类物质,提高总酚含量,从而提升发酵产物的抗氧化能力。
