HPLC法测定山楂炮制前后10种有机酸成分的含量
2021-07-25蒋昊
蒋昊
(天津市第一中心医院药学部,天津 300192)
山楂来源于蔷薇科山楂属植物山里红Cralaegus pinnatifida.Bge.var.major N.E.Br.或山楂Crataegus pinnatifida Bge.的干燥成熟果实。山楂具有消食健脾、行气散瘀、化浊降脂的功效。山楂主要含有黄酮、有机酸、萜类等多种成分[1-2]。其中有机酸是消食健脾的主要有效成分[3]。现代药理研究表明,山楂对H2O2诱导的H9C2心肌细胞和血管内皮细胞损伤均具有保护作用[4-5],此外还有抗菌、抗氧化和血脂血糖调节作用等[6]。有机酸有一定的刺激性,临床上多用其炮制品炒山楂和焦山楂来消食导滞,其中焦山楂消食导滞作用较强,常用于肉食积滞,泻痢不爽。而山楂炭则具有收敛止血、固涩止泻的功效。有机酸对热不稳定,加热炮制后总有机酸含量会降低[7-11],而部分有机酸成分的含量也是随着温度升高和加热时间延长呈现下降趋势[12-13],这也是导致不同炮制品药效作用差异的原因之一。山楂具有药食同源的特点,山楂的提取和加工常用水作为溶媒,因此本研究针对山楂中水溶性较好的10种有机酸成分,建立了高效液相色谱法(HPLC)同时进行含量测定的方法,旨在为今后研究山楂炮制前后的有机酸成分变化规律提供条件和参考。
1 材料
1260型高效液相色谱仪,二极管阵列检测器(美国安捷伦科技有限公司),MSE6.6S-OCE-DM型百万分之一微量天平(赛多利斯实验室仪器有限公司),JP-060S型超声波清洗仪(深圳市洁盟清洗设备有限公司),FW100型高速粉碎机(天津泰斯特仪器有限公司)。
去核山楂饮片(购于安徽亳州药材市场,产地四川),经天津中医药大学李天祥教授鉴定为蔷薇科山楂属植物山楂Crataegus pinnatifida Bge.的干燥成熟果实。草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸、咖啡酸对照品(上海源叶生物科技有限公司,纯度≥98%),水为超纯水,甲醇、乙腈为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件 Hypersil ODS2色谱柱(4.6 mm×250 mm,5 μm),流动相:0.1% 磷酸水溶液(A)∶甲醇(B)梯度洗脱(0~10 min,1%~25%B;10~28 min,25%B;28~30 min,25%~1%B;30~35 min,1%B),检测波长:210 nm,流速:0.8 mL/min,柱温 27.5℃,进样量10 μL。见图1。
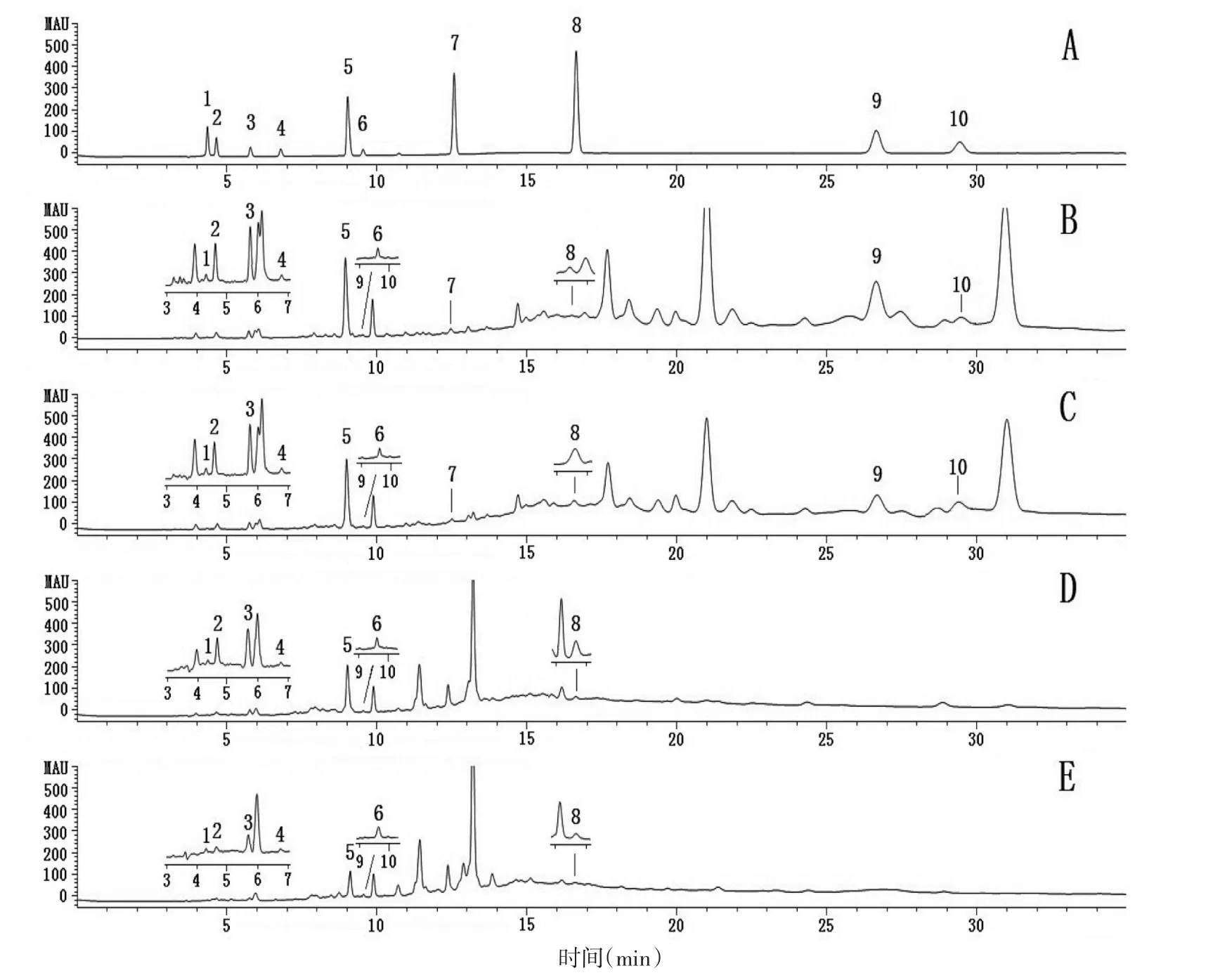
图1 山楂的HPLC色谱图Fig.1 HPLC chromatograms of CP
2.2 对照品储备液的制备 精密称量适量草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸和咖啡酸对照品,加50%甲醇水溶液配制成浓度分别为 200、900、900、800、5 000、800、50、50、50、50 μg/mL 的混合对照品储备液,并逐级稀释配制成一系列浓度的混合对照品溶液,备用。
2.3 供试品溶液的制备 取山楂饮片,粉碎,过80目筛,得到山楂细粉,取该细粉1 g,加适量水,30℃超声30 min,过滤后定容于25 mL容量瓶中,取适量过0.45 μm滤膜,备用。
2.4 炮制品的制备[8]
2.4.1 炒山楂的制备 取净制的山楂,将其放在已预热适宜的炒制容器内,用中火(120℃)加热,并不断翻炒,炒至颜色变深,取出放凉。
2.4.2 焦山楂的制备 取净制的山楂,将其放在已预热适宜的炒制容器内,用中火(120℃)加热炒至表面焦褐色,内部为黄褐色,取出放凉。
2.4.3 山楂炭的制备 取净制的山楂,将其放在已预热适宜的炒制容器内,用武火(180℃)加热,翻炒至表面黑色,内部为焦褐色,取出放凉。
2.5 方法学考察
2.5.1 线性关系考察 精密吸取上述10种对照品的混合溶液适量,加水稀释后得系列质量浓度的混合对照品溶液,分别按2.1项下色谱条件测定,记录峰面积,以对照品的质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸、咖啡酸的回归方程、线性范围、相关系数见表1。

表1 山楂中10种有机酸成分的回归分析、线性范围、相关系数Tab.1 Regression analysis,linear range and correlation coefficient of ten organic acid components in CP
2.5.2 精密度实验 精密吸取混合对照品溶液10 μL,按2.1项下色谱条件重复进样6次,计算草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸、咖啡酸的峰面积RSD分别为1.26%,1.55%,0.70%,0.81%,0.64%,0.71%,1.20%,0.81%,0.66%,0.90%,表明仪器精密度良好。
2.5.3 稳定性实验 精密吸取同一生山楂供试品溶液,分别在制备后 0、2、4、6、8、12、24 h 按 2.1 项下色谱条件测定,计算草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸、咖啡酸的峰面积RSD,常温放置24 h后10种有机酸成分的峰面积 RSD分别为 2.79%、2.55%、2.20%、2.77%、2.06%、2.91%、2.75%、2.68%、2.10%、2.10%;4℃放置24 h后10种有机酸成分的峰面积RSD分别为 1.51%、1.48%、1.92%、1.11%、0.91%、1.77%、1.57%、1.12%,0.97%,1.03%,表明供试品溶液在24 h内稳定,且在4℃低温保存更稳定。
2.5.4 重复性实验 精密称取同一批生山楂样品6份,按2.3项下方法制备供试品溶液,按2.1项下条件测定,计算草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸、咖啡酸的峰面积RSD分别为1.92%、1.94%、0.89%、0.68%、1.74%、1.95%、2.47%、1.85%、1.91%、1.83%,表明该方法重复性良好。
2.5.5 加样回收率实验 取同一批已知各指标成分含量的生山楂样品1.0 g,平行6份,精密称定,每份分别精密加入适量的10种有机酸对照品,按2.3项下方法制备供试品溶液,按2.1项下色谱条件测定,计算草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、没食子酸、原儿茶酸、香草酸、咖啡酸的平均加样回收率和RSD,见表2。

表2 山楂中10个有机酸成分含量测定的加样回收率实验Tab.2 Recovery test of content determination of ten organic acid components in CP
2.6 样品测定 取生山楂饮片及其炮制品,按2.3项下方法制备供试品溶液,平行3份,按2.1项下色谱条件测定,采用外标法计算各样品中上述10种有机酸成分的含量。见表3。
表3 山楂中10个有机酸成分炮制前后的含量(±s)Tab.3 Contents of ten organic acid components in CP before and after processing(±s)
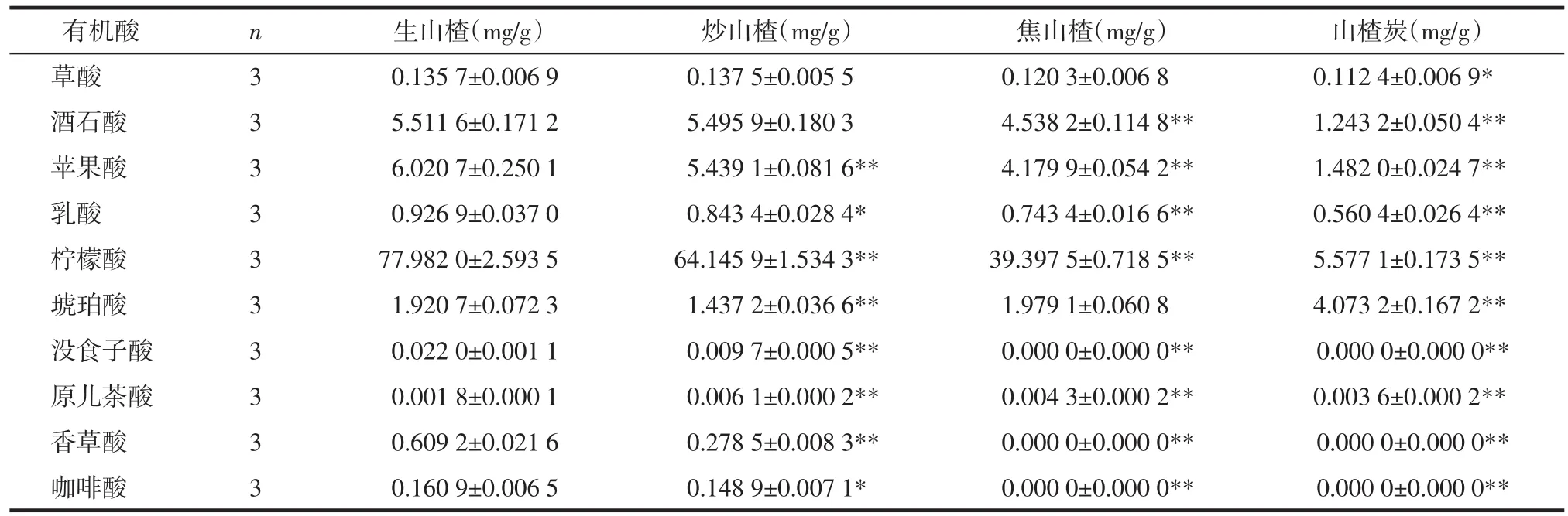
表3 山楂中10个有机酸成分炮制前后的含量(±s)Tab.3 Contents of ten organic acid components in CP before and after processing(±s)
注:采用 SPSS 25.0 统计软件对各炮制品与生品含量比较,*P<0.05,**P<0.01。
有机酸 n草酸 3酒石酸 3苹果酸 3乳酸 3柠檬酸 3琥珀酸 3没食子酸 3原儿茶酸 3香草酸 3咖啡酸 3生山楂(mg/g) 炒山楂(mg/g) 焦山楂(mg/g) 山楂炭(mg/g)0.135 7±0.006 9 0.137 5±0.005 5 0.120 3±0.006 8 0.112 4±0.006 9*5.511 6±0.171 2 5.495 9±0.180 3 4.538 2±0.114 8** 1.243 2±0.050 4**6.020 7±0.250 1 5.439 1±0.081 6** 4.179 9±0.054 2** 1.482 0±0.024 7**0.926 9±0.037 0 0.843 4±0.028 4* 0.743 4±0.016 6** 0.560 4±0.026 4**77.982 0±2.593 5 64.145 9±1.534 3** 39.397 5±0.718 5** 5.577 1±0.173 5**1.920 7±0.072 3 1.437 2±0.036 6** 1.979 1±0.060 8 4.073 2±0.167 2**0.022 0±0.001 1 0.009 7±0.000 5** 0.000 0±0.000 0** 0.000 0±0.000 0**0.001 8±0.000 1 0.006 1±0.000 2** 0.004 3±0.000 2** 0.003 6±0.000 2**0.609 2±0.021 6 0.278 5±0.008 3** 0.000 0±0.000 0** 0.000 0±0.000 0**0.160 9±0.006 5 0.148 9±0.007 1* 0.000 0±0.000 0** 0.000 0±0.000 0**
3 讨论
3.1 提取方法的选择 2015版《中国药典》规定有机酸的提取方法[14]:取本品细粉约1 g,精密称定,精密加入水100 mL,室温下浸泡4 h,时时振摇,滤过。另有研究用水或者不同浓度乙醇作溶剂,采用超声或回流的方法提取有机酸[15-18]。另有报导用果胶酶预处理后采用浸提法提取中药山楂中有机酸成分,相比溶剂浸提法得率增加了近一倍[19]。从色谱峰个数、峰面积及经济角度考虑,提取时间以30 min为佳。本研究采用30℃水超声30 min的提取方法,由于山楂中部分有机酸成分的含量较低,因此加大了待测药液的浓度,药材粉末的重量和提取溶剂的比例设定为 1∶25(g∶mL)。
3.2 色谱条件的优化 本研究比较了WelchUltimate AQ-C18和Hypersil ODS2两种色谱柱,后者对10种有机酸成分的分离效果更好。草酸、苹果酸、乳酸、柠檬酸、琥珀酸和酒石酸在210 nm附近有最大吸收,没食子酸、原儿茶酸和香草酸在260和270 nm附近有最大吸收,咖啡酸在290和320 nm附近有最大吸收。通过比较上述5个检测波长,发现草酸、苹果酸、乳酸、柠檬酸和琥珀酸在260、270、290和320 nm处吸收较小或没有吸收,而没食子酸、原儿茶酸、香草酸和咖啡酸在210 nm处也有较强吸收,故最终选定210 nm为检测波长。
流动相的pH值对有机酸的分离度和峰型影响较大,比较了甲醇-甲酸水溶液、甲醇-乙酸水溶液、甲醇-磷酸水溶液、乙腈-甲酸水溶液、乙腈-乙酸水溶液、乙腈-磷酸水溶液6种组合的流动相,甲醇-磷酸水溶液的分离效果最好,而磷酸的浓度越高,峰型越好,但考虑到pH值低于2会对色谱柱和仪器有损害,故采用0.1%磷酸做水相。
柱温和流速对有机酸的分离度影响较大,柱温越高,出峰越早、峰型越好,但是各峰之间分离度不好,尤其是极性大的有机酸成分几乎分不开;而减慢流速可以改善分离度。比较了 25、27.5、30、35、40℃5种柱温,25℃和27.5℃时分离效果最好,但是25℃易受室温影响,波动大,故选择27.5℃。比较了0.3、0.5、0.8和1 mL/min 4种流速,其中0.8 mL/min的分离效果和检测时间更合适,而0.3和0.5 mL/min流速时每个样品的检测时间过长,1 mL/min的流速无法将10种有机酸都分离开。
3.3 炮制前后10种有机酸成分的含量变化 草酸、酒石酸、苹果酸、乳酸、柠檬酸、没食子酸、香草酸、咖啡酸,这8种成分随炮制温度升高或加热时间延长,含量下降,这与总有机酸的变化趋势一致;琥珀酸的含量先下降后升高:炒山楂<生山楂<焦山楂<山楂炭。原儿茶酸的含量先升高后下降:生山楂<山楂炭<焦山楂<炒山楂,这两种成分与总有机酸的变化趋势不同。根据这两种有机酸含量变化规律推测炮制过程可能导致山楂中的其他成分在加热或pH值降低的条件下转化成琥珀酸和原儿茶酸。其中转化成的琥珀酸含量远远高于琥珀酸受热被破坏的含量,山楂炭中琥珀酸含量约为生品的2倍,推测加热或(和)pH值降低可以促进这种转化的发生;而山楂中原儿茶酸的含量本身就很微量,转化成的原儿茶酸含量又不足以弥补原儿茶酸受热被破坏的含量,推测短时间或低温加热可以促进这种转化的发生,而长时间或高温加热反而抑制这种转化。近年来的研究发现,由于山楂中含有较多糖类和氨基酸成分,在山楂炮制过程中会发生美拉德反应产生5-羟甲基糠醛(5-HMF),热加工程度越高,5-HMF的含量越高[20-21],而琥珀酸正是5-HMF的下游产物之一,因此推测在炮制过程中或在炮制品提取过程中部分5-HMF转化成琥珀酸,从而增加了琥珀酸的含量。
本研究通过HPLC法同时测定山楂炮制前后10种有机酸成分的含量变化,发现了琥珀酸和原儿茶酸不同的变化规律,其中的反应机制还有待更深入的研究探索。