矢志方对高尿酸血症大鼠尿酸和脂质代谢水平的影响
2021-07-25吴燕升谢芸周剑国刘秋玉刘伟伟高建东
吴燕升,谢芸,周剑国,刘秋玉,刘伟伟,高建东
实验研究
矢志方对高尿酸血症大鼠尿酸和脂质代谢水平的影响
吴燕升1,谢芸2,周剑国3,刘秋玉1,刘伟伟1,高建东1
1.上海中医药大学附属曙光医院,上海中医药大学中医肾病研究所,上海市中医临床肝肾疾病重点实验室,上海 201203;2.上海交通大学医学院附属第九人民医院,上海 200011;3.上海市松江区泗泾医院,上海 201601
观察矢志方对不同病程高尿酸血症大鼠尿酸和脂质代谢水平的影响。160只SD大鼠随机分为正常组、模型组、矢志方组和别嘌醇组,每组40只,除正常组外,其余各组给予氧嗪酸钾(750 mg/kg)灌胃制备高尿酸血症大鼠模型,矢志方组和别嘌醇组同时给予相应药物灌胃,实验第3、5、7、11周各组取10只大鼠检测肾功能(血尿酸、血尿素氮、血肌酐)、血脂[总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)]、血清及肝肾组织黄嘌呤氧化酶(XOD)活性及肾脏病理变化。与同一时间点正常组比较,模型组第11周TC、TG水平明显升高(<0.05),各时间点LDL-C、血尿酸水平及XOD活性均显著升高(<0.05),24 h尿酸排泄总量减少;与同一时间点模型组比较,矢志方组和别嘌醇组除第5周外血尿酸水平明显降低,血清及肝肾组织各时间点XOD活性明显降低(<0.05,<0.000 1),矢志方组第3、11周24 h尿酸排泄总量显著增加(<0.05),矢志方组第11周TC、TG和LDL-C水平明显降低,各组大鼠血尿素氮及血肌酐水平差异均无统计学意义(>0.05)。HE、PAS、Masson病理染色及电镜超微结构可见,矢志方可缓解肾小管炎症和纤维化改变。矢志方可降低不同病程高尿酸血症大鼠血尿酸水平,增加尿酸排泄量,改善脂质代谢,延缓肾小管间质纤维化。
高尿酸血症;矢志方;尿酸;脂质代谢;大鼠
流行病学调查及实验研究显示,高尿酸血症与痛风[1]、糖尿病[2-3]、代谢综合征[4]、慢性心力衰竭[5]、银屑病[6]、神经系统疾病[6-7]等有密切相关性。研究表明,尿酸浓度是慢性肾脏病(chronic kidney disease,CKD)早期肾功能衰竭的独立危险因素,与CKD全因死亡率呈“J”型相关[8]。高水平尿酸可诱导内皮细胞功能紊乱,慢性高尿酸血症可导致肾小管间质损伤,最终导致肾功能丧失[9]。
近年来,大量研究从尿酸导致肾脏损伤的各病理阶段探索具有降尿酸、保护肾脏损伤作用的药物。如Meng等[10]发现黄芩素能降低尿酸水平,保护高尿酸血症小鼠肾损伤;Chen等[11]发现祛浊通痹汤具有与别嘌醇不同方式的降尿酸作用。矢志方是上海中医药大学附属曙光医院治疗高尿酸血症及尿酸性肾病的验方,由车前子、芥子、王不留行和冬葵子组成,临床治疗高尿酸血症和尿酸性肾病20余年,疗效较好[12]。课题组前期研究发现,矢志方能降低高尿酸血症大鼠血尿酸,抑制肾小管炎症[13],促进尿酸转运蛋白表达[14]。然而现有研究均局限于单一时间段药物降尿酸作用,忽视了高尿酸血症及导致肾损伤的动态变化过程。基于此,本实验观察矢志方对不同病程高尿酸血症大鼠的治疗作用,跟踪高尿酸血症对肾脏的动态损伤过程,为矢志方临床应用提供更多实验依据。
1 实验材料
1.1 动物
健康成年雄性SPF级SD大鼠160只,体质量(200±20)g,北京西普尔-必凯实验动物有限公司提供,动物许可号SYXK(沪)2018-0016,动物伦理学编号SZY201512003。饲养于上海中医药大学实验动物中心,温度25 ℃,相对湿度45%,12 h光照,自由摄食饮水,适应性喂养1周。
1.2 药物
矢志方(王不留行、芥子、冬葵子各15 g,车前子30 g,批号分别为140220、LY1505016、160517HY、151225),饮片均购自上海药房股份有限公司徐重道中药饮片厂,委托国家中药制药工程技术研究中心制成复方颗粒剂;别嘌醇片,货号05160702,上海信谊万象药业股份有限公司,80 mg/片。
1.3 主要试剂与仪器
氧嗪酸钾,批号20160623,山东中科泰斗化学有限公司;切片石腊,货号69019361,国药集团化学试剂有限公司;甘油明胶封片剂(货号G1402)、苏木素-伊红染色试剂盒(货号G1005)、PAS染色试剂盒(货号G1008),武汉赛维尔生物科技有限公司;黄嘌呤氧化酶(XOD)活性检测试剂盒(货号A002),南京建成生物工程研究所。全自动生化分析仪(AU5800),美国Beckman公司;自动组织脱水机(KD-TS3A)、生物组织冷冻包埋机(KD-BM)、摊片机(KD-P)、烘片机(KD-H),浙江省金华市科迪仪器设备有限公司;荧光显微镜+数码成像系统(Nikon80i),日本Nikon;透射电子显微镜(Tecnai G2 SpiritBiotwin),德国FEI公司。
2 实验方法
2.1 分组、造模及给药
160只雄性SD大鼠随机分为正常组、模型组、矢志方组、别嘌醇组,每组40只。除正常组外,其余各组大鼠每日按750 mg/kg剂量灌胃氧嗪酸钾混悬液制备高尿酸血症大鼠模型,正常组予等体积蒸馏水灌胃,自由摄食饮水。矢志方组和别嘌醇组自造模第1日起给药,矢志方组予矢志方药液10.72 g/kg灌胃,别嘌醇组予别嘌醇溶液15 mg/kg灌胃,每日1次,给药体积2 mL(相当于临床成人日用剂量10倍)。
2.2 尿酸、肾功能及血脂水平检测
实验第3、5、7、11周,每组取10只大鼠留取24 h尿液(禁食不禁水),全自动生化分析仪检测尿液中尿酸浓度,计算24 h尿酸排泄总量(尿酸浓度×24 h尿量)。留尿后次日大鼠腹腔注射2.5%戊巴比妥钠(2 mL/kg)麻醉,腹主动脉取血,分离血清,全自动生化分析仪检测肾功能(血尿酸、血尿素氮、血肌酐)、血脂[总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)]。
2.3 病理观察
2.3.1 HE染色
大鼠肾组织置于90%乙醇溶液固定48 h,脱水,浸蜡,包埋,制作肾组织石蜡切片(3 µm),行HE染色,石蜡切片脱蜡至水,苏木素染细胞核,伊红染细胞质,脱水,中性树胶封片。
2.3.2 PAS染色
石蜡切片脱蜡至水,0.5%高碘酸水溶液氧化10~15 min,Schiff试剂暗处浸染30~40 min,流水冲洗10 min,苏木素染核30~60 s,1%盐酸水溶液分化3 s,氨水返蓝,无水乙醇脱水,正丁醇30 s,二甲苯透明,中性树胶封片。显微镜下观察,图像采集分析。
2.3.3 Masson染色
石蜡切片脱蜡至水,Weigert铁苏木素染5 min,自来水洗,1%盐酸乙醇分化,流水冲洗,丽春红染色5~10 min,蒸馏水快速漂洗,磷钼酸水溶液处理3~5 min,苯胺蓝染色5 min,1%冰醋酸处理1 min,脱水,中性树胶封片。显微镜下观察,图像采集分析。
2.4 超微结构观察
取1 mm×1 mm×1 mm肾皮质部分,固定于2.5%戊二醛溶液,4 ℃避光保存。样本树脂包埋后,行超薄切片,枸橼酸铅和醋酸铀染色。透射电镜观察肾皮质近端小管上皮细胞及细胞内结构改变。
2.5 黄嘌呤氧化酶活性测定
称取肾皮质和肝脏各20 mg,按1∶9(M∶V)加入生理盐水,制备10%组织匀浆,2500 r/min离心10 min,取上清液备用。按试剂盒说明书检测血清、肝肾组织XOD活性。
3 统计学方法
4 结果
4.1 一般状况
实验过程中各组大鼠精神较好,毛色光泽,对刺激反应灵敏,食欲旺盛,体质量增长较快。正常组第11周死亡1只,矢志方组第8、11周各死亡1只,别嘌醇组第11周死亡1只,均为灌胃不当所致。第3、5周各组大鼠体质量差异均无统计学意义(>0.05);第7周,与同一时间点正常组比较,模型组和矢志方组大鼠体质量明显减轻,差异有统计学意义(<0.05),第11周各组大鼠体质量差异无统计学意义(>0.05)。结果见表1。
4.2 矢志方对高尿酸血症大鼠尿酸水平的影响
各组大鼠血尿酸水平、24 h尿酸排泄总量随造模及饲养时间延长而升高,与同一时间点正常组比较,模型组大鼠血尿酸水平显著升高(<0.05),除第5周外,尿酸排泄总量明显减少(<0.05,<0.000 1);与同一时间点模型组比较,除第5周外,矢志方组和别嘌醇组大鼠血尿酸水平明显降低(<0.05,<0.000 1),矢志方组第3、11周尿酸排泄总量明显增加(<0.05)。结果见表2、表3。
4.3 矢志方对高尿酸血症大鼠肾功能的影响
各组大鼠同一时间血尿素氮及血肌酐含量无明显差异(>0.05),结果见表4、表5。
4.4 矢志方对高尿酸血症大鼠血脂水平的影响
与同一时间点正常组比较,模型组大鼠第11周TC、TG含量明显增加,第3、5、7、11周LDL-C含量明显增加(<0.05)。与同一时间点模型组比较,矢志方组大鼠第5、11周TC含量减少,第11周TG含量减少,第5、7、11周LDL-C含量明显减少,差异均有统计学意义(<0.05);别嘌醇组大鼠第5周TC、TG含量减少,第5、7、11周LDL-C含量明显减少(<0.05)。结果见表6~表8。

表1 各组大鼠不同时间点体质量比较(±s,g,每组8~10只)
注:与同一时间点正常组比较,*<0.05

表2 各组大鼠不同时间点血尿酸水平比较(±s,µmol/L,每组8~10只)
注:与同一时间点正常组比较,*<0.05;与同一时间点模型组比较,#<0.05,####<0.000 1

表3 各组大鼠不同时间点24 h尿酸排泄总量比较(±s,µmol,每组8~10只)
注:与同一时间点正常组比较,*<0.05,****<0.000 1;与同一时间点模型组比较,#<0.05

表4 各组大鼠不同时间点血尿素氮含量比较(±s,mmol/L,每组8~10只)

表5 各组大鼠不同时间点血肌酐含量比较(±s,µmol/L,每组8~10只)

表6 各组大鼠不同时间点TC含量比较(±s,mmol/L,每组8~10只)
注:与同一时间点正常组比较,*<0.05;与同一时间点模型组比较,#<0.05

表7 各组大鼠不同时间点TG含量比较(±s,mmol/L,每组8~10只)
注:与同一时间点正常组比较,*<0.05;与同一时间点模型组比较,#<0.05

表8 各组大鼠不同时间点LDL-C含量比较(±s,mmol/L,每组8~10只)
注:与同一时间点正常组比较,*<0.05;与同一时间点模型组比较,#<0.05
4.5 矢志方对高尿酸血症大鼠肾组织病理形态的影响
HE染色显示:正常组大鼠肾组织结构基本正常;模型组大鼠偶见局部肾近曲小管上皮细胞肿胀,发生空泡变性,第7、11周炎性细胞浸润增加,肾小管上皮细胞空泡变性增加并伴有细胞核脱落,肾小球未见明显异常;矢志方组和别嘌醇组各时间点肾近曲小管上皮细胞肿胀减轻,鲜有空泡变性,炎症细胞浸润较模型组明显改善。见图1。
PAS及Masson染色显示:正常组大鼠肾小管排列整齐,管壁均匀,管腔腔面内侧微绒毛形成的刷状缘形态正常,基底部细胞内陷形成基底褶,未见肾间质纤维化;模型组大鼠偶见肾小管间质炎性细胞浸润,第3、5周未见明显肾小管及间质纤维化发生,第7周可见肾小管间质及肾小球内嗜蓝染色明显增多,第11周可见肾小球内、肾小管管腔及间质较前期出现明显纤维化;矢志方组和别嘌醇组大鼠肾小管排列整齐,管壁均匀连续,在整个实验周期内肾小管间质纤维化改变均不明显。见图2、图3。

图1 各组大鼠肾组织形态(HE染色,×400)

图2 各组大鼠肾组织形态(PAS染色,×400)
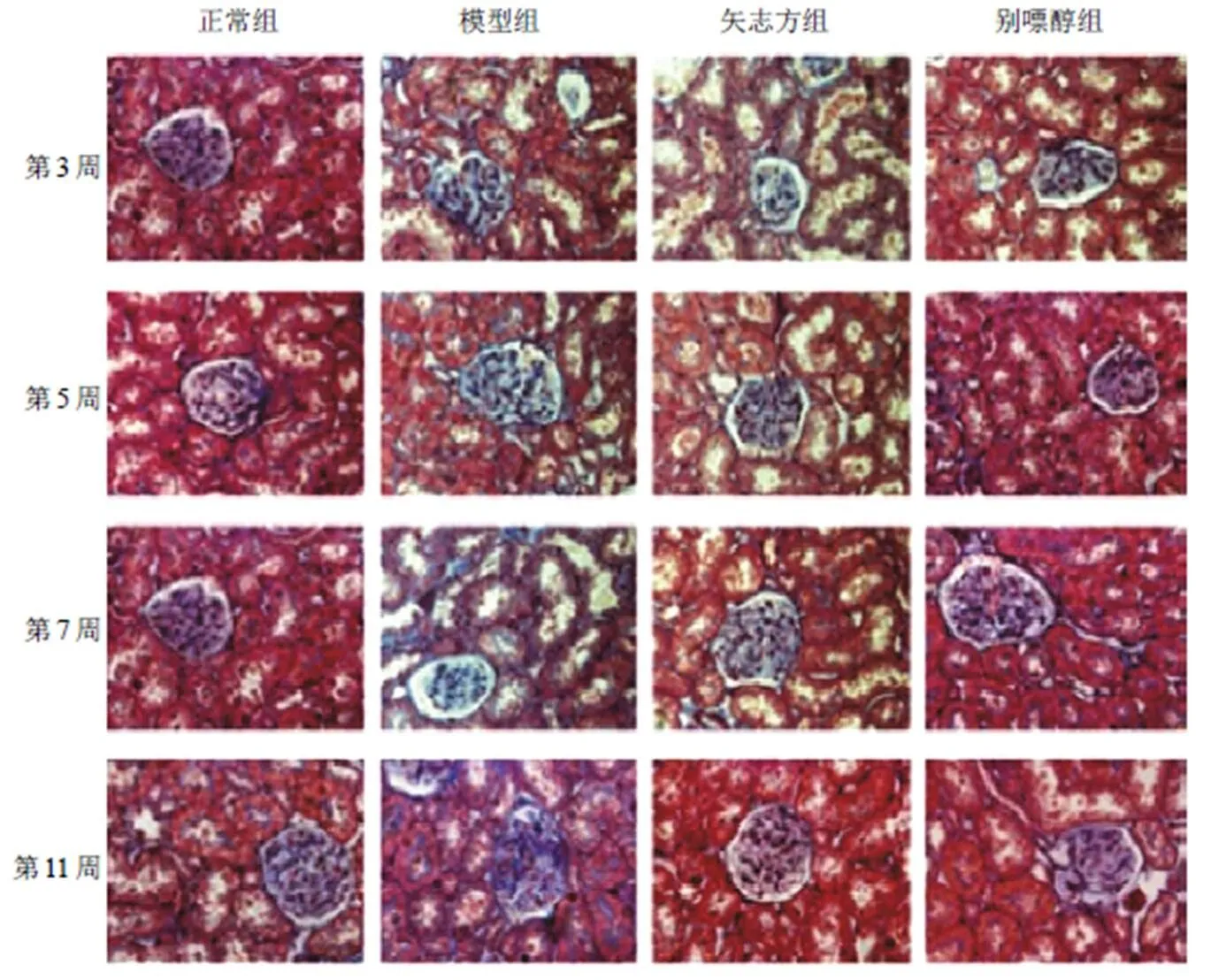
图3 各组大鼠肾组织形态(Masson染色,×400)
透射电镜观察显示,正常组大鼠肾脏近端小管上皮细胞及附件结构正常,肾小管排列整齐,微绒毛丰富、结构清晰完整,线粒体丰富,无结构损伤。第3周,模型组大鼠偶见死亡细胞,并可见死亡细胞碎片;矢志方组和别嘌醇组大鼠上皮细胞结构无明显改变。第5周,模型组和矢志方组肾脏近端小管均可见死亡细胞碎片,别嘌醇组可见微绒毛变性、线粒体结构欠清晰。第7周,模型组可见上皮细胞变性、肿胀,死亡细胞增多,质膜内褶增多;矢志方组和别嘌醇组可见与模型组类似改变。第11周,模型组频见死亡细胞,胞质肿胀,内容物释放;矢志方组和别嘌醇组可见较多死亡细胞碎片,别嘌醇组微绒毛结构破坏。见图4。

注:A.死亡细胞碎片;B.微绒毛变性、线粒体结构欠清晰;C.细胞空泡变性,胞质肿胀,内容物释放;D.质膜内褶增多
4.6 矢志方对高尿酸血症大鼠血清和肝、肾组织黄嘌呤氧化酶活性的影响
与同一时间点正常组比较,模型组大鼠各时间点血清和肝、肾组织XOD活性显著升高,差异均有统计学意义(<0.05,<0.01,<0.000 1);与同一时间点模型组比较,矢志方组和别嘌醇组各时间点血清XOD活性明显降低,差异均有统计学意义(<0.05,<0.000 1),矢志方组大鼠第3、11周肝、肾组织XOD活性明显降低,差异有统计学意义(<0.05),第5周矢志方组肝组织XOD活性显著高于别嘌醇组,差异有统计学意义(<0.05),其余时间点2组大鼠XOD活性差异无统计学意义(>0.05)。结果见表9、表10。

表9 各组大鼠不同时间点血清XOD活性比较(±s,U/L,每组8~10只)
注:与同一时间点正常组比较,*<0.05,****<0.000 1;与同一时间点模型组比较,#<0.05,####<0.000 1

表10 各组大鼠不同时间点肝肾组织XOD活性比较(±s,U/L)
注:与同一时间点正常组比较,*<0.05,**<0.01,****<0.000 1;与同一时间点模型组比较,#<0.05,####<0.000 1;与同一时间点别嘌醇组比较, ▲<0.05
5 讨论
高尿酸血症患者血尿酸一般为正常人群的1.5~2倍,并且呈慢性进展性病程,故本研究用750 mg/kg氧嗪酸钾灌胃制备高尿酸血症大鼠模型,更符合临床特点[15]。通过比较血尿酸水平发现,第3周各组大鼠血尿酸水平差异明显,模型组血尿酸水平上升迅速而尿酸排泄能力较差,表明氧嗪酸钾能抑制尿酸酶,提升血尿酸水平。第5周各组大鼠血尿酸水平缓慢上升,给药组与模型组比较差异无统计学意义(>0.05),各组大鼠24 h尿酸排泄总量差异均无统计学意义,与文献报道[16]一致。由于氧嗪酸钾竞争性抑制尿酸酶活性,此时期可能出现尿酸酶反馈性激活,尿酸酶活性增强,促进尿酸水解后排出。随着造模及用药时间的累积,氧嗪酸钾对尿酸酶的抑制作用趋于稳定,第7、11周可见造模大鼠血尿酸水平稳定升高,尿酸排泄总量明显下降。
研究表明,较低血尿酸水平可能带来类似高水平尿酸的风险[17],尿酸是机体糖、脂代谢的调节器[18],与血脂水平存在明显相关性。研究表明,高基线血尿酸是发生高LDL-C的独立风险因素,超过5年血尿酸升高也是发展成高LDL-C和高TG血症的独立危险因素[19]。亚洲及非洲人种尿酸水平与代谢综合征的多种因素有关,如腰围、体质量指数、TG、TC等[20]。
根据高尿酸血症临床表现,可归属于中医学“痛风”“痹证”“腰痛”“水肿”“石淋”“肾劳”等范畴。《丹溪心法》有“肥人肢节痛,多是风湿与痰饮流注经络而痛,瘦人肢节痛,是血虚”。《格致余论•痛风论》提到“彼痛风者,大率因血受热,已自沸腾,其后或涉冷水,或立湿地,或扇取凉,或卧当风,寒凉外抟,热血得寒,污浊凝涩,所以作痛”。我们认为,本病病机为脾肾不足,兼夹湿浊、痰瘀,为本虚标实之证。湿浊、痰瘀是基本病理因素,在病情发生发展中出现痰瘀互结。为此确立化痰祛湿、活血化瘀治法及中药复方矢志方。方中芥子、车前子为君药,共奏化痰祛湿、祛痰散结之效;配伍王不留行为臣,通络逐瘀,使瘀血化,痰涎祛,津血运行通畅;车前子因其利水除湿之功甚殊,与王不留行及芥子相配,加强通络涤痰之效;佐以冬葵子利水消导,使邪有去路,津行得通,而使化瘀祛痰之效更甚。诸药合用,化痰祛湿、活血化瘀,则脉道得通,血行得畅,水道通利,津行不滞。本研究结果显示,矢志方可降低高尿酸血症大鼠血尿酸,改善脂质代谢,延缓肾小管间质纤维化,对不同病程阶段的高尿酸血症大鼠均有积极的治疗作用。
[1] PEREZ-RUIZ F, MARIMON E, CHINCHILLA S P. Hyperuricaemia with deposition:latest evidence and therapeutic approach[J]. Ther Adv Musculoskelet Dis,2015,7(6):225-233.
[2] ZHU Y, HU Y, HUANG T, et al. High uric acid directly inhibits insulin signalling and induces insulin resistance[J]. Biochem Biophys Res Commun,2014,447(4):707-714.
[3] LYTVYN Y, PERKINS B A, CHERNEY D Z. Uric acid as a biomarker and a therapeutic target in diabetes[J]. Can J Diabetes, 2015,39(3):239-246.
[4] IBRAHIM S M, EL-DENSHARY E S, ABDALLAH D M. Geraniol, alone and in combination with pioglitazone, ameliorates fructose-induced metabolic syndrome in rats via the modulation of both inflammatory and oxidative stress status[J]. PLoS One,2015,10(2):e0117516.
[5] BRAGA F, PASQUALETTI S, FERRARO S, et al. Hyperuricemia as risk factor for coronary heart disease incidence and mortality in the general population:a systematic review and meta-analysis[J]. Clin Chem Lab Med,2016,54(1):7-15.
[6] LI X, MIAO X, WANG H, et al. Association of serum uric acid levels in psoriasis[J]. Medicine,2016,95(19):e3676.
[7] DE GIORGI A, FABBIAN F, PALA M, et al. Uric acid: friend or foe? Uric acid and cognitive function “Gout kills more wise men than simple”[J]. Eur Rev Med Pharmacol Sci,2015,19(4):640-646.
[8] SRIVASTAVA A, KAZE A D, MCMULLAN C J, et al. Uric acid and the risks of kidney failure and death in individuals with CKD[J]. American Journal of Kidney Diseases,2018,71(3):362-370.
[9] KANBAY M, YILMAZ M I, SONMEZ A, et al. Serum uric acid level and endothelial dysfunction in patients with nondiabetic chronic kidney disease[J]. Am J Nephrol,2011,33(4):298-304.
[10] MENG X L, MAO Z , LI X , et al. Baicalein decreases uric acid and prevents hyperuricemic nephropathy in mice[J]. Oncotarget, 2017,8(25):40305-40317.
[11] CHEN J, ZHOU J, WEI S S, et al. Effect of a traditional Chinese medicine prescriptionDecoction on hyperuricemia model rats studied by using serum metabolomics based on gas chromatography-mass spectrometry[J]. Journal of Chromatography B,2016,1026:272-278.
[12] 李屹,何立群.矢志方治疗痰浊瘀阻型尿酸性肾病33例[J].上海中医药杂志,2011,45(9):41-43.
[13] WU Y S, HE F, LI Y Q, et al. Effects ofon NLRP3 inflammasome activation and renal tubular injury in hyperuricemic rats[J]. Evidence-based Complementray and Alternative Medicine, 2017,2017:7674240.
[14] WU Y S, WANG Y X, OU J Y, et al. Effect and mechanism of Shizhifang on uric acid metabolism in hyperuricemic rats[J]. Evidence-based Complementary and Alternative Medicine,2018, 2018:1-11.
[15] 吴燕升,万强,史丽强,等.高尿酸血症肾纤维化动物模型研究进展[J].成都医学院学报,2016,11(6):747-750.
[16] MAZZALI M, HUGHES J, KIM Y G, et al. Elevated uric acid increases blood pressure in the rat by a novel crystal-independent mechanism[J]. Hypertension,2001,38(5):1101-1106.
[17] DIN U A A S E, SALEM M M, ABDULAZIM D O. Uric acid in the pathogenesis of metabolic, renal, and cardiovascular diseases: a review[J]. Journal of Advanced Research,2017,8(5):537-548.
[18] LIMA W G, MARTINS-SANTOS M E, CHAVES V E. Uric acid as a modulator of glucose and lipid metabolism[J]. Biochimie,2015, 116:17-23.
[19] KUWABARA M, BORGHI C, CICERO A F G, et al. Elevated serum uric acid increases risks for developing high LDL-C cholesterol and hypertriglyceridemia:A five-year cohort study in Japan[J]. International Journal of Cardiology,2018,261:183-188.
[20] NAN H R, QIAO Q, SÖDERBERG S, et al. Serum uric acid and components of the metabolic syndrome in non-diabetic populations in Mauritian Indians and Creoles and in Chinese in Qingdao, China[J]. Metabolic Syndrome and Related Disorders,2008,6(1):47-57.
Effect ofPrescription on Serum Uric Acid and Lipid MetabolismLevel in Rats of Hyperuricemia
WU Yansheng1, XIE Yun2, ZHOU Jianguo3, LIU Qiuyu1, LIU Weiwei1, GAO Jiandong1
To observe the effects ofPrescription on serum uric acid and lipid metabolism level in rats with different courses of hyperuricemia.Totally 160 SD rats were divided into normal group, model group,Prescription group and allopurinol group, with 40 rats in each group. Except for the normal group, the other groups were given potassium oxazine (750 mg/kg) per day to prepare hyperuricemia rat models.Prescription group and the allopurinol group were given corresponding drugs simultaneously. On the 3rd, 5th, 7th, and 11th week of the experiment, 10 rats from each group were taken to test renal function (blood uric acid, blood urea nitrogen, blood creatinine), blood lipids (TC, TG, LDL-C), xanthine oxidation enzyme (XOD) activity of surem and kidney tissue and renal pathological changes.Compared with the normal group at the same time point, the TC and TG levels of the model group increased significantly at the 11th week (<0.05), and LDL-C levels increased significantly at each time point (<0.05), the blood uric acid level and XOD activity were significantly increased (<0.05), and the total amount of uric acid excretion in 24 h decreased. Compared with the model group at the same time point, the blood uric acid level ofPrescription group and allopurinol group was significantly reduced except the 5th week, and the XOD activity of serum and liver and kidney tissue was significantly decreased at each time point (<0.05,<0.000 1). The total amount of uric acid excretion in thePrescription group was significantly increased at the 3rd and 11th week (<0.05).Prescription group at 11th week TC, TG, LDL-C was significantly decreased (<0.05). There was no significant difference in the levels of blood urea nitrogen and blood creatinine in each group of rats (>0.05). The pathological staining of HE, PAS, Masson and the ultrastructure of electron microscopy could be seen.Prescription could alleviate renal tubular inflammation and fibrosis.Prescription can reduce blood uric acid levels in hyperuricemia rats with different courses, increase uric acid excretion, improve lipid metabolism, and delay tubular interstitial fibrosis.
hyperuricemia;Prescription; uric acid; lipid metabolism; rats
R285.5
A
1005-5304(2021)06-0052-07
10.19879/j.cnki.1005-5304.202010380
国家自然科学基金(81904126、81874437、81373613)
高建东,E-mail:gaojiandong@hotmail.com
(2020-10-31)
(2020-12-03;编辑:华强)
