金纳米颗粒的微反应连续合成
2021-07-24董晓锐王凯骆广生
董晓锐,王凯,骆广生
(清华大学化学工程系,化学工程联合国家重点实验室,北京100084)
引 言
金纳米颗粒(AuNPs)是一种重要的贵金属纳米材料,它可以分散于水中形成水溶胶,因此又被称为胶体金(colloidal gold)[1]。溶液中的金纳米颗粒表面被配体覆盖从而免于团聚沉淀,常见配体有柠檬酸钠(Na3Ct)[2]、十六烷基三甲基溴化铵(CTAB)[3]、聚乙烯吡咯烷酮(PVP)[4]等。由于存在局域表面等离子体共振效应,低浓度的金纳米颗粒溶液具有明显的紫外-可见光吸收[5],并且颗粒的粒径越均匀其吸收峰越窄[6]。如果金纳米颗粒在溶液中发生聚集,其特征吸收峰会发生红移并且展宽[7],因此可以利用金纳米颗粒对被检测物的光谱响应实施分析检测[5]。此外,金纳米颗粒也可被应用于超分子化学[8]、生物标记[9]、化学探针[10-11]等领域。
不同粒径的金纳米颗粒一般采用不同方法制备,如NaBH4还原法(1~10 nm)、晶种生长法(>40 nm)等[12-15],其中15~30 nm 的金颗粒制备技术大多源于Turkevich 法[16],其突出优势在于产物颗粒的粒径高度均一。该方法在水溶液中以弱还原剂柠檬酸钠作为反应物和配体,在沸腾条件下与氯金酸(HAuCl4)反应形成单质金,以不规则形态沉淀出的金颗粒晶核再经过一定时间的奥氏熟化[17]即可转变为窄分布的金纳米颗粒。该体系在酸性环境下反应速度快,但易受到原料混合的影响,一般制得的颗粒粒径分布较宽;相反在碱性环境下反应速度慢,通过长时间的搅拌反应有助于获得分散因子(PDI)小于10%的金纳米颗粒[18],因此Turkevich 法一般都在碱性反应条件下进行。反应体系的酸碱性可通过Na3Ct 与HAuCl4的比例控制,也可以通过外加无机酸碱进行调节。Turkevich 法制备出的金纳米颗粒表面由物理吸附的柠檬酸根离子保护,当结合能力更强的配体,如巯基化合物[19-20]存在时,柠檬酸根可以被交换下来[21],这使得很多生物分子经巯基修饰后,可进一步与金纳米颗粒结合形成功能化合物或超分子[22-23]。
由于金纳米颗粒的用途广泛,其批量制备技术是当前化学工程领域的研究热点。以往金纳米颗粒大多在搅拌釜内通过间歇反应合成,该方法存在固有局限性,例如:反应效率低、颗粒批次重复性差、制备规模难以灵活调节等。当前研究者普遍认为连续化的微反应技术是突破传统间歇搅拌反应局限的重要手段[24-26],而且实验室级别的微通道反应器也十分适合快速制备金纳米颗粒[27-29],避免纳米粒子大量储存过程中稳定性不佳的问题。2005年Wagner 等[30]拉开了金纳米颗粒连续合成的序幕,他们以抗坏血酸为还原剂,通过IPHT微通道反应器实现了5~50 nm 金颗粒的连续合成。该方法使用较强的还原剂快速完成反应过程,颗粒的均匀性不够理想。对于粒径控制能力强的Turkevich 法,相关微反应技术的报道还很少,主要原因在于该反应一般通过降低反应速率的方法控制颗粒的成核与生长,动力学上不利于微反应过程的实施,但也有少部分研究者在该方向上进行了尝试。例如Girardon 等[31]提出了一种不锈钢毛细管微反应器,他们通过T 型三通快速混合Na3Ct 和HAuCl4水溶液,制备出了平均粒径<5 nm 的金颗粒。由于物料停留时间短,反应仅停留在成核阶段,因此颗粒均匀性也欠佳。Gavriilidis 等提出了类似的毛细管微反应器用于实施Na3Ct和HAuCl4的水溶液反应[32-33],通过在合成过程中引入微波照射[34]或紫外线照射[35]的方法强化颗粒的成核,在一定程度上改善了粒径大小和分布状况。
为了实现窄分布金纳米颗粒的连续稳定制备,本文工作突破了传统Turkevich 法的碱性反应条件,提出了一种酸性条件下合成金纳米颗粒的微反应方法。该方法尝试在高反应速率下实施HAuCl4的还原反应,利用螺纹管微混合器强化反应物混合,保障成核环境的均匀性,引入惰性溶剂避免颗粒在反应器内沉积,在连续流的条件下完成纳米颗粒的成核、生长、熟化过程,利用膜分相装置对溶剂进行连续回收,实现金纳米颗粒的连续稳定合成。围绕该方法本文重点介绍了微反应器的设计依据,系统展示了反应物摩尔比、浓度、停留时间、水油体积比、pH等因素对于颗粒粒径分布和吸收光谱的影响规律。
1 实验材料和方法
1.1 材料
实验使用的三水合氯金酸(98%)来自Sigma-Aldrich,二水合柠檬酸钠(分析纯)、氢氧化钠(分析纯)来自国药集团化学试剂有限公司,正癸烷(色谱纯)来自阿拉丁生化科技股份有限公司,去离子水由The Lab 超纯水系统制备,电导率为18.2 mΩ。所有药品在实验中未进行进一步纯化。
1.2 装置和运行
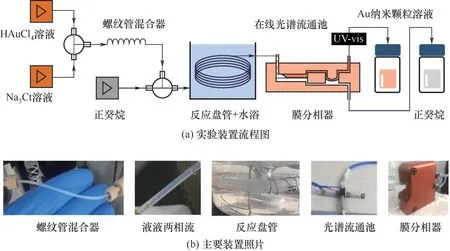
图1 金纳米颗粒微反应连续合成实验平台Fig.1 Experimental platform for the microreaction continuous synthesis of gold nanoparticles

1.3 分析检测
实验所获得的水相反应产物通过紫外-可见光谱仪(UV2450,Shimadzu Co.,Ltd.)测量吸收光谱,通过 激 光 光 散 射 仪(BI-90Plus,Brookhaven Instruments)测量溶液中金纳米颗粒的中值粒径(d50)和分散因子(PDI)。使用离心超滤管(Ultracel-50K,Merck Millipore)浓缩颗粒溶液,并在浓缩过程中使用去离子水洗涤产物颗粒2 次,最终将所获得的颗粒转移至微栅,通过透射电镜(JEM-2010,JEOL)观察颗粒的形貌和分散状态。
2 实验结果与讨论
2.1 单相反应体系的金纳米颗粒连续制备
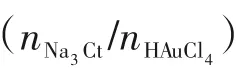
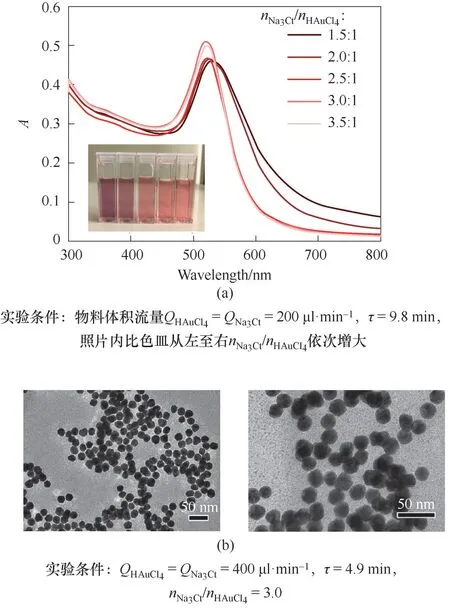
图2 Na3Ct/HAuCl4摩尔比对金颗粒特征吸收峰的影响和窄分布金颗粒的透射电镜照片Fig.2 Effect of Na3Ct/HAuCl4 molar ratio on the characteristic absorption peak of Au particles and the TEM images of narrowdistributed Au particles
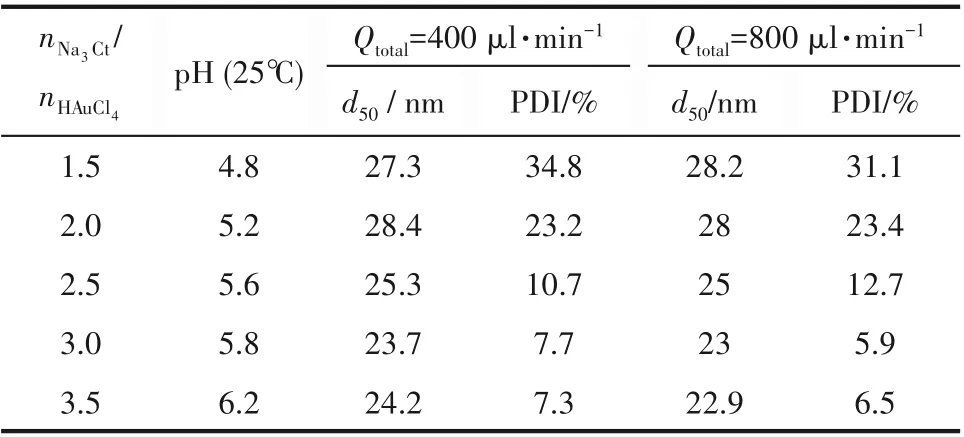
表1 反应体系pH和颗粒粒径分布结果Table 1 pH of the reaction system and particle size distribution results


在明确了反应的基本条件后,为了提升金纳米颗粒产量,尝试开展小时级连续微反应合成实验,结果发现金纳米颗粒的制备过程存在颗粒在反应器内壁吸附的问题。如图4所示,利用Na3Ct/HAuCl4摩尔比等于3 的实验条件开展连续合成研究,当微反应器工作时间达到2 h 时,产物溶液颜色明显变浅,3 h 后溶液的最大吸光度降低至初始值的1/4。取出水浴中的反应盘管,发现其颜色由透明变为紫红(图4 中照片),部分区域更显示出伴有金属光泽的黑色,说明有大量金颗粒沉积在反应管道上。产生颗粒吸附现象的原因一方面来源于95℃的高温反应环境下柠檬酸钠与金颗粒的结合力较弱,配体保护作用被削弱的金颗粒疏水性增强,易与疏水的反应器表面相结合;另一方面单相流反应器管壁附近流速低,颗粒停留时间长,容易在奥氏熟化的作用下进一步生长并且在管道表面发生沉降。因此,需进一步通过引入惰性溶剂隔绝纳米颗粒水溶液和输水反应管道,实现微反应器的长时间稳定运行。
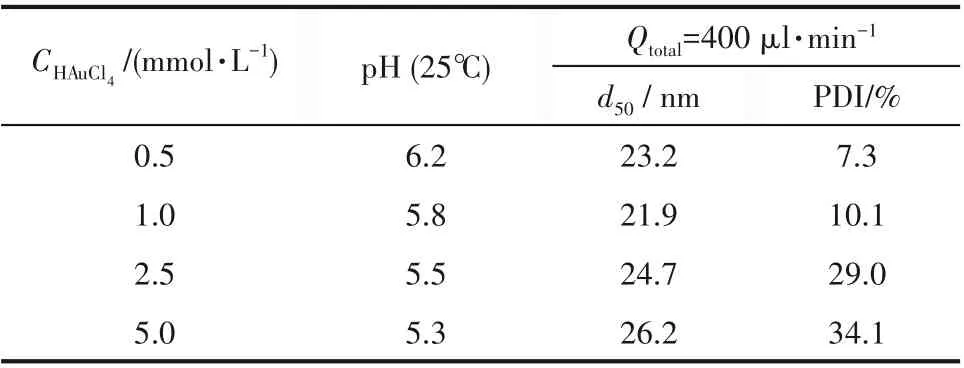
表2 不同反应物浓度实验的颗粒粒径分布Table 2 Particle size distribution in experiments with different reactant concentrations
2.2 两相反应体系的金纳米颗粒连续制备
为了解决金纳米颗粒在反应器内的吸附问题,进一步启用了图1所示的液液两相微反应系统。从图1(b)所示的PFA 毛细管内两相流照片可以看出,在疏水毛细管内部水相以液滴形式存在,因此在反应液滴和反应器管道之间存在一层有机相薄膜[38],该薄膜有效阻止了金颗粒接触反应管道壁面。实验结果表明:经过20 h 的连续合成实验,反应管道上仍然没有任何颗粒吸附沉积现象的发生。
图5对比了相同实验体系单相和两相反应产物溶液的吸收光谱曲线。为了对比颗粒的细微差别,对该曲线也采取归一化处理并使用式(1)定义的特征半峰宽Wλ定量比较特征吸收峰的分布情况。


图3 HAuCl4和Na3Ct浓度对金颗粒特征吸收峰的影响(实验条件:=200µl·min-1,τ=9.8 min =3.5)Fig.3 Effect of HAuCl4 and Na3Ct concentrations on the characteristic absorption peak of Au particles

图4 单相流体系连续微反应合成实验(实验条件==400µl·min-1,=0.5 mmol·L-1=3.0,τ=4.9 min)Fig.4 Continuous microreaction synthesis experiment in single-phase flow system

图5 单相与两相反应代表性产物颗粒的吸收光谱对比(实验条件=0.5 mmol·L-1=3.0,τ=4.9 min,单相反应=400µl·min-1;两相反应=300µl·min-1,=200µl·min-1)Fig.5 Comparison of absorption spectra of representative product particles of single-phase and two-phase reactions
针对两相反应在颗粒粒径分布上的不足,进一步优化反应条件以获得特征吸收峰型更优的金纳米颗粒。文献结果表明Turkevich 法制备的金纳米颗粒可经过一段时间的奥氏熟化变得更为均匀[18],因此尝试通过降低流速延长微反应器内的停留时间改善颗粒的分布状态,结果如图6(a)所示。随着反应停留时间从4.9 min 延长至11.8 min 颗粒的特征吸收峰明显变窄,特征半峰宽Wλ由96 nm 下降至77 nm,说明进行适当的奥氏熟化可以获得粒径更均匀的金颗粒。实验结果还表明停留时间9.8 min和11.8 min 的实验结果基本无差别,说明反应10 min 后奥氏熟化的作用不再明显。考虑到惰性溶剂并不参与反应过程,大量使用虽然可以更好地分割水相液滴,但是会占用反应器体系,影响物料处理量,因此尝试优化其用量,结果如图6(b)所示。实验结果表明:水油体积比从1∶1 到7∶1 都能起到隔绝水相和反应器壁面的效果,产物水溶液特征吸收峰半峰宽介于82~89 nm 之间。当水油体积比为8∶1时,过于悬殊的体积比导致水相液柱在反应管道内容易发生聚并,此时反应器内流动变得不稳定,实验不能稳定进行,也无法采集稳定的产物溶液。此外,实验还考察了反应体系pH 的微小调整对于粒径分布的影响。通过向Na3Ct 溶液中添加少量NaOH 改变反应体系的pH 进行实验,图6(c)所示的实验结果表明:在pH=6.2~6.6 的酸性范围内,所制备的金颗粒直径基本无差别,相应颗粒的特征吸收峰半峰宽在70~72 nm 之间,略优于图5 所示的单相体系反应结果。图7展示了获得的部分代表性颗粒的透射电镜照片,该实验在相对优化的实验条件下获得了分散因子小于10%的窄分布金纳米颗粒。
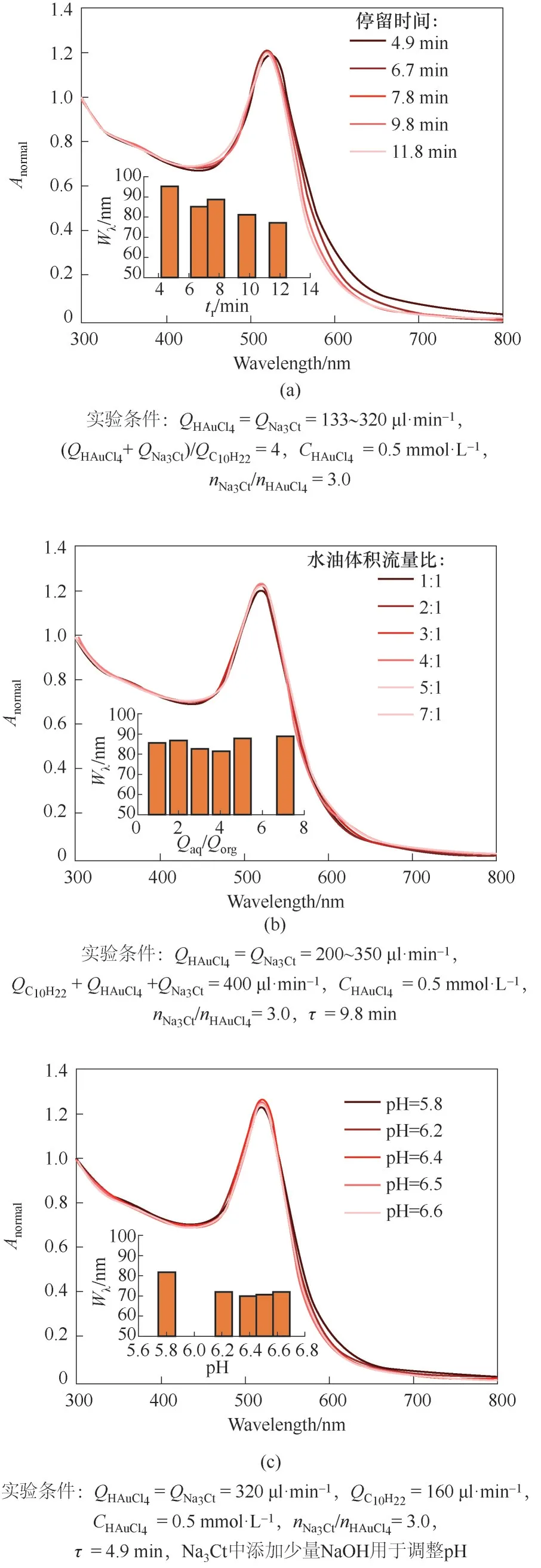
图6 不同反应条件对金纳米颗粒特征吸收峰的影响Fig.6 The influences of different reaction conditions on the characteristic absorption peaks of Au nanoparticles

图7 代表性产物颗粒的透射电镜照片Fig.7 TEM images of representative product particles
3 结 论
本文介绍了一种通过微反应系统合成窄粒径分布金纳米颗粒的方法。不同于常规间歇合成过程所使用的碱性Turkevich 反应体系,该方法使用酸性Turkevich 反应体系在高反应速率下实现了金纳米颗粒的连续稳定合成。所使用的微反应系统通过螺纹管混合器强化物料的快速均匀混合,引入正癸烷作为惰性溶剂防止纳米颗粒在反应器内吸附沉积,利用膜分离器实施在线油水分离实现溶剂的在线回收。研究结果表明:在95℃下,pH=5.6~6.6,HAuCl4浓度为0.5~1.0 mmol·L-1,Na3Ct/HAuCl4的摩尔比为3.0~3.5,反应体系的水油体积比≤7是较为优化的操作条件,在此条件下反应物经历4.9~9.8 min的停留时间即可完成金纳米颗粒的成核、生长、熟化过程,所制备的金纳米颗粒中值粒径为20~24 nm,分散因子小于10%。
