含牛轮状病毒VP6 的嵌合型HBcAg 颗粒抗原的制备及其免疫原性分析
2021-07-24邢亚茹张增贤顾文源彭志豪左玉柱范京惠
邢亚茹,张增贤,顾文源,郭 禹,彭志豪,左玉柱,范京惠
(1.河北农业大学 动物医学院,河北 保定 071001; 2. 宁晋县农业农村局,河北 宁晋 055550; 3. 河北省动物疫病预防控制中心,河北 石家庄 050035; 4. 河北省兽医生物技术创新中心,河北 保定 071001)
牛轮状病毒(Bovine rotavirus,BRV)是犊牛腹泻的重要病原之一。1968 年Mebus 等首次从新生犊牛腹泻粪便中分离到NCDV 株,并证实BRV 是引发新生犊牛腹泻的主要病原[1]。1980 年福建畜牧兽医研究所研究证实BRV 也存在于我国牛群中[2]。目前BRV感染在全球范围内流行,严重威胁着全世界养牛业的快速发展[3],因此有必要加强对BRV 的及时监测和防治。而预防BRV 的主要手段就是通过疫苗进行免疫接种,常见的疫苗有灭活疫苗和减毒活疫苗。世界范围内唯一的商品化BRV 减毒疫苗(NCDV-lincoln 株)已经获得USDA 的批文[4]。近年来,随着科学技术的不断进步和发展,基因工程疫苗也得到快速的发展,如嵌合疫苗、转基因疫苗和亚单位疫苗等。
RV 由外层衣壳、内层衣壳和核心衣壳3 层衣壳蛋白组成,分别编码(VP1 ~VP4、VP6、VP7)6 种结构蛋白和(NSP1 ~NSP6)6 种非结构蛋白[5]。VP6 蛋白可以在组装病毒颗粒的过程中让VP4 和VP7 空间结构更加稳定从而增强外壳蛋白的免疫原性。同时VP6 蛋白可以针对不同轮状病毒毒株产生交叉保护性免疫应答,这对BRV 疫苗的研制具有重要意义[6]。
1986 年,Newton SE 和Clarke 等人首次报道了HBcAg 可作为VLP 载体,用于包装外源的口蹄疫病毒片段,并通过实验证明可获得良好的免疫保护效果,这为表达其他外源性抗原提供了可能[7-9],同时HBcAg 在许多表达系统中都能高水平表达,如在人HeLa 细胞、腺病毒载体表达系统及细菌(大肠杆菌、沙门氏菌等)表达系统中都能有效表达[10-11]。因此,本研究以HBcAg 作为载体蛋白,在其主要免疫优势区插入VP6 序列,经诱导后在大肠杆菌中表达获得重组HBc-VP6 蛋白,并在小鼠模型组中检测重组蛋白的免疫原性,为今后研制BRV 疫苗提供重要的参考。
1 材料与方法
1.1 材料和试剂
pcDNA3.1(+)-HBcAg-VP1-VP4 阳性质粒由王家鑫老师惠赠;pET32a 空质粒由本实验室保存;BRV病毒阳性血清由本实验室收集保存;pMD19-T 载体、DL2000 DNA Marker、大肠杆菌DH5α 和BL21 感受态菌细胞均购自宝生物(大连)有限公司;蛋白纯化试剂盒购自北京康为世纪生物科技有限公司;小鼠细胞因子ELISA 检测试剂盒为北京绿源伯德生物科技有限公司产品;BALB/c 小鼠购自斯贝福实验动物科技有限公司。
1.2 引物的设计与合成
根据BRV(登录号MN047454)VP6 基因和乙肝病毒核心抗原基因序列(KC774394),设计上下游引物PCR.扩增所需的片段(见表1)。引物由上海生工生物工程技术服务有限公司合成。

表1 引物信息Table 1 Primer information
1.3 融合基因的扩增与重组表达载体的构建
以pcDNA3.1(+)-HBcAg-VP1-VP4 为 模 板,使用引物P5 及P6 扩增F3 片段,即HBcAg(编码83 ~144 aa)基因,胶回收PCR 扩增产物利用XhoⅠ和Hind Ⅲ进行双酶切回收并连接至pET32a 载体上,获得pET32a- HBcAg(编码83 ~144aa)重组质粒。同理利用P1 和P2 为引物扩增F1 片段,即HBcAg(编码1 ~74 aa),使用引物P3 及P4 扩增F2 片段,即VP6 基因。通过Overlap PCR 法将F1 和F2 片段融合扩增得到HBcAg(编码1 ~74aa)-VP6基因,胶回收PCR 扩增产物利用EcoRⅠ和Hind Ⅲ进行双酶切回收并连接至pET32a-HBcAg (编码83 ~144 aa)重组质粒,获得重组质粒pET32a-HBcAg-VP6。
1.4 重组蛋白的表达及纯化
将测序正确的阳性菌液培养至OD600nm为0.6 ~0.8 时,加入诱导剂IPTG,继续振荡培养6 h,收集菌体。超声破碎菌体,分别收集上清和沉淀进行SDS-PAGE 电泳,观察目的蛋白的表达情况。超声裂解收集诱导的菌体沉淀按照蛋白纯化试剂盒说明书进行纯化。将纯化后的蛋白溶液加入透析袋中,在4 ℃条件下透析,每6 ~8 h 更换1 次透析液,透析液中尿素的浓度依次为6、4、2、1、0 mol/L,测定透析后的蛋白浓度。
1.5 重组蛋白的Western blot 鉴定
将纯化后的重组蛋白HBc-VP6 进行SDS-PAGE电泳后将蛋白转移至NC 膜上,5%脱脂牛奶4 ℃封闭过夜,用1∶500 稀释的BRV 阳性血清室温孵育2 h,PBST 洗涤3 次。加入1∶10 000 稀释的HRP兔抗牛IgG 室温孵育2 h,PBST 洗涤3 次。使用DAB 显色液显色。
1.6 透射电镜成像
复性后的目的蛋白送至河北师范大学分析测试中心进行透射电镜成像实验,观察病毒样颗粒的形成情况。
1.7 小鼠免疫验证
将24 只6 ~8 周龄的BALB/c 小鼠随机平均分成3 组。即HBc-VP6 组、VP6 组和PBS 组。于第0 天将HBc-VP6 重组蛋白和VP6 重组蛋白分别与完全弗氏佐剂1∶1 混匀乳化后进行背部皮下多点注射。HBc-VP6 组接种50 μg/只的HBc-VP6 重组蛋白;VP6 组接种50 μg/只的VP6 重组蛋白;PBS 组接种等量的PBS。在第14、28 天将HBc-VP6 重组蛋白和VP6 重组蛋白分别与不完全弗氏佐剂1∶1 混匀乳化后按照首次的免疫剂量和方式对各组小鼠进行免疫。于首免后第7、14、21、28、35、42、49 天进行尾静脉采血。室温放置1 h 后,4 ℃静置过夜,3 000 r/min 离心10 min,收集血清存放于-20 ℃。
1.8 ELISA 检测
通过间接ELISA 检测血清中抗BRV 的特异性IgG 抗体。将纯化的HBc-VP6 蛋白稀释至2 μg/mL作为包被抗原,包被96 孔培养板,每孔100 μL,37 ℃孵育1 h,4 ℃孵育过夜。PBST 洗涤3 次,以1∶200 稀释的血清为一抗,以HRP 标记的山羊抗小鼠IgG 为二抗,以TMB 底物显色液显色,多功能酶标仪检测OD450值。
1.9 细胞因子检测
采用商业化细胞因子ELISA 试剂盒,检测待测血清中细胞因子IL-4 的质量浓度。标准孔各加不同浓度的标准品各50 μL,待测样品孔中先加样品稀释液40 μL,然后加待测样品10 μL,轻轻晃动混匀后每孔加入酶标试剂100 μL,用封板膜封板后置37 ℃温育60 min。弃去液体,甩干,每孔加满稀释后的洗涤液,静置30 s 后弃去,重复洗涤5 次,拍干。每孔加入显色剂A 50 μL,再加入显色剂B 50 μL,轻轻振荡混匀,37 ℃避光显色15 min,每孔加50 μL 终止液终止反应,450 nm 波长测量各孔的吸光度(OD 值)。以标准物的浓度为横坐标,OD 值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD 值由标准曲线查出相应的浓度,再乘以稀释倍数,即为样品的实际浓度。
采用商业化细胞因子ELISA 试剂盒,检测待测血清中IFN-γ 的质量浓度。具体操作参照细胞因子IL-4 的质量浓度的操作方法并结合小鼠γ 干扰素酶联免疫分析试剂盒说明书进行检测。
1.10 数据分析
应用GraphPad Prism8.0.1 软件进行作图与数据分析,采用t检验进行差异显著性分析,P<0.05 认为具有生物统计学意义。
2 结果与分析
2.1 重组质粒的鉴定
重组表达质粒pET32a-HBcAg-VP6经EcoRⅠ、XhoⅠ双酶切后得到5 900 bp(载体)和1 014 bp(目的基因)2 条条带(图1),说明重组的HBcAg-VP6基因已成功插入到pET32a 载体中。

图1 重组质粒pET32a- HBcAg-VP6 的酶切鉴定Fig.1 Identification of pET32a-HBcAg-VP6 by enzyme digestion
2.2 重组蛋白的纯化与复性
超声裂解后收集的上清和沉淀进行SDS-PAGE 检测,结果显示重组蛋白HBc-VP6主要存在于包涵体中(见图2)。纯化并复性后的重组蛋白HBc-VP6 经SDSPAGE 检测可见仅在57 kD 左右的单一条带(见图3),经BandScan 软件分析蛋白纯度可达80%以上,经浓缩后重组蛋白HBc-VP6 的质量浓度为0.54 mg/mL。

图2 重组蛋白的可溶性检测Fig.2 Soluble detection of recombinant protein

图3 HBc-VP6 蛋白纯化的SDS-PAGE 分析Fig.3 SDS-PAGE analysis of HBc-VP6 protein purification
2.3 目的蛋白的Western blot 检测
Western blot 检测结果显示,纯化复性后的蛋白HBc-VP6 在约57 kD 处出现单一的条带(图4),说明其可以和BRV 阳性血清发生良好的反应。

图4 HBc-VP6 蛋白Western-blot 分析Fig.4 Western-blot analysis of HBc-VP6 protein
2.4 透射电镜检测重组蛋白HBc-VP6
纯化复性后的重组蛋白在透射电子显微镜下呈现病毒样颗粒结构(图5),表明VP6 蛋白与HBc蛋白融合表达后,HBc-VP6 重组蛋白能自我折叠装配成病毒样颗粒结构。

图5 透射电镜检测HBc-VP6 重组蛋白病毒样颗粒结构Fig.5 Observation of virus-like particles of HBc-VP6 recombinant protein by negative-stain TEM
2.5 特异性抗体的ELISA 检测
ELISA 结果显示,重组蛋白HBc-VP6 和VP6首次免疫后第14 天加强免疫,产生的抗BRV 特异性抗体水平明显升高(图6)。首次免疫后第14天HBc-VP6 和VP6 抗体水平显著高于PBS 组(P<0.01)。首次免疫后第21 天HBc-VP6 组产生的抗体水平显著高于另外两组(P<0.01)。在整个过程中,HBc-VP6 组的抗体水平较高,PBS 组并未检测到抗BRV 特异性抗体。

图6 免疫后小鼠血清中BRV 特异性抗体IgG 的检测Fig.6 Detection of BRV specific antibody IgG in serum of immunized mice
2.6 细胞因子的检测
为了进一步检测小鼠产生的免疫应答的类型和水平,本研究检测免疫小鼠血清中Th1 型(IFN-γ)和Th2 型(IL-4)细胞因子的质量浓度。结果表明HBc-VP6 组和VP6 组产生的IL-4 水平显著高于PBS 组(P<0.01)。首免后第7 天HBc-VP6 组产生的IL-4 水平高于VP6 组和PBS 组(P<0.05)。首免后第21 天HBc-VP6 组产生的IL-4 水平显著高于VP6 组(P<0.01)。首免后第28 天VP6 组产生的IL-4 水平显著高于PBS 组(见图7)。
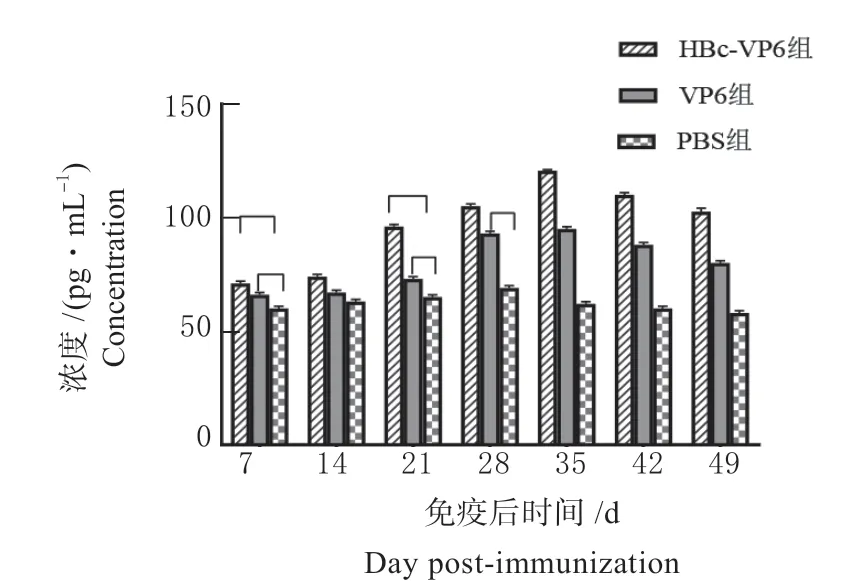
图7 免疫后小鼠血清细胞因子IL-4 的检测Fig.7 Detection of serum cytokines IL-4 in mice after immunization
细胞因子IFN-γ 检测结果表明(见图8),首免后第7 天HBc-VP6 组和VP6 组产生的IFN-γ 水平显著高于PBS 组(P<0.05),首免后第14 天HBc-VP6 组和VP6 组产生的IFN-γ 水平极显著高于PBS 组(P<0.01),但HBc-VP6 组和VP6 组产生的IFN-γ 水平无明显差异。

图8 免疫后小鼠血清细胞因子IFN-γ 的检测Fig.8 Detection of serum cytokines IFN-γ in mice after immunization
3 结论与讨论
犊牛腹泻是养牛场饲养管理过程中面临的最主要的奶牛健康问题之一,而牛轮状病毒是引起犊牛腹泻最主要同时也是发生率最高的病原,7 日龄以内犊牛最为易感[12-13]。因此用疫苗接种预防BRV感染就成为犊牛腹泻防控的关键环节。VP6 蛋白作为决定轮状病毒分组的特异性抗原有较强的免疫原性,是轮状病毒感染血清抗体检测重要的候选抗原[14]。VP6 蛋白作为RV 共同亚组的抗原蛋白,在原核表达系统中VP6 表达效率高,可作为重组亚单位疫苗抵抗不同基因型RV 的感染[15]。故本研究将VP6 蛋白插入到HBcAg 的免疫显性区的基因中,使其在大肠杆菌BL21 中表达融合蛋白HBc-VP6,并通过Western blot 对所表达的融合蛋白进行鉴定。同时在小鼠模型中检测了重组抗原的免疫原性和产生的免疫反应类型。
BRV 引起的腹泻在新生犊牛最为常见,新生犊牛的保护机制主要是由泌乳免疫介导的,哺乳初期犊牛主要通过母乳获得抗体,犊牛从母乳中获取的BRV 特异性抗体IgG 在预防全身性感染中承担重要作用[16-18]。本研究结果表明,最终检测的HBc-VP6 组和VP6 组均能产生抗BRV 的特异性抗体IgG,且抗体水平显著高于PBS 对照组(P<0.01),同时HBc-VP6 组产生的抗体水平显著高于VP6 组,说明HBcAg 与外源基因VP6融合表达后,其自发组装成的HBc-VLPs 不仅其本身具有较强的免疫原性,且相连后可与外源基因VP6增强外源基因的免疫原性。
IFN-γ 由Th1 型细胞分泌,在机体产生的细胞免疫过程中承担重要的作用。IL-4 由Th2 型细胞产生,促进B 淋巴细胞的增殖和分化,在机体的体液免疫反应中承担重要作用。为探讨重组抗原HBc-VP6 诱导的免疫反应类型,本研究检测了免疫小鼠血清中IFN-γ 和IL-4 的水平,结果显示,HBc-VP6 组和VP6 组小鼠在免疫后第7 天既产生IFN-γ,同时也产生IL-4,且分泌水平显著高于PBS 组(P<0.01),这表明重组抗原能够促进Th1 型和Th2 型细胞免疫反应,间接表明HBc-VP6 能同时促进细胞免疫和体液免疫反应。
