牛HoxC9 基因CDS 区克隆及表达谱分析
2021-07-24高晓茜雷召雄汪书哲杨梦丽
高晓茜,雷召雄,唐 林,汪书哲,杨梦丽,马 云
(宁夏大学 农学院/宁夏回族自治区反刍动物分子细胞育种重点实验室,宁夏 银川 750021)
牛肉肉质鲜美,富含矿物质、维生素、多种氨基酸和脂肪酸等营养成分,在人们日常膳食中占有重要地位。随着生活水平的提高,消费者对高质量牛肉需求增加。肌内脂肪含量直接影响牛肉品质,提高肌内脂肪含量,可增加牛肉的大理石花纹,提高肉的嫩度,从而提升肉的色泽和风味[1]。前期研究表明,肌内脂肪含量除了受环境和营养水平等因素影响外,更多取决于基因的控制[2]。HoxC9基因(Homeobox C9)作为Hox同源异型盒家族成员之一,可提供细胞在前后轴上的特定位置识别信息,在脊椎动物胚胎肢体发育过程中具有重要调节作用[3]。发育基因是脂肪分布和脂肪组织功能的重要调节剂,且越来越多的研究证明,HoxC9基因是调控脂肪组织的重要因子,在白色脂肪组织中特异性表达[4]。因此,HoxC9基因在脂肪组织形成过程中具有重要功能。目前经过测序发现,各物种的HoxC9基因长度、外显子数目、编码区长度、表达区域都有一定的差异,但关于牛HoxC9基因的表达模式以及功能研究尚未见报导。本研究旨在通过克隆获得牛HoxC9基因的CDS 区序列,分析其序列特征,检测该基因在牛7 种组织中以及脂肪细胞分化过程中的表达水平,为进一步揭示其功能提供基础数据。
1 材料与方法
1.1 样品采集
于宁夏农垦贺兰山牛羊产业(集团)有限公司采集3 头成年健康的2 岁干奶期荷斯坦牛心、肝、脾、肺、肾、肌肉和背部脂肪组织,样品采集方法参见文献[5]。
1.2 主要试剂
pMD-18T 载体购自Takara(大连);胶回收试剂盒、无内毒素质粒小量提取试剂盒II 购自Omega Bio-Tek(广州);DH5α 感受态细胞购自北京索莱宝科技有限公司;DMEM 高糖培养基购自海克隆生物化学制品(北京)有限公司;胎牛血清购自赛默飞世尔科技(中国)有限公司;IBMX、地塞米松以及罗格列酮均购自Sigma 公司。
1.3 牛HoxC9 基因重组质粒构建
提取总RNA(组织样和细胞样),酶标仪检测总RNA 的质量及浓度,根据反转录试剂盒将总RNA 反转录成cDNA,保存于-20 ℃冰箱。根据GenBank(登录号:XM_002687231.6)上公布的牛HoxC9序列,以肝脏组织cDNA(原液)为模板进行基因克隆,扩增体系参照文献[7],引物信息见表1。扩增条件为:预变性3 min (95 ℃),变性30 s (95 ℃),复性30 s (59 ℃),退火54 s(72 ℃),35 个循环,延伸5 min (95 ℃)。将PCR产物用1%琼脂糖凝胶电泳检测,回收纯化后连接于pMD18-T 载体,转入DH5α 感受态细胞,选取阳性菌液送往通用生物系统(安徽)股份有限公司测序。

表1 引物信息Table 1 Primer sequences
1.4 牛HoxC9 基因生物信息学分析
通过NCBI 中的BLAST 模块将克隆所得的牛HoxC9基因序列进行同源性比对,运用在线工具ProtPram (https://web.expasy.or g/protparam/) 分析HoxC9 的蛋白质理化性质;ProtScal (https://web.expasy.or g/protscale/) 分析蛋白质的亲疏水性;TMpred (https://embnet.vi-tal-it.ch/software/TMPRED_form.html)预测蛋白质跨膜区和跨膜方向;NetPhos 3.1 Server (http://www.cbs.dtu.dk/services/NetPhos/)预测HoxC9中潜在的磷酸化位点;SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html) 分析HoxC9 蛋白的二级结构;SWISSMODEL (https://www.swissmodel.expasy.or g/)分析HoxC9 蛋白的三级空间构型。
1.5 牛HoxC9 组织表达谱检测
以组织样cDNA(原液稀释10 倍)为模板,以GAPDH 为内参基因,利用Touch down PCR 进行qPCR,反应体系参照文献[5]。每个待测样品设置3 个重复,反应程序为:95 ℃ 3 min;95 ℃ 10 s,62 ℃ 30 s,72 ℃ 32 s,35 个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
1.6 原代脂肪细胞的分离培养与诱导分化
脂肪细胞的分离、培养、传代、冻存、诱导分化方法参照文献[6-7]。
1.7 油红O 染色
油红O 染色方法参照文献[8]。
1.8 牛HoxC9 时序表达谱检测
以GAPDH 为内参基因,qPCR 检测HoxC9以及成脂标志基因PPARγ 在脂肪细胞分化0、2、4、6、8、10 d 时的表达水平,反应体系同1.5。
1.9 数据分析
运用2-ΔΔCT法对实验数据进行分析,SPSS 22.0软件对HoxC9表达量进行单因素方差(one-way ANOVA)分析、LDS 法多重比较分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 牛HoxC9 基因克隆
PCR 扩增得到牛HoxC9基因预测长度为968 bp(图1A),通过测序后分析发现其CDS 区长度为783 bp。Chromas 软件分析测序结果,发现均为单一峰。利用DNAMAN 软件将克隆得到的HoxC9序列与NCBI 已有序列进行比对,相似度高达99.82%(图1B),表明克隆所获得序列是牛HoxC9基因CDS 区。

图1 牛HoxC9 基因克隆结果与序列比对Fig.1 Analysis of the cloning results of HoxC9 gene of bovine
2.2 牛HoxC9 蛋白理化性质分析
通过与其他物种进行同源性比对发现,牛HoxC9基因在哺乳动物体内具有较高同源性,其中与山羊(Capra hircus)同源性最高为99.62%、马(Equus caballus) 97.83%、 大猩猩(Gorilla gorilla gorilla)97.57%、人类(Homo sapiens)97.57%、兔(Oryctolagus cuniculus) 97.19%、 小鼠(Mus musculus)96.55%。利用BioEdit 软件分析得知牛HoxC9共编码260 个氨基酸(见表2)。ProtScale 在线软件预测发现组成该基因的氨基酸中亲水性残基占比较大(图2A);ProtParam 的分析结果表明该蛋白为不稳定蛋白,具有一定亲水性;TMHMM 2.0 Server v. 分析发现该基因的编码产物存在0 个跨膜螺旋 (TMHs)结构(图2B);此外,TMpred 分析结果表明,HoxC9 蛋白在6 ~754 位氨基酸之间有18 个由膜内向膜外的跨膜氨基酸,在1 ~754 位氨基酸之间有19 个由膜外向膜内的跨膜氨基酸(图2C)。NetPhos 3.1 Server 预测HoxC9中存在4 处潜在的磷酸化位点, 包括Thr7、Ser8、Tyr19、Tyr23(图2D)。

表2 HoxC9 的氨基酸组成Table 2 Composition of amino acid of HoxC9

图2 牛HoxC9 蛋白质理化性质分析Fig.2 Physicochemical property analysis and prediction of protein structure of bovine HoxC9
2.3 牛HoxC9 蛋白质结构的预测
SOPMA 预测发现牛HoxC9 蛋白序列的二级结构主要为无规则卷曲(Random coil,紫色短竖线区)和α- 螺旋(Alpha helix,蓝色长竖线区),分别占比65.77%、23.46%;延伸链(Extended strand,红色中竖线区) 和β- 转角(Beta turn,绿色中竖线区)仅占7.31%、3.46%(图3A)。进一步通过SWISSMOD-EL 预测HoxC9 的三级结构(图3B),结果表明该蛋白质大部分是由无规则卷曲和α-螺旋构成,与二级结构预测结果一致。
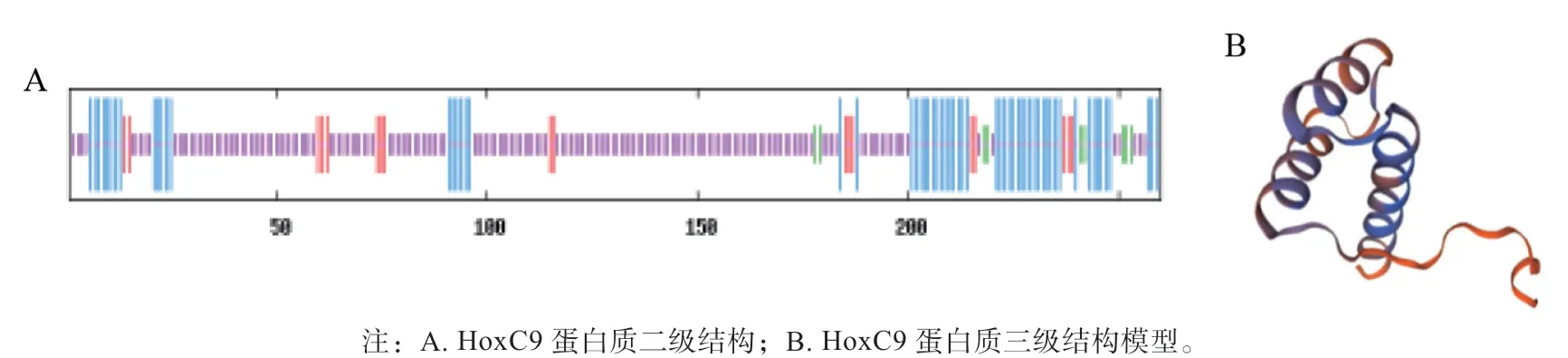
图3 牛HoxC9 蛋白质结构预测结果Fig.3 Prediction of protein structure of bovine HoxC9
2.3 消化法分离培养牛原代脂肪细胞
牛原代脂肪细胞消化分离培养第3 天可观察到部分脂肪细胞贴壁(图4A),培养到第5 天细胞密度达到90%以上(图4B),随即将细胞消化传代,待细胞密度再次生长至90%以上时,再次将细胞消化传代,部分细胞用于后续诱导分化试验,部分细胞冻存以备后续使用。
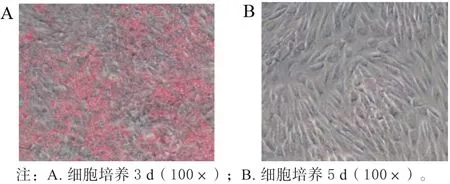
图4 消化分离法培养牛原代脂肪细胞Fig.4 Digestion method for culture of bovine primary preadipocytes
2.4 牛原代脂肪细胞诱导分化
油红O 结果显示,诱导分化组(图5A)相比对照组(图5B)脂滴增多。PPARγ的表达量自诱导2 d 起始终高于对照;在第4 天达到最高,极显著高于对照组(P<0.01);从第6 天开始,PPARγ的表达量逐渐降低(图5C)。这表明原代脂肪细胞的诱导分化成功,分离的原代细胞可用后续试验。
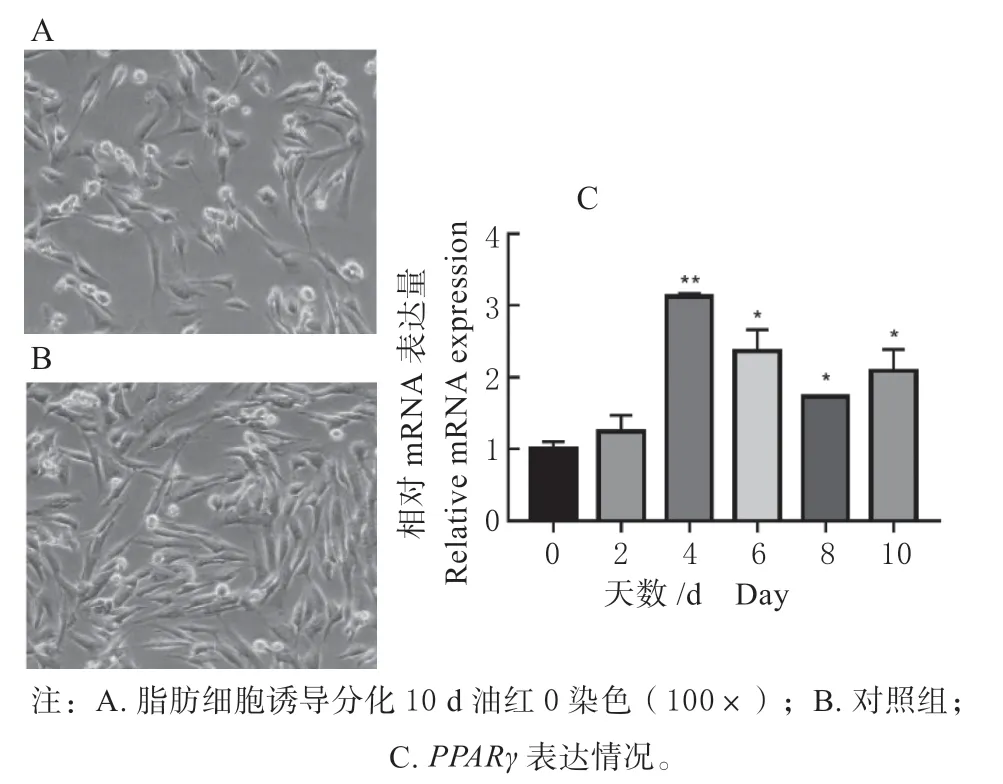
图5 牛原代脂肪细胞诱导分化Fig.5 Induced differentiation of bovine preadipocytes
2.5 牛HoxC9 表达谱检测
qPCR 技术检测结果显示,HoxC9在牛背脂中表达量最高,在背脂、脾中的表达量极显著高于肌肉、心、肾、肺、肝(P<0.01);在肺中的表达水平显著高于肝、肾(P<0.05);在肌肉和心表达量较低,且两者之间存在极显著差异(P<0.01)(图6A)。以0 d 为对照,通过qPCR 检测HoxC9在牛前体脂肪细胞分化过程中的表达模式发现,HoxC9与PPARγ的表达模式一致,呈现先上升后降低的趋势。HoxC9的表达量在第4 天时显著高于对照(P<0.05);从第6天开始,HoxC9的表达量逐渐降低,第8 天时表达量达到最低,显著低于对照(P<0.05)(图6B)。

图6 HoxC9 在牛组织(A)和牛原代脂肪细胞分化过程(B)中的表达情况Fig.6 Expression of HoxC9 in tissues and preadipocyte differentiation of bovine
3 讨论与结论
同源异型盒(homeobox,HOX)基因家族是一个广泛存在于各种真核生物体、在进化上高度保守的家族,所表达的蛋白是一组转录因子[9],参与胚胎发育、细胞分化、细胞迁移和细胞凋亡等多种细胞生物学过程的调控[10-12]。牛HoxC9 的氨基酸中亲水性残基占比较大,共有37 个跨膜氨基酸,存在4 处潜在的磷酸化位点。研究报道,大部分蛋白可通过磷酸化与去磷酸化的方式来实现核质穿梭等亚细胞定位的改变[13],因此HoxC9 蛋白是一种能核质转位的亲水性蛋白。牛HoxC9 具有3 个螺旋和3个转角,形成了螺旋-转角-螺旋(HTH)功能区域。研究表明,Hox基因家族每个成员都具有一个由61个氨基酸组成的同源结构域,即HTH 功能区域,HTH 结构域与DNA 特异核苷酸序列相结合,可实现基因对下游靶基因的调控[14]。通过与其他物种同源性比对发现,牛HoxC9与山羊、小鼠等哺乳类动物的同源性高达96%以上,如果蛋白质功能类似,那么可以将小鼠作为模式动物,进一步探索HoxC9在脂肪代谢中的调控作用。
研究发现,HoxC9在腹股沟、腋下等皮下白色脂肪及附睾旁、肠系膜周围、肾周等内脏白色脂肪中高表达[16]。本研究发现HoxC9在牛背脂中的表达量相比其他组织最高,这与现有研究结果一致。此外,通过将低脂饮食(CD)和高脂饮食(HFD)条件下的雄性、雌性ATHoxC9-/-小鼠(Fabp4-Cre介导的HoxC9敲除小鼠)与同窝仔对照研究发现,HoxC9的表达量与体脂变化成正相关[17];运动训练后,HoxC9表达量随体脂的减少而降低[18]。值得注意的是,随着诱导分化时间的推移,HoxC9的表达量在第4 天达到最高,第8 天时表达量达到最低且显著低于0 d。虽然HoxC9与PPARγ的表达模式均呈现先升高后下降的趋势,但自诱导2 d 后,PPARγ的表达量始终高于0 d。现有研究结果表明,在采用corylin 诱导白色脂肪褐变过程中,HoxC9表达量显著升高[19];有研究报道,将处于寒冷工作环境的健康矿工与生活在热中性条件下的健康受试者进行比较,前者外周血单个核细胞(PBMC)中HoxC9的表达量显著高于后者[20]。因此推测本研究中所存在的HoxC9与PPARγ表达模式的差异,可能是由于环境因素的影响使牛背脂在诱导分化过程中发生了褐变。HoxC9在白色脂肪的生成与分化中有特定的功能,但作用机制仍不明确。
本研究成功克隆牛HoxC9基因 CDS 序列(GenBank 登录号:XM_002687231),长度为783 bp,编码260 个氨基酸。利用生物信息学分析发现 HoxC9蛋白是一种可发生核质穿梭、磷酸化/去磷酸化的亲水性蛋白。HoxC9基因的表达量在牛背脂中较高,在脂肪细胞分化过程中呈现先升高后下降的变化趋势。本研究提示HoxC9基因可能参与脂肪的生成与分化过程,结果可为后续研究提供基础资料。
