黄曲霉毒素B1检测与脱毒方法最新研究进展
2021-07-23孙统政王娜田俊杨坤龙
孙统政 王娜 田俊 杨坤龙

摘要: 食品和谷物中的黄曲霉毒素污染在全球范围内造成了严重的经济和健康问题。黄曲霉毒素B1(AFB1)具有极强的致突变性和毒性,并且对人类和牲畜均具有强致癌性。有关毒素的脱毒技术一直是国内外的一个研究热点,其中物理法、化学法和生物法脱毒是主要的脱毒方法。本文结合最新的研究成果, 详细介绍了黄曲霉毒素B1的毒性及主要的检测方法,对黄曲霉毒素物理、化学、生物脱毒方法进行了概述。
关键词: 黄曲霉毒素B1;检测方法;脱毒方法
中图分类号: TS201.3 文献标识码: A 文章编号: 1000-4440(2021)03-0789-11
Research progress of aflatoxin B1 detection and detoxification methods
SUN Tong-zheng, WANG Na, TIAN Jun, YANG Kun-long
(School of Life Sciences, Jiangsu Normal University, Xuzhou 221116, China)
Abstract: Aflatoxin contamination in foods and grains poses serious economic and health problems worldwide. Aflatoxin B1 (AFB1) is extremely mutagenic and toxic, and is highly carcinogenic to humans and livestock. The detoxification technology for toxins has always been a research hotspot at home and abroad. Among them, physical, chemical and biological detoxification are main detoxification methods. Based on the latest research results, this article introduced the toxicity and main detection methods of aflatoxin B1 in detail and summarized physical, chemical and biological detoxification methods for aflatoxin.
Key words: aflatoxin B1;detection method;detoxification method
黃曲霉菌(Aspergillus flauvs)是一种世界范围常见的许多重要农作物以及动物的共同致病菌。黄曲霉菌产生的次级代谢产物黄曲霉毒素B1(AFB1)是目前发现毒性和致癌性最强的天然化合物之一[1]。黄曲霉菌能够感染许多重要的农作物,例如,花生、玉米、棉花等,均可对收获前后的农作物进行污染,给世界各地的农业生产造成巨大的经济损失。根据联合国粮农组织统计,每年约有25%的谷物被真菌毒素污染,其中最主要的就是黄曲霉毒素,给农业造成了巨大经济损失[2]。中国同样是黄曲霉毒素污染的重灾区,多个省份储存的玉米和花生中都检测到了黄曲霉毒素的污染[3-4],此外,在多个抽样的酱油以及水产饲料等加工产品中都检出AFB1 [5-6]。由于黄曲霉毒素B1具有较稳定的理化性质,很难被降解,一旦污染的饲料被禽畜食用,AFB1将在动物体内经羟基化代谢形成和AFB1毒性和致癌性基本相似的衍生物AFM1,一部分的AFB1的衍生物会随尿液和乳汁排出,而很大一部分会出现在奶制品和肉制品中。
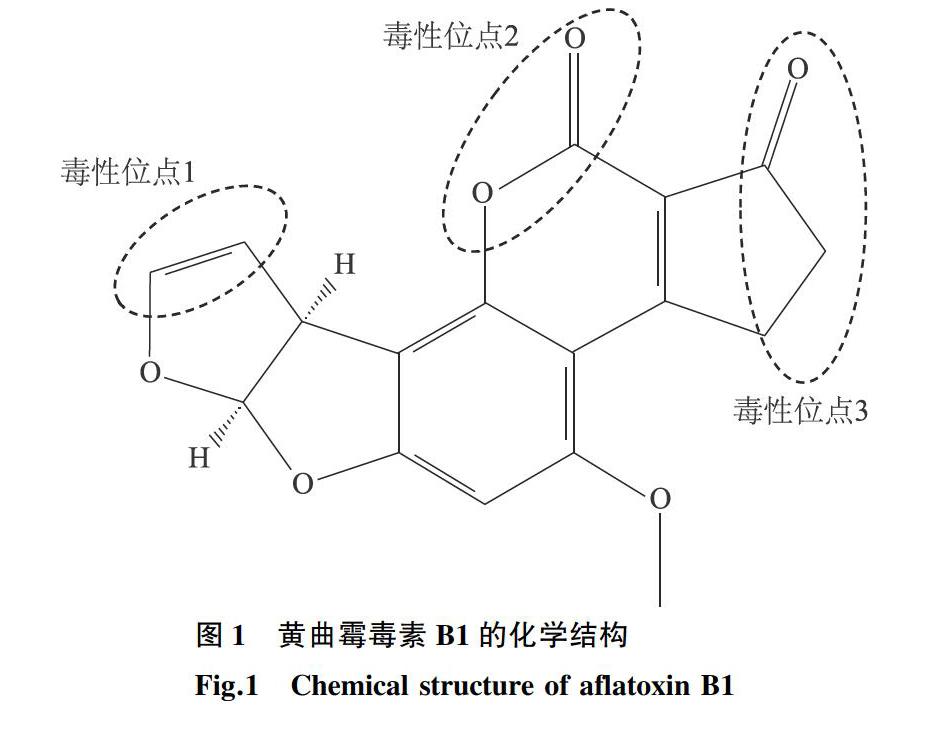
黄曲霉毒素具有较强的毒性、诱变性及致癌性[7]。AFB1是二氢呋喃氧杂萘邻酮的衍生物,含有一个双呋喃环和一个氧杂萘邻酮[8],见图1。AFB1结构中存在3个毒性位点:①呋喃环上的 8、9 位双键, 是毒素与蛋白质和核酸形成复合物的作用位点, 为基因突变以及致癌致畸的主要功能基团;②内酯环部分的 10、11、15 号位点, 易受到水解作用, 因此是较活跃的毒素降解位点;③环戊烯酮环上的 1、2、3、14 号位, 该位点易被取代基团取代, 从而也决定了黄曲霉毒素的毒性。黄曲霉毒素的污染给农牧业生产带来重大的经济损失,并严重危害人类健康和食品安全,目前世界卫生组织已将其认定为1A类致癌物,2017年中国农业农村部也将农产品中黄曲霉毒素的控制技术作为农业主推技术之一。因此,研究AFB1的脱毒技术变得尤为重要。
1 黄曲霉毒素B1毒性概述
1.1 AFB1对人类和动物的毒性作用
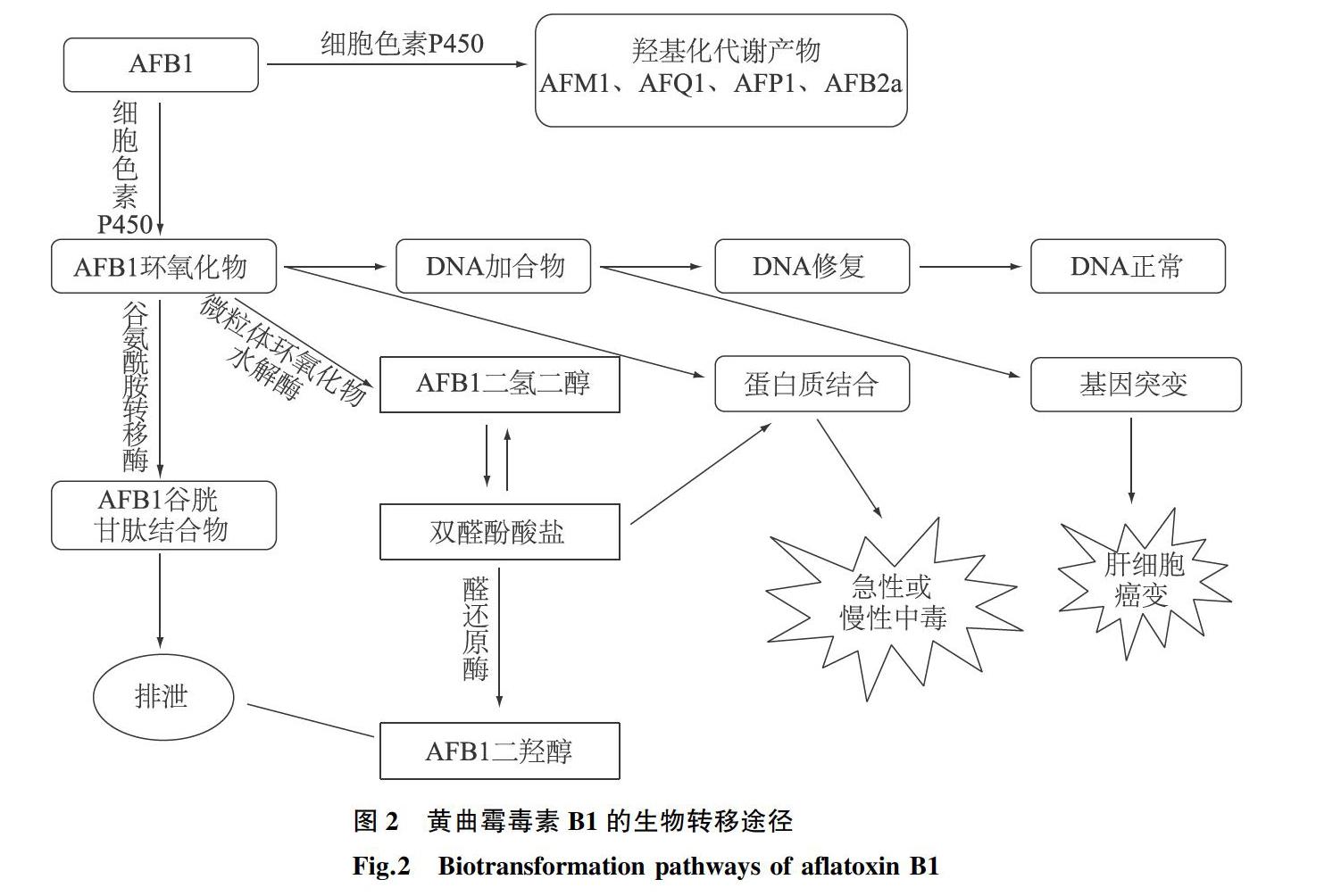
AFB1对人类和几种动物有剧毒,并具有3个主要特征:亲有机性、遗传毒性和致癌性。它主要对有机体的肝脏亲和并产生损害,例如肝出血和肝细胞坏死[9]。遗传毒性主要是诱导AFB1-DNA加合物的形成和代谢形成ABF1环氧化物(ABFO)引起p53基因的热点突变。虽然部分AFBO会在谷氨酰胺转移酶作用下生成AFB1谷胱氨肽结合物或生成AFB1二氢二醇进一步在醛还原酶作用下生成AFB1二羟醇经肾脏排泄出机体,但是剩下的大部分AFB1仍然会损害机体,例如诱导DNA损伤进而引起肝细胞癌变[7]。临床调查发现,AFB1是乙型肝炎病毒感染患者患肝癌的主要原因。它是一种遗传毒性肝癌,AFB1通过诱导形成DNA加合物引起癌症,从而导致靶细胞发生遗传变化,诱导DNA链断裂和DNA碱基损伤。氧化损伤最终会导致癌症。AFB1主要通过肝脏代谢,从食物中摄取的AFB1主要通过细胞色素P450酶代谢为最终致癌物AFB1-8-9-环氧化合物(AFBO)。当AFBO与DNA反应时,它通过与鸟嘌呤碱基相互作用而抑制p53(外显子249的热点编码区)中的基因突变,这可能会导致肝细胞癌变。AFB1通过P450系统代谢为许多羟基化产物,包括AFM1、AFQ1、AFP1、AFB2a [7]。黄曲霉毒素被摄入人体后,主要的中毒表现为急性中毒和慢性中毒,急性中毒发作通常由于高浓度的黄曲霉毒素摄入。AFB1在人体中的转化途径如图2所示。
1.2 AFB1对儿童生长发育的影响
生长障碍或发育迟缓是一个重大的公共卫生问题,影响到全世界数以百万计的儿童,特别是在发展中国家。一项对125名肯尼亚孕妇的调查结果表明,有53%的孕妇血液中黄曲霉毒素生物标志物为阳性,而脐带血中标志物阳性率为37%,研究还发现黄曲霉毒素阳性的孕妇生产的新生儿体质量明显降低,另外,研究期间发生的2个死胎仅来自AFB1阳性孕妇[10]。Gong等[11]发现研究地区的479名儿童中有99%的儿童为AFB1-白蛋白阳性,断奶后儿童阳性水平更高,此外,发育不良的儿童的AFB1-白蛋白水平与身高和体质量之间呈显著负相关,断奶的儿童中AFB1-白蛋白水平高于仍在接受母乳的孩子(断奶后饮食主要以玉米为主),AFB1-白蛋白水平较高的儿童身高平均下降了1.7 cm。这些研究结果表明,胎儿和新生儿暴露于AFB1会对身体生长有显著影响,尤其在断奶后阶段。
1.3 免疫抑制
动物中的研究结果显示AFB1具有诱导免疫抑制的作用。例如,在暴露于AFB1的动物模型中发现,B细胞和T细胞的活性降低了,T细胞对AFB1毒性更敏感[12]。在黄曲霉菌引起的曲霉病中,鸡的吞噬细胞受到严重破坏,从循环中清除异物的能力下降,这可能会降低加工抗原成分的能力[13]。同样在暴露于AFB1的猪体内,AFB1会降低淋巴细胞对有丝分裂原的反应,抑制大噬菌体迁移并延迟皮肤过敏反应[13]。尽管从动物研究中获得了许多有关AFB1影响免疫作用的数据,但是关于长期食用被AFB1污染的食物对人体免疫系统影响的数据很少。冈比亚儿童唾液中sIgA水平降低,可能是由于饮食中黄曲霉毒素的暴露水平较高[14]。在对64位加纳人的研究中,发现AFB1暴露可能导致淋巴细胞亚群的主要成分T细胞和B细胞减少,与低水平的AFB1白蛋白加合物相比,高水平的AFB1白蛋白加合物能显著降低CD8+细胞毒性T细胞中穿孔素和颗粒酶a水平[15]。在AFB1水平高的受试者中,这些免疫参数的改变可能导致细胞免疫功能受损,从而降低宿主对感染的抵抗力。
2 黄曲霉毒素B1检测方法
高效液相色谱法、薄层色谱法和液相色谱质谱法是过去几十年测定AFB1含量的常规分析方法[16],这些分析方法具有很高的灵敏度和良好的重复性,但样品处理繁琐,需要昂贵的仪器和专业人员,很大程度上限制了其在AFB1快速检测和现场筛选中的应用[17]。近年来以适配体和新型纳米材料为基础的检测传感器因具备灵敏度高、检出限低、成本低和操作简单等优势,在AFB1等毒素检测中得到了广泛应用。此外,目前也开发出通过引入基于适配子的不同技术,例如电化学[18]、表面等离子体共振[19]和比色法[20]来检测AFB1。
2.1 双真菌毒素比色生物传感器
比色生物传感器基于浓度信息转换为颜色变化的比色,可用肉眼进行分辨而达到检测目的,具有低成本、便携性、易操作性等优点,已广泛应用于霉菌毒素检测。目前比色测定多集中应用在单一霉菌毒素的检测[21] ,关于同时检测多种霉菌毒素的报道较少。Zhu等[22]开发了一种同时检测双霉菌毒素的生物传感器,首次实现了针对AFB1和赭曲霉毒素(OTA)2种霉菌毒素的双重目标检测。该双霉菌毒素检测的工作原理为:将Fe3O4/GO和TP-GO(TP为百里酚酞,GO为氧化石墨烯)分别与不同的AFB1的半互补链结合,然后加入AFB1适体并组装形成AFB1检测复合体(图3A);同样,Fe3O4 @Au和AuNPs(金纳米颗粒)也与OTA的半互补链和适体结合形成OTA检测复合体(图3B);当AFB1和OTA存在时,因适体和靶标之间的亲和力强于半互补链,两个检测复合体都将解离,磁超螺旋离心分离后,提取上清液进行反应,并根据相应溶液在不同pH值下的颜色变化确定AFB1和OTA的量(图3C)。由于反应条件的不同,两种传感方法互不干扰,甚至可以提供更高的检测效率。双真菌毒素比色生物传感器具有良好的检测性能,线性范围为AFB1 5~250 ng/ml和OTA 0.5~80.0 ng/ml,具有良好的重现性和选择性,在微生物和环境领域具有广阔的应用前景。
2.2 刺激响应型水凝胶生物传感器
由于适配体具有稳定性好、便携性、易于存储和高特异性等特点,DNA /适体交联的DNA聚合物杂化刺激响应水凝胶引起了广泛的关注[23]。Tang等[24]在一项研究中,设计了一种简单的AFB1检测方法,结合了基于适体的靶标刺激反应水凝胶系统的多功能性以及使用电子天平作为读数的便利性,以线性透明质酸接枝的单链DNA复合物作为主链,AFB1适体和聚乙烯亚胺作为交联剂,构建了AFB1靶标响应性双交联水凝胶。铂纳米颗粒(PtNPs)首先被嵌入水凝胶中,AFB1的存在可以提高亲和力与适体结合,并导致适体从水凝胶中释放。通过添加DNA外切酶I(Exo I)可特异性识别并切割AFB1中的适体-适体复合物,导致AFB1释放;AFB1再次与水凝胶反应,导致水凝胶适体再次释放,从而实现目标循环。通过这种方式,水凝胶将崩溃,并使大量的PtNP释放。释放的PtNP与排水装置中的H2O2反应,在内部和外部之间产生压力差,从而排出水,并且水的质量可以通过简单的电子天平准确称量。
该方法已用于花生样品中AFB1的检测[24],在新鲜花生样品中未检测到AFB1,但在发霉的花生样品中检测到约33.16 μg/kg AFB1,AFB1的回收率在91.5%至98.1%之间,结果与AFB1酶联免疫分析试剂盒的检测结果[92.8%至97.7%(LOD:1 μg/kg)]基本一致,证明了使用该传感器检测食品样品中AFB1的可行性。
2.3 新型荧光适配体传感器
近年来,金纳米星(AuNSs)因具有特殊的多支化纳米结构,且有一个易于修饰和固定材料的中心核,应用范围广泛。Zheng等[18]成功地开发了一种新型的适体传感器,用于基于量子点和AuNSs的荧光定量猝灭剂纳米和智能手机光谱读取器的多农药实时定量。Wei等[25]以AuNSs作为荧光猝灭材料,制造了用于AFB1检测的简单新颖的FRET系统。由于适体的荧光标记会影响适体与其靶标的结合亲和力[25-26],因此,将合成羧基荧光素(FAM)标记的具有发夹结构的互补DNA设计为信号探针。AuNSs不仅固定了大量的信号探针,而且由于其特殊的结构和出色的光学性能,还可以用作淬灭材料。FAM标记的发夹结构(HP)与AFB1杂交适体形成双链DNA,发夹结构被打开。当通过Bio-SA特异性结合在AuNSs的表面修饰双鏈DNA时,FAM离AuNSs很远,导致淬灭效率低和荧光强度强。当AFB1存在时,AFB1优先结合适体,导致双链DNA的崩解。FAM标记的HP恢复发夹结构,使FAM接近AuNSs,并降低荧光强度(图4)。新型荧光适配体传感器对玉米样品中AFB1的最低检出限为21.3 pg/ml,证明新型荧光适配体传感器的AFB1检测试验获得满意结果,并且在存在其他高浓度毒素的情况下也表现出良好的选择性。
3 黄曲霉毒素B1脱毒方法
由于食品中黄曲霉毒素的污染对人类健康构成威胁,并造成严重的经济损失,因此开发高效、安全的AFB1脱毒方法具有重要意义。目前对真菌毒素的脱毒主要有2种策略:(1)防止霉菌污染和生长;(2)污染产品脱毒。常用的脱毒方法包括物理方法、化学方法和生物方法。
3.1 物理方法
3.1.1 加热脱毒
从食品中去除AFB1的物理方法最常见的是加热。众所周知,黄曲霉毒素在高温下稳定,因此需要苛刻的加热才能有效地去除黄曲霉毒素。最近的研究结果表明,在150~200 ℃的温度下可以去除大量的AFB1(平均降低79%),同时在高湿度下最为有效[27-28]。该方法的问题是在加热和烘烤完成之后难以确保产品的完整性,从而会限制可以使用的最高温度,可能仅导致部分的AFB1分解。然而,该技术可以容易地以低成本实施,并且可以在2 h或更短时间内实施,从而具有物流优势。
3.1.2 γ射线脱毒 另一种最常用的物理净化方法是γ射线脱毒,可用于花生、谷物和动物饲料等多种食品基质。该技术为用γ射线源(例如60Co)辐照食品,直到获得一定量的电离辐射为止,电离辐射的范围为6~60 kGy。AFB1含量平均降低65%[29]。使用强辐射存在安全问题,可能使实施这项技术变得困难。
3.1.3 吸附剂脱毒 在食品中添加吸附剂也可有效去除AFB1污染。此方法与降解方法不同,它不破坏、不减少食品中AFB1的量。吸附剂与AFB1结合可防止摄入后AFB1被肠道吸收,从而防止AFB1的肝毒性作用。
(1)叶绿素对AFB1的吸附。Simonich等[30]报道了在向受AFB1污染的饲料中添加叶绿素后,大鼠的AFB1-DNA加合物减少了42%,AFB1-白蛋白减少了65%,肿瘤发生率降低了77%。一项使用人类志愿者的研究中也发现,叶绿素可将尿中AFM1水平降低28%,尿中AFB1水平降低41%[31]。这些数据表明,在高风险地区的饮食中添加吸附剂可能有助于减轻AFB1的毒性作用。
(2)氧化磁性石墨烯(MGO)和磁性石墨烯(MrGO)的纳米材料对AFB1的吸附。磁性复合材料的孔径分布均匀,孔连通性好,表面积大,是吸附有机污染物的优秀吸附剂。Ji等[32]研究结果显示,MGO和MrGO都能够在40 min内移除AFB1,对于受污染的油样,MGO将AFB1从16.1 μg/L降低至2.2 μg/L,去除率为86.33%,当吸附剂量为20 mg/ml时最大去除率达到96.4%。磁性复合吸附剂在AFB1脱毒中的应用,可能为食用油工业开发新型复合吸附剂开辟一条新道路。
(3)黏土对AFB1的吸附。与叶绿素相似,黏土可在消化道中结合AFB1并防止肠道吸收AFB1。钙蒙脱土(NovaSil)是目前被证明有效的吸附剂黏土,它可以显著减少AFB1生物标志物的毒性作用[33]。Afriyie-Gyawu等进行了一项长期研究,发现在28周内给大鼠喂食NovaSil含量高达2.0%的饮食后,未观察到NovaSil具有明显的毒性[34]。此外,临床试验也证实,NovaSil不仅能够明显降低参与者的尿AFM1和血清AFB1含量,而且具有较小的副作用[35]。这些结果表明,在饮食中添加NovaSil是降低AFB1毒性的安全有效方法。
3.2 化学方法
3.2.1 山梨酸钾、水合铝硅酸钠钙、L-蛋氨酸组合法 山梨酸钾(Sor)是一种有效的食品防腐剂,用于控制各种加工食品中霉菌的生长[36]。蛋氨酸(LM)是一种必需氨基酸,作为谷胱甘肽前体,可消除活性氧和DNA甲基化反应[37]。目前研究发现蛋氨酸有助于抗体的产生并改善血清中IgG水平[38]。因此,在AFB1污染的饮食中添加蛋氨酸可降低AFB1对动物的危害[39]。水合硅铝酸钠钙(Hsc)是一种化学吸附性物质,可以与AFB1形成稳定而牢固的复合物,以减少动物在消化和利用饲料过程中AFB1造成的不良影响,并且复合物还可以减弱AFB1对身体器官的毒性[40]。Reda等[41]发现在饲料中添加山梨酸钾(Sor)、水合铝硅酸钠钙(Hsc)和L-蛋氨酸(LM)的混合物能够有效提高兔抗AFB1毒性的能力。
3.2.2 ClO2熏蒸法 二氧化氯(ClO2)是一种具有广泛且稳定的杀生物活性的强氧化剂和消毒剂,被用作水、水果和蔬菜的消毒剂,已经被联合国粮食及农业组织(FAO)分类为的食品添加剂。ClO2能够作用于AFB1毒性和致癌活性的关键活性位点——AFB1呋喃环的C8-C9双键。ClO2将AFB1分解为4种物质:C17H13O8、C16H15O10、C17H15O10和C16H11O7。如图5所示,这4个降解产物的C8-C9双键已被ClO2破坏,从而使经过修饰的AFB1降解产物的毒性大大降低甚至消失[42]。Yu等研究发现,ClO2气体可以抑制黄曲霉菌菌丝生长、孢子萌发和产生AFB1。随着ClO2浓度的增加,AFB1的降解率也随之提高,而且AFB1的降解明显加快[42]。之前的研究者发现氯和次氯酸钠的氯化消毒剂能有效降解食品中的AFB1[43],但是氯处理产生的化学残留物限制了其应用,并且作为液体消毒剂,次氯酸钠不适用于干物质(如谷物)脱毒。
3.2.3 壳聚糖包被α-松油醇法 壳聚糖广泛用于包被生物材料,将某些化合物封装在壳聚糖纳米基质中可以增强其在保护食品中免受微生物污染的功效和稳定性,从而延长其货架寿命[44]。α-松油醇是一种单萜醇,已在食品工业中广泛用作调味剂和熏蒸剂,用来保护食品免受微生物和昆虫的污染。此外它还具有广泛的药理特性,例如抗癌、抗炎和抗氧化[45]。将α-松油醇包被在壳聚糖中制成一种壳聚糖纳米乳液(α-TCsNe),可用作新型抗真菌防腐剂增强α-松油醇的杀菌作用從而抑制AFB1的形成。α-TCsNe的活性增强可能是由于α-松油醇的抗微生物活性与壳聚糖之间的协同作用所致。此外,纳米封装后的小粒径大表面积很容易穿透处理过的细胞,并干扰真菌细胞利用必需化合物,从而致其死亡[46]。该方法经济、方便、无毒、可控、无溶剂,这种方法对操作条件要求低,适用于亲水性和亲脂性化合物,用于配制稳定的纳米乳液[47]。
3.3 生物方法
3.3.1 植物提取物降解 植物精油(EOs)具有显著的抗菌功效,因此作为健康危害性合成防腐剂的替代品具有巨大潜力,但其尚未被食品工业广泛使用。研究发现鸭嘴花和柠檬桉的提取物均有超过95%的AFB1降解率[48]。Yadav等[49-50]发现0.3 μl/ml壳聚糖包被的黑孜然精油可完全抑制黄曲霉菌生长和AFB1产生,壳聚糖包被的肉豆蔻精油在1.25 μl/ml时便可以完全抑制AFB1产生,都具有很强的自由基清除活性。Prakash等对马郁兰、芫荽、草果藥、没药和香水树5种植物提取精油的抑菌、杀菌和对粮食的菌染防护率进行了研究,结果见表1[51]。
3.3.2 益生菌抑制 利用微生物,特别是具有益生菌性质的微生物用于AFB1脱毒,是一种绿色高效、环保、廉价和安全的策略。不同类型的益生菌脱毒方式不同,有的将AFB1改造成其他无毒或低毒的次级产物或异构体,以达到消除食品和饲料中AFB1的目的。最新的益生菌脱毒研究成果如表2所示。Yang等[52]近期研究发现,利用米曲霉菌或者不产黄曲霉毒素的黄曲霉菌突变体可以抑制黄曲霉菌的生长和毒素的合成。Xing等早期也运用黑曲霉菌来拮抗黄曲霉菌,从花生中分离到20株黑曲霉菌,20个黄曲霉毒素生物合成基因中有19个被黑曲霉菌下调[53]。因此,利用不产毒的黄曲霉菌或者安全的曲霉工业用菌可以有效地对产毒黄曲霉菌进行生物防治,可减少产毒黄曲霉菌对许多农产品的侵染及合成毒素,达到提前防控并减少经济损失的作用[54]。
3.3.3 基因水平调控 基因水平调控是指在基因转录或翻译水平上,利用一些综合性方法处理黄曲霉菌,使黄曲霉菌的某些产毒基因被抑制甚至阻断或下调黄曲霉菌生命活动的必须基因,从而限制AFB1合成所必需的蛋白质、酶和化学物质的形成,甚至杀死黄曲霉菌。黄曲霉毒素合成基因簇如图6所示。
Dhanamjayulu等[55]使用苯并咪唑及其衍生物下调黄曲霉菌的AFB1合成基因中的调控基因aflR和结构基因aflB表达,有效抑制AFB1的生物合成,仅10 μg/ml的质量浓度抑制效率便达到了98%,但是并不影响黄曲霉菌的正常生长。Casquete等[56]利用pH、水分活度和温度对2个调节基因(aflR和aflS)和1个结构基因(aflP)表达的进行了研究,结果表明在pH 5.5、水分活度0.95和20~25 ℃时基因具有最高表达水平和AFB1积累量。Xing等[53]利用黑曲霉菌拮抗黄曲霉菌,发现aflS的表达显著下调,导致aflS/AflR比值降低,表明黑曲霉菌可通过降低aflS的丰度而直接抑制AFB1的生物合成。近期,Chen等[57]从Bacillus megaterium中分离出的短肽L-Asp-L-Asn (DN)可以有效抑制黄曲霉菌的生长。
4 结语
黄曲霉毒素B1是目前发现毒性和致癌性最强的天然污染物之一,对人类和动物健康安全存在潜在威胁。因此对黄曲霉菌和黄曲霉毒素的研究也成为近几十年来国内外同行研究的热点。本文主要综述了AFB1的毒性,以及近年来AFB1检测和脱毒方法。由于AFB1的低剂量、高毒特性,开发出更灵敏、更快速、更经济的检测手段是新的趋势和挑战。尽管目前已有多种AFB1脱毒方法,但是每种方法都有各自的优点和缺陷,很难做到既能保障脱毒食品的风味品质,又能确保食品安全。对于黄曲霉毒素的防范应早发现,AFB1一旦进入后期的食品加工链,即使脱毒技术再成熟也会带来健康威胁。因此对黄曲霉毒素的早期检测以及消除其在农作物收获前后的污染对黄曲霉毒素的预防具有重要意义。
参考文献:
[1] 刘 畅,刘 阳,邢福国. 黄曲霉毒素生物学脱毒方法研究进展[J]. 食品科技, 2010, 35(5):290-293.
[2] AMAIKE S, KELLER N P. Aspergillus flavus[J]. Annu Rev Phytopathol, 2011, 49:107-133.
[3] DING N, XING F, LIU X,et al. Variation in fungal microbiome (mycobiome) and aflatoxin in stored in-shell peanuts at four different areas of China[J]. Front Microbiol, 2015, 6:1055.
[4] ZHANG S, WANG H, YANG M, et al. Versicolorin A is a potential indicator of aflatoxin contamination in the granary-stored corn[J]. Food Additives & Contaminants: Part A, 2018,35(5): 972-984.
[5] 张自强,柏 凡,张克英,等. 我国饲料中黄曲霉毒素B1污染的分布规律研究[J]. 中国畜牧杂志, 2009,45(12): 27-30.
[6] 李 江,李晓明,綦 艳,等.酶联免疫法检测酱油中的黄曲霉毒素B1[J].食品安全质量检测学报, 2016, 7(12):4735-4739.
[7] ABRAR M, ANJUM F M, BUTT M S, et al. Aflatoxins: biosynthesis, occurrence, toxicity, and remedies[J]. Crit Rev Food Sci Nutr, 2013, 53 (8): 862-874.
[8] 宋承钢,王彦多,杨 健,等.黄曲霉毒素脱毒研究进展[J].食品安全质量检测报,2020,11(12):3945-3957.
[9] MAGNUSSEN A, PARSI M A. Aflatoxins, hepatocellular carcinoma and public health[J]. World J Gastroenterol. 2013, 19(10):1508-1512.
[10]WALKER A, HALLINGER P. School leadership for learning and change: Progress of an asian agenda[M]//JOHNSON G, DEMPSTER N. Leadership in Diverse Learning Contexts. Cham: Springer International Publishing, 2016:145-171.
[11]GONG Y, HOUNSA A, EGAL S, et al. Postweaning exposure to aflatoxin results in impaired child growth: a longitudinal study in Benin, West Africa[J]. Environ Health Perspect, 2004,112(13): 1334-1338.
[12]WANG F, ZUO Z, CHEN K, et al. Selenium rescues aflatoxin B1-inhibited T cell subsets and cytokine levels in cecal tonsil of chickens[J]. Biol Trace Elem Res, 2019, 188(2): 461-467.
[13]PENG X, ZHANG K, BAI S, et al. Histological lesions, cell cycle arrest, apoptosis and T cell subsets changes of spleen in chicken fed aflatoxin-contaminated corn[J]. Int J Environ Res Public Health, 2014, 11(8):8567-8580.
[14]TURNER P C, MOORE S E, HALL A J, et al. Modification of immune function through exposure to dietary aflatoxin in Gambian children[J]. Environ Health Perspect, 2003, 111(2): 217-220.
[15]SU Q Y. The toxification and detoxification mechanisms of aflatoxin B1 in human: An update[M]//XI D L. Aflatoxin B1 occurrence, detection and toxicological effects. Rijeka: IntechOpen, 2020: 89221.
[16]LI Z B, XUE N, MA H Y, et al. An ultrasensitive and switch-on platform for aflatoxin B1 detection in peanut based on the fluorescence quenching of graphene oxide-gold nanocomposites[J]. Talanta, 2018, 181: 346-351.
[17]ABNOUSA K, DANESH N M, ALIBOLANDI M, et al. A new amplified π-shape electrochemical aptasensor for ultrasensitive detection of aflatoxin B1[J]. Biosens Bioelectron, 2017, 94: 374-379.
[18] ZHENG W L, TENG J, CHENG L, et al. Hetero-enzyme-based two-round signal amplification strategy for trace detection of aflatoxin B1 using an electrochemical aptasensor[J]. Biosens Bioelectron, 2016, 80: 574-581.
[19]YANG M X, LIU G K, CHEN H M, et al. A universal SERS aptasensor based on DTNB labeled GNTs/Ag core-shell nanotriangle and CS-Fe3O4 magnetic-bead trace detection of Aflatoxin B1[J]. Anal Chim Acta, 2017, 986: 122-130.
[20]CHEN J, WEN J, ZHUANG L. An enzyme-free catalytic DNA circuit for amplified detection of aflatoxin B1 using gold nanoparticles as colorimetric indicators[J]. Nanoscale, 2016, 8 (18): 9791-9797.
[21]WANG C, QIAN J, WANG K, et al. Colorimetric aptasensing of ochratoxin A using Au@Fe 3 O 4 nanoparticles as signal indicator and magnetic separator[J]. Biosensors and Bioelectronics, 2016, 77: 1183-1191.
[22]ZHU W, LI L B, ZHOU Z, et al. A colorimetric biosensor for simultaneous ochratoxin A and aflatoxins B1 detection in agricultural products[J]. Food Chemistry, 2020, 319: 126544.
[23]VERMONDEN T, CENSI R, HENNINK W E. Hydrogels for protein delivery[J]. Chem Rev, 2012,112 (5): 2853-2888.
[24]TANG L, HUANG Y, LIN C, et al. Highly sensitive and selective aflatoxin B1 biosensor based on Exonuclease I-catalyzed target recycling amplification and targeted response aptamer-crosslinked hydrogel using electronic balances as a readout[J]. Talanta, 2020, 214: 120862.
[25]WEI M, ZHAO F, XIE Y. A novel gold nanostars-based fluorescent aptasensor for aflatoxin B1 detection[J]. Talanta, 2020, 209: 120599.
[26]LV L, LI D, LIU R, et al. Label-free aptasensor for ochratoxin A detection using SYBR Gold as a probe[J]. Sens Actuators B Chem, 2017, 246: 647-652.
[27]ARZANDEH S, JINAP S. Effect of initial aflatoxin concentration, heating time and roasting temperature on aflatoxin reduction in contaminated peanuts and process optimisation using response surface modelling[J]. Int J Food Sci Technol, 2011, 46: 485-491.
[28]ZHENG H, WEI S, XU Y, et al. Reduction of aflatoxin B1 in peanut meal by extrusion cooking[J]. LWT-Food Science and Technology, 2015, 64(2): 515-519.
[29]MOHAMED N F, EL-DINE R S S, KOTB M A M, et al. Assessing the possible effect of gamma irradiation on the reduction of aflatoxin B1, and on the moisture content in some cereal grains[J]. American Journal of Biomedical Sciences, 2015(7): 33-39.
[30]SIMONICH M T, EGNER P A, ROEBUCK B D, et al. Natural chlorophyll inhibits aflatoxin B 1 -induced multi-organ carcinogenesis in the rat [J]. Carcinogenesis, 2007, 28(6): 1294-1302.
[31]RUSHING B R, SELIM M I. Aflatoxin B1: A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods[J]. Food and Chemical Toxicology, 2019,124: 81-100.
[32]JI J, XIE W. Detoxification of aflatoxin B1 by magnetic graphene composite adsorbents from contaminated oils[J]. Journal of Hazardous Materials, 2020, 381: 120915.
[33]PHILLIPS T D, AFRIYIE-GYAWU E, WILLIAMS J, et al. Reducing human exposure to aflatoxin through the use of clay: A review[J]. Food Additives & Contaminants: Part A, 2008, 25(2): 134-145.
[34]AFRIYIE-GYAWU E, MACKIE J, DASH B, et al. Chronic toxicological evaluation of dietary NovaSil Clay in Sprague-Dawley rats[J]. Food Additives & Contaminants, 2005,22(3): 259-269.
[35]WANG P, AFRIYIE-GYAWU E, TANG Y, et al. NovaSil clay intervention in Ghanaians at high risk for aflatoxicosis: II. Reduction in biomarkers of aflatoxin exposure in blood and urine[J]. Food Additives & Contaminants: Part A, 2008, 25(5): 622-634.
[36]FERRAND C, MARC F, FRITSCH P, et al. Genotoxicity study of reaction products of sorbic acid[J]. Journal of Agriculture and Food Chemistry, 2000, 48(8): 3605-3610.
[37]ALAGAWANY M, ABD E M, ARIF M, et al. Individual and combined effects of crude protein, methionine, and probiotic levels on laying hen productive performance and nitrogen pollution in the manure[J]. Environmental Science and Pollution Research, 2016, 23(22): 22906-22913.
[38]SWAIN B K, JOHRI T S. Effect of supplemental methionine, choline and their combinations on the performance and immune response of broilers[J]. British Poultry Science, 2000, 41(1): 83-88.
[39]ELNESR S S, ELWAN H A M, XU Q Q, et al. Effects of in ovo injection of sulfur‐containing amino acids on heat shock protein 70, corticosterone hormone, antioxidant indices, and lipid profile of newly hatched broiler chicks exposed to heat stress during incubation[J]. Poultry Science, 2019, 98(5): 2290-2298.
[40]SCHEIDELER S E. Effects of various types of aluminosilicates and aflatoxin B1 on aflatoxin toxicity, chick performance, and mineral status[J]. Poultry Science, 1993, 72(2): 282-288.
[41]REDA F M, ISMAIL I E, EL MEKKAWY M M, et al. Dietary supplementation of potassium sorbate, hydrated sodium calcium almuniosilicate and methionine enhances growth, antioxidant status and immunity in growing rabbits exposed to aflatoxin B1 in the diet[J]. Journal of Animal Physiology and Animal Nutrition, 2019,104(1): 196-203.
[42]YU Y, SHI J, XIE B, et al. Detoxification of aflatoxin B1 in corn by chlorine dioxide gas[J]. Food Chemistry, 2020, 328: 127121.
[43]SHI H U, STROSHINE R L, ILELEJI K. Determination of the relative effectiveness of four food additives in degrading aflatoxin in distillers wet grains and condensed distillers solubles[J]. Journal of Food Protection, 2017, 80(1): 90-95.
[44]KUMAR C A, SINGH A, KUMAR S V, et al. Assessment of chitosan biopolymer encapsulated α-Terpineol against fungal, aflatoxin B1 (AFB1) and free radicals mediated deterioration of stored maize and possible mode of action[J]. Food Chemistry, 2020, 311: 126010.
[45]KHALEEL C, TABANCA N, BUCHBAUER G. α-Terpineol, a natural monoterpene: A review of its biological properties[J]. Open Chemistry, 2018, 16(1): 349-361.
[46] MARTNEZ-ABAD A, SNCHEZ G, OCIO M J, et al. CHAPTER 11 polymeric materials containing natural compounds with antibacterial and virucide properties[M]//ALEXANDRA M B, MARíA C, MARTA F G. Polymeric materials with antimicrobial activity: From synthesis to applications. Cambridge: The Royal Society of Chemistry, 2014: 310-326.
[47]HASHEMINEJAD N, KHODAIYAN F, SAFARI M. Improving the antifungal activity of clove essential oil encapsulated by chitosan nanoparticles[J]. Food Chemistry, 2019, 275: 113-122.
[48]VIJAYANANDRAJ S, BRINDA R, KANNAN K, et al. Detoxification of aflatoxin B1 by an aqueous extract from leaves of Adhatoda vasica Nees[J]. Microbiological Research, 2014, 169(4): 294-300.
[49]YADAV A, KUJUR A, KUMAR A, et al. Encapsulation of Bunium persicum essential oil using chitosan nanopolymer: Preparation, characterization, antifungal assessment, and thermal stability[J]. International Journal of Biological Macromolecules, 2020, 142: 172-180.
[50]YADAV A, KUJUR A, KUMAR A, et al. Assessing the preservative efficacy of nanoencapsulated mace essential oil against food borne molds, aflatoxin B1 contamination, and free radical generation[J]. LWT-Food Science and Technology, 2019, 108: 429-436.
[51]PRAKASH B, SINGH P, KEDIA A, et al. Assessment of some essential oils as food preservatives based on antifungal, antiaflatoxin, antioxidant activities and in vivo efficacy in food system[J]. Food Research International, 2012,49(1): 201-208.
[52]YANG K L, GENG Q R, SONG F Q, et al. Transcriptome sequencing revealed an inhibitory mechanism of Aspergillus flavus asexual development and aflatoxin metabolism by soy-fermenting non-aflatoxigenic aspergillus[J]. International Journal of Molecular Sciences,2020, 21 (19): 6994.
[53]XING F, WANG L, LIU X, et al. Aflatoxin B1 inhibition in Aspergillus flavus by Aspergillus niger through down-regulating expression of major biosynthetic genes and AFB1 degradation by atoxigenic A. flavus[J]. International Journal of Food Microbiology, 2017,256: 1-10.
[54]楊坤龙,袁 军,胡天然,等. 一种产毒黄曲霉的生物防治方法: CN109170509A[P]. 2019-01-11.
[55]DHANAMJAYULU P, BOGA R B, MEHTA A. Inhibition of aflatoxin B1 biosynthesis and down regulation of aflR and aflB genes in presence of benzimidazole derivatives without impairing the growth of Aspergillus flavus[J]. Toxicon, 2019,170: 60-67.
[56]CASQUETE R, BENITO M J, ARANDA E, et al. Gene expression of Aspergillus flavus strains on a cheese model system to control aflatoxin production[J]. Journal of Dairy Science, 2019,102(9): 7765-7772.
[57]CHEN Y J, KONG Q, LIANG Y. Three newly identified peptides from Bacillus megaterium strongly inhibit the growth and aflatoxin B1 production of Aspergillus flavus[J]. Food Control, 2019, 95: 41-49.
[58]FARZANEH M, SHI Z, GHASSEMPOUR A, et al. Aflatoxin B1 degradation by Bacillus subtilis UTBSP1 isolated from pistachio nuts of Iran[J]. Food Control, 2012,23(1): 100-106.
[59]CAI M, QIAN Y, CHEN N, et al. Detoxification of aflatoxin B1 by Stenotrophomonas sp. CW117 and characterization the thermophilic degradation process[J]. Environmental Pollution, 2020,261: 114178.
[60]JEBALI R, ABBS S, SALAH-ABBS J B, et al. Ability of Lactobacillus plantarum MON03 to mitigate aflatoxins (B1 and M1) immunotoxicities in mice[J]. J Immunotoxicol, 2015, 12(3):290-299.
[61]HUANG L, DUAN C, ZHAO Y, et al. Reduction of aflatoxin B1 toxicity by Lactobacillus plantarum C88: A potential probiotic strain isolated from Chinese traditional fermented food ‘Tofu[J]. PLoS One, 2017, 12(1):e0170109.
[62]TAHEUR F B, FEDHILA K, CHAIEB K, et al. Adsorption of aflatoxin B1, zearalenone and ochratoxin A by microorganisms isolated from Kefir grains[J]. International Journal of Food Microbiology, 2017,251: 1-7.
[63]SADEGHI A R, EBRAHIMI M, SADEGHI B. Effect of isolated Lactobacillus acidophilus and Lactobacillus brevis on growth of Aspergillus flavus and reduction of aflatoxin B1[J]. Journal of Rafsanjan University of Medical Sciences, 2016, 15(1): 3-16.
[64]WACOO A P, MUKISA I M, MEEME R, et al. Probiotic enrichment and reduction of aflatoxins in a traditional African maize-based fermented food[J]. Nutrients, 2019, 11(2): 265.
[65]CHLEBICZ A, SLIZEWSKA K. In vitro detoxification of aflatoxin B1, deoxynivalenol, fumonisins, T-2 toxin and zearalenone by probiotic bacteria from genus Lactobacillus and Saccharomyces cerevisiae yeast[J]. Probiotics and Antimicrobial Proteins, 2020, 12(1): 289-301.
[66]HARKAI P, SZAB I, CSERHTI M, et al. Biodegradation of aflatoxin-B1 and zearalenone by Streptomyces sp. collection[J]. International Biodeterioration & Biodegradation, 2016, 108: 48-56.
[67]RAO K R, VIPIN A V, HARIPRASAD P, et al. Biological detoxification of aflatoxin B1 by Bacillus licheniformis CFR1[J]. Food Control, 2017, 71: 234-241.
(責任编辑:张震林)
