基于代谢组学分析桃胶中酚类化合物含量及抗氧化活性
2021-07-23刘启月李勇陈小龙余向阳
刘启月 李勇 陈小龙 余向阳

摘要: 為深入了解桃胶的营养价值,首先分析了5种不同颜色桃胶提取液中总酚含量及抗氧化活性差异,然后基于高效液相色谱-四极杆飞行时间质谱(LC-QTOF-MS)和高效液相色谱串联质谱(LC-MS)的代谢组学方法对桃胶提取液中的酚类物质进行定性定量分析。结果表明,不同颜色桃胶提取液中总酚含量和抗氧化活性存在明显差异,颜色越深总酚含量越多、抗氧化活性越强,颜色最深样品(S5)中总酚含量为28.23 μmol/g,是颜色最浅样品组的7.8倍。基于LC-QTOF-MS分析桃胶提取液,共鉴定出32种活性化合物,其中黄酮类化合物有20种;基于LC-MS的靶向代谢组学方法对18种酚类化合物进行定量分析,发现橙皮素、柚皮素、表儿茶素、圣草酚含量最多。相关性分析结果表明,18种酚类化合物中,14种酚类化合物与总酚含量及抗氧化活性呈显著正相关关系。
关键词: 桃胶;酚类化合物;抗氧化活性;代谢组学
中图分类号: TS218 文献标识码: A 文章编号: 1000-4440(2021)03-0746-08
Analysis on phenolics contents and antioxidant activity in peach gum based on metabolomics
LIU Qi-yue1,2,3, LI Yong2,3, CHEN Xiao-long2,3, YU Xiang-yang1,2,3
(1.College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China;2.Key Lab of Food Quality and Safety of Jiangsu Province-State Key Laboratory Breeding Base Constructed by Province-Ministry, Nanjing 210014, China;3.Institute of Agricultural Resources and Environment, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: To better understand the nutritive value of peach gum, total phenol content and antioxidant activity difference in the extracting solution of peach gum presenting five different colors were analyzed firstly. Then the phenolic substances in the extracting solution of peach gum were analyzed qualitatively and quantitatively via metabolomics methods of liquid chromatography-hybrid quadrupole time-of-flight mass spectrometry (LC-QTOF-MS) and liquid chromatograph-mass spectrometer (LC-MS). The results showed that, total phenol content and antioxidant activity of peach gum extracting solutions with various colors were significantly different, and the deeper the color, the higher the total phenol content was, with stronger antioxidant activity. The total phenol content in the peach gum with the darkest color (S5) was 28.23 μmol/g, which was 7.8 times compared with the lightest color group. 32 active metabolites were identified in the extracting solution of peach gum via LC-QTOF/MS methods, including 20 flavonoid compounds. Quantitative analysis of 18 phenol compounds based on target metabonomics of LC-MS showed that, the contents of hesperetin, naringenin, epicatechin and eriodictyol were relatively high. Correlation analysis showed that, 14 phenolic compounds of 18 phenolic compounds in peach gums showed significant positive correlation with total phenols content and antioxidant activity.
Key words: peach gum;phenolic compounds;antioxidant activity;metabolomics
桃胶为蔷薇科植物桃[Prunus persica (L.) Batsch]或山桃[Prunus davidiana (Carr.) Franch]等植物的树皮受损后分泌出来的半透明无色、浅黄色或黄棕褐色琥珀状固体,初分泌时为透明状黏液,随着风干日晒,经氧化浅层变黑后透明度降低。古籍记载,桃胶味苦、平、无毒,炼服能保中不饿、和血益气、下石淋、止痛等[1]。桃胶可活血消肿、通淋止痛,临床运用对腹泻、疼痛、血淋、石淋、痢疾等症均有效,被《中药大辞典》收录[2]。桃胶70%~80%的成分为桃胶多糖,现代医学研究结果表明,桃胶多糖具有良好的体内外抗氧化活性[3],且能提高免疫力、降血糖、降血脂、调节胃肠道[4-5]。作为药食同源的农副产品,桃胶除供日常食用外,在功能食品、医疗美容和医药领域的应用也受到越来越多的关注。
植物中存在的天然产物如多酚、黄酮类化合物及花色苷等物质,可以起到保持人体健康、预防慢性疾病的作用,其中天然黄酮类化合物存在于绝大部分植物中,含有2-苯基色原酮结构,羟基衍生物多具黄色,它在植物的生长、发育、开花、结果以及抗菌防病等方面起着重要的作用[6]。桃树受机械损伤,如切伤或虫咬后流出的一般是白色透明桃胶,受病菌感染后则分泌黄色或黄褐色至深红棕色的胶。推测桃胶中除桃胶多糖外可能含有其他丰富的活性成分,且初始分泌出不同颜色桃胶可能是因为其中含有的黄酮类物质含量差异造成。
目前,对于桃胶的研究以其成分[7-8]及理化性质[9-10]为主,成分研究又集中在桃胶多糖的研究,包括多糖提取纯化[11-12]及其应用[5,13-14]方面。桃胶中酚类化合物及其抗氧化活性方面鲜见相关研究报道。有研究者对不同品种、不同产地的桃胶进行多糖含量[8]、微量元素[15]等检测,但对不同颜色桃胶的成分差异未有研究报道。本研究收集同品种5种不同颜色桃胶,首先分析不同颜色桃胶提取液中总酚含量及抗氧化活性差异,然后基于LC-QTOF-MS和LC-MS的代谢组学方法对桃胶提取液中酚类物质进行定性定量分析,为桃胶在医药保健、美容护肤等产品的开发利用提供试验依据,同时为其作为新资源食品开发奠定基础。
1 材料与方法
1.1 材料与试剂
桃胶样品采摘于国家果树种质南京桃资源圃(位于江苏省农业科学院内)同品系桃树,2019年6月至8月每周采集主干及主枝桃胶一次,新鲜桃胶采摘后经自然晾干后低温保存。按颜色将桃胶样品分成5组(图1),分别为白色透明桃胶组(S1)、浅黄色透明桃胶组(S2)、黄色透明桃胶组(S3)、棕黄色透明桃胶组(S4)、深黄褐色透明桃胶组(S5)。将不同颜色桃胶样品粉碎后过60目筛,收集桃胶粉末样品。准确称取桃胶样品粉末100 mg于50 ml具塞试管中,加入20 ml 70%乙醇,60 ℃下超声波处理1 h,离心取上清液经0.22 μm有机微孔滤膜过滤后,用于总酚含量、抗氧化活性以及酚类物质定性定量分析,每个样品重复制备5次。
酚类化合物标准品芹菜素、金合欢素、圣草酚、金雀异黄酮、金圣草黄素、异樱花亭、山柰酚、橙皮素、柚皮素、柚皮素-7-O-葡萄糖苷、根皮素、花旗松素、松属素、表儿茶素、原花青素B1、积雪草酸、绿原酸、对羟基肉桂酸均采购于上海安谱实验科技股份有限公司,均为分析纯。分别精密称取18个对照标准品,用色谱级甲醇溶解,配置成20 μg/ml的标准溶液。将18种单标溶液混合成2 μg/ml的混合标准溶液,逐级稀释成1 000 ng/ml、500 ng/ml、200 ng/ml、100 ng/ml、50 ng/ml、20 ng/ml、10 ng/ml、5 ng/ml、2 ng/ml、1ng/ml等质量浓度,待用。
植物总酚(TP)含量测定试剂盒(货号A143-1-1)、总抗氧化能力(T-AOC)测定试剂盒(货号A015-3-1,FRAP法)、总抗氧化能力(T-AOC)测定试剂盒(货号A015-3-1,ABTS法)均购买于南京建成生物工程研究所。甲醇(德国Merck公司产品)、乙腈(德国Merck公司产品)、甲酸(美国Fisher公司产品) 均为色谱纯。
1.2 仪器与设备
高速冷冻离心机(KDC-220HR,中国安徽中科中佳科学仪器有限公司产品),超声波恒温清洗机(10DT,宁波新芝生物科技股份有限公司产品),超纯水仪(Direct-Q5 UV,美国Millipore公司产品)。
LC-MS为高效液相色谱(安捷伦1290)串联三重四级杆质谱(AB SCIEX QTRAP 6500),LC-QTOF-MS为高效液相色谱(安捷伦1260)串联飞行时间质谱(AB SCIEX QTOF 5600+)。
1.3 方法
1.3.1 LC-QTOF-MS定性分析桃胶提取液 将不同颜色桃胶提取液混合后进行LC-QTOF-MS分析,LC-QTOF-MS的色谱柱为XSelect HSS T3(4.6 mm×150.0 mm,3.5 μm),正电离模式流动相为0.1%甲酸/水(A)和乙腈(B),负电离模式流动相为0.005 mol/L乙酸铵(A)和乙腈(B)。流动相梯度洗脱程序为:0~3.00 min,10% B;3.00~21.00 min,10%~95% B;21.00~28.00 min,95% B;28.00~28.10 min,10% B;28.10~34. 00 min,10% B。
LC-QTOF-MS的质谱條件为选择QTOF-MS全扫描模式和信息相关分析(IDA),质量扫描范围为m/z 50~1 000,正、负电离模式的源电压分别为5 500 V和4 500 V,帘气、雾化器(gas1)和加热气体(gas2)的流动压力分别为25 psi、50 psi和50 psi。碰撞能量(CE)分别为30 V和-30 V。利用MS-DIAL软件对LC-QTOF-MS数据进行分析,通过分析保留时间、质量精度和同位素比值以及与公共数据库(包括MassBank、LipidBlast、GNPS、MetaboBASE)进行MS/MS相似性匹配来进行化合物鉴定。
1.3.2 LC- MS定量分析桃胶提取液酚类物质 基于LC-MS对18种酚类物质进行定量分析。LC-MS色谱柱为ZORBAX SB-C18色谱柱(2.1 mm×100.0 mm,3.5 μm,美国安捷伦公司产品),流动相A为0.1%甲酸水,流动相B为甲醇,梯度洗脱程序为:0~1.00 min,95%~80% A;1.00~4.00 min,80%~25% A;4.00~7.00 min,25%~5% A;7.00~9.00 min,5% A;9.00~9.10 min,5%~95% A;9.10~13.00 min,95% A。柱溫为30 ℃,流速为0.3 ml/min,进样体积为2.0 μl。
质谱条件为正负离子切换模式电喷雾电离,气帘气40 psi,离子化电压5 500 V和4 500 V,雾化温度400 ℃,雾化气65 psi,辅助气60 psi。
2 结果与分析
2.1 桃胶总酚含量及抗氧化能力分析
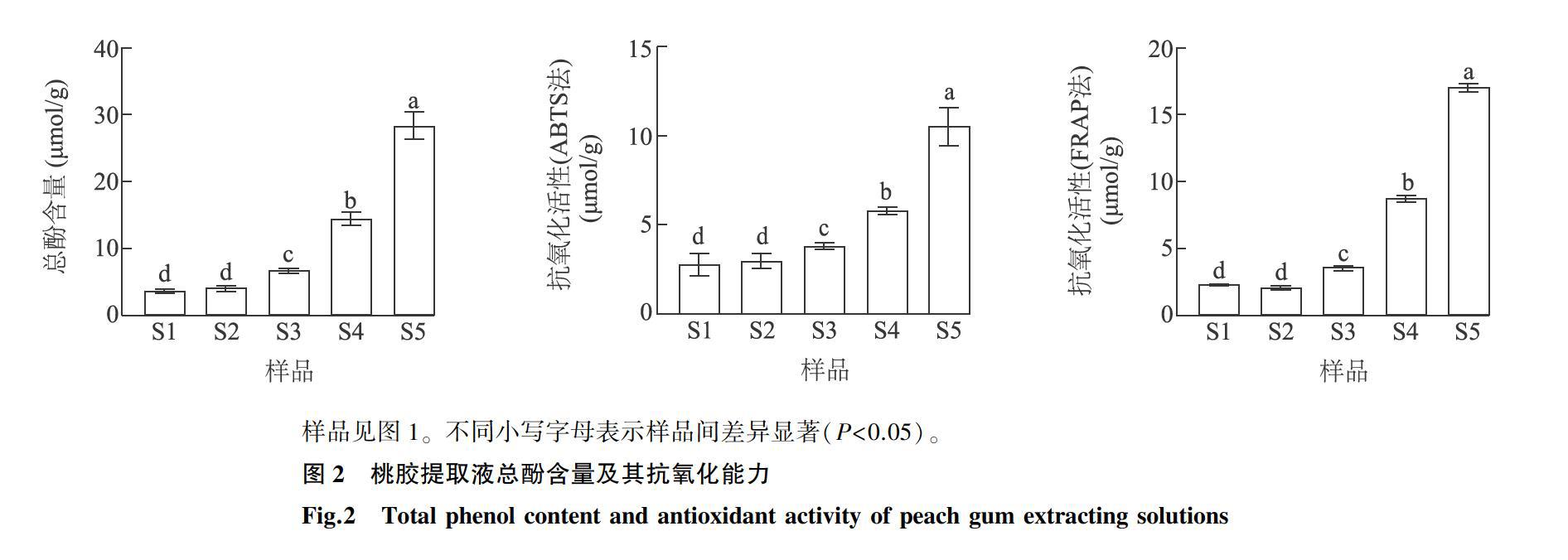
不同颜色桃胶总酚含量及抗氧化活性差异明显,颜色越深,桃胶提取液总酚含量越高、抗氧化活性越强(图2)。桃胶样品S1、S2、S3、S4、S5提取液中总酚含量分别是3.60 μmol/g、4.02 μmol/g、6.70 μmol/g、14.40 μmol/g、28.23 μmol/g, S5样品的总酚含量最高,为S1的7.8倍、S2的7.0倍、S3的4.2倍、S4的2.0倍。桃胶提取液的抗氧化活性变化趋势与总酚含量变化趋势一致。S5样品的抗氧化活性最高,为10.46 μmol/g(ABTS法)和17.00 μmol/g (FRAP法);S1样品的抗氧化活性最弱,为2.79 μmol/g (ABTS法)和2.31 μmol/g (FRAP法)。
2.2 桃胶提取液的LC-QTOF-MS定性分析
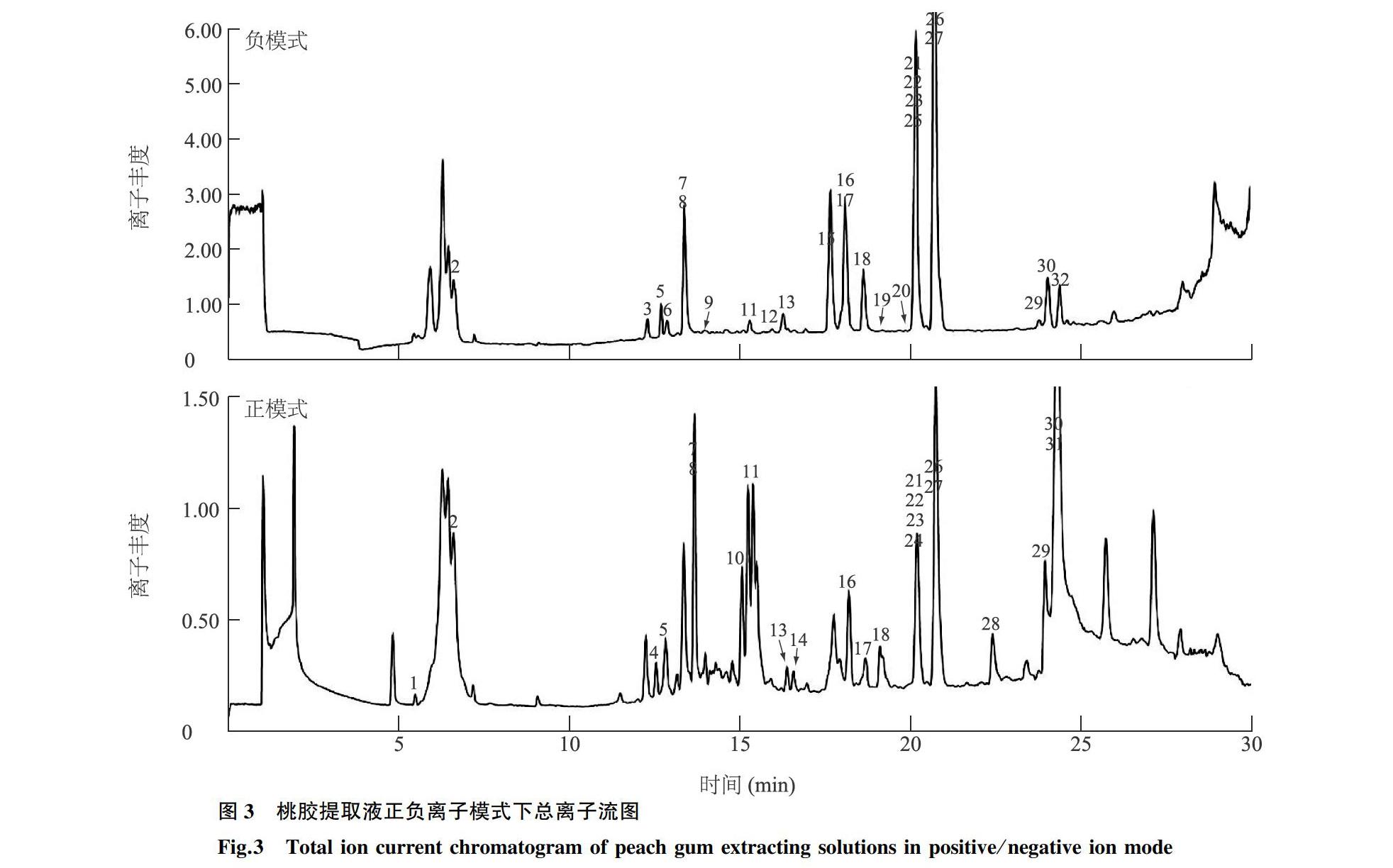
基于LC-QTOF-MS方法在桃胶提取液中鉴定出32种活性化合物,其中包括儿茶酚/酚酸3种、儿茶素/花色素5种、黄酮类化合物20种、香豆素类2种、五环三萜酸1种、类氨基酸左旋肉碱1种[16]。表1为32种化合物的定性鉴定结果,图3为正负总离子流色谱图,表1中的32种化合物峰号与图3一致。20种黄酮类化合物包括3种黄酮(木犀草素、芹菜素、金圣草黄素)、9种黄烷酮及其苷(圣草酚、圣草酚-7-O-葡萄糖苷、高圣草酚、柚皮素、柚皮素-7-O-葡萄糖苷、橙皮素、异樱花亭、松属素、5,7-二羟基-3′,4′-二甲氧基黄烷酮)、2种异黄酮(金雀异黄酮、鹰嘴豆芽素A)、2种黄酮醇(山奈酚、山奈素)、2种二氢黄酮醇(花旗松素、二氢山奈酚)、2种二氢查耳酮(根皮苷、根皮素)。在木质部中,天然黄酮类化合物多以苷元形式存在[17],桃胶由桃树枝干部位分泌[18-19],所鉴定出的20种黄酮类化合物也是以17种苷元为主。黄酮类化合物表现出多种多样的药理活性,能防治心脑血管系统的疾病和呼吸系统的疾病,具有抗炎抑菌、降血糖、抗氧化、抗辐射、抗肿瘤以及增强免疫能力等药理作用[20]。其中橙皮素、柚皮素、柚皮苷是芸香科柑橘属植物主要药效成分或代谢成分。花旗松素、圣草酚、高圣草酚、芹菜素、木犀草素、根皮素、根皮苷、山奈酚、山奈素等广泛存在于蔬菜、水果及中药中。5,7-二羟基-3′,4′-二甲氧基黄烷酮属于甲基化黄酮类化合物,甲基化黄酮类化合物是一类重要的天然黄酮类衍生物,具有潜在的多种保健功能,与黄酮类前体相比,它们具有更高的生物利用度,但甲基化黄酮类化合物在植物中含量一般比黄酮苷元和黄酮苷低[21]。
2.3 基于靶向代谢组学定量分析桃胶提取液中酚类物质含量
基于LC-QTOF-MS的定性分析结果,针对酚类化合物建立基于LC-MS的靶向代谢组学的定量分析方法。表2为不同颜色桃胶提取液中酚类化合物的定量分析结果,可以看出,桃胶提取液中不同酚类化合物含量存在显著差异,S5样品中18种酚类物质的含量分别为:橙皮素100.56 μg/g、柚皮素66.41 μg/g、表儿茶素25.60 μg/g、圣草酚24.66 μg/g、花旗松素8.22 μg/g、原花青素B17.20 μg/g、松属素6.25 μg/g、积雪草酸3.53 μg/g、柚皮苷3.30 μg/g、异樱花亭 1.82 μg/g、金圣草黄素0.49 μg/g、绿原酸0.43 μg/g、山奈酚0.38 μg/g、芹菜素 0.35 μg/g、对羟基肉桂酸0.33 μg/g、根皮素0.26 μg/g、木犀草素0.24 μg/g、金雀异黄酮0 μg/g,其中橙皮素、柚皮素、表儿茶素、圣草酚平均含量最多,这4种酚类物质可能是桃胶提取液中总酚的重要成分。
同一行数据后不同小写字母表示具有显著差异(P<0.05)。ND表示小于定量限或未检出。
此外,同一物质在不同颜色桃胶提取液中含量差异显著,除金雀异黄酮、绿原酸、积雪草酸及对羟基肉桂酸之外其余14种酚类化合物的含量均随颜色变深而增加。以含量最多的橙皮素为例,桃胶样品S1、S2、S3、S4、S5提取液中橙皮素含量分别是6.34 μg/g、10.60 μg/g、32.40 μg/g、65.11 μg/g、100.56 μg/g, S5样品的橙皮素含量最高是S1的15.9倍、S2的9.5倍、S3的3.1倍、S4的1.5倍,与总酚含量测定结果一致,说明橙皮素是桃胶提取液中总酚的主要成分。
表3为不同颜色桃胶提取液中酚类化合物含量与总酚含量及抗氧化活性之间的相关性分析结果,18种酚类化合物中,除金雀异黄酮、绿原酸、对羟基肉桂酸、积雪草酸等与总酚含量及抗氧化活性无显著相关性外,其余14种酚类化合物均与总酚含量及抗氧化活性呈显著相关关系。
3 结论
本研究对不同颜色桃胶提取液的总酚含量、抗氧化活性进行分析,同时采用LC-QTOF-MS及LC-MS的代谢组学方法对桃胶提取液中的小分子活性成分进行定性定量研究。研究发现,桃胶中含有丰富的酚类物质,且随着颜色的变深其总酚含量及抗氧化活性均增加;基于LC-QTOF-MS对桃胶提取液中活性物质进行定性分析,共鉴定出32种活性成分,其中黄酮类化合物种类最多有20种;基于LC-MS对18种酚类化合物进行定量分析,发现橙皮素(100.56 μg/g)、柚皮素(66.41 μg/g)、表儿茶素(25.60 μg/g)、圣草酚(24.66 μg/g)含量最高,且大多数酚类物质随桃胶颜色变深含量变高。本研究对桃胶品质进行了初步探索,研究结果为桃胶的进一步高值化开发利用提供科学依据。
参考文献:
[1] 明·姚可成. 食物本草[M]. 北京:人民卫生出版社,1994.
[2] 江苏新医学院. 中药大辞典[M]. 上海:上海人民出版社,1977.
[3] 蔡延渠,董碧莲,陈利秋,等. 桃胶多糖体内外抗氧化作用的研究[J]. 食品工业科技,2020,41(13):53-58.
[4] 丁 婷,杨建华,路新卫,等. 桃胶粗多糖对糖尿病小鼠免疫调节和血糖影响初探[J]. 食品工业,2009,30(6):7-9.
[5] 丁 婷,王 飞,韦莉萍,等. 桃胶多糖对2型糖尿病大鼠血糖和血脂的影响[J]. 中医药导报,2010,16(5):8-10.
[6] 曹纬国,刘志勤,邵 云,等. 黄酮类化合物药理作用的研究进展[J]. 西北植物学报,2003,23(12):2241-2247.
[7] 薛 梅,邢常瑞,孙梦璐,等. 微波消解-电感耦合等离子体质谱法同时测定桃胶中22种矿物元素含量[J]. 安徽农业大学学报,2020,47(4):505-512.
[8] 蔡延渠,邓剑壕,朱志东,等. 不同产地原桃胶的多糖含量研究[J]. 广东药学院学报,2018,34(1):25-28.
[9] 尹 楠,沈 群. 桃胶与阿拉伯胶性质的比较[J]. 食品工业科技,2006(8):146-148,165.
[10]李依娜. 桃胶的流变学特性研究[D]. 长沙:中南林业科技大学,2013.
[11]蔡延渠,董碧莲,王晓佳,等. 响应面法优化桃胶多糖碱水提取工艺及抗氧化活性研究[J]. 中药新药与临床药理,2019,30(12):1516-1522.
[12]徐 燕,朱科学,钱海峰,等. 桃胶多糖的提取分离及组成性质研究[J]. 食品工业科技,2008(1):66-68,71.
[13]左婧驰,陈 云,郭馨阳,等. 桃胶多糖及其协同EGCG抗醉解酒作用研究[J]. 食品研究与开发,2019,40(20):22-26.
[14]ZHANG L, KOU X Y, HUANG X, et al. Peach-gum: A promising alternative for retarding the ripening and senescence in postharvest peach fruit[J]. Postharvest Biology and Technology, 2020, 161: 111088. DOI:10.1016/j.postharvbio.2019.111088.
[15]薛 梅,邢常瑞,孙梦璐,等. 微波消解-电感耦合等离子体质谱法同时测定桃胶中22种矿物元素含量[J]. 安徽农业大学学报,2020,47(4):505-512.
[16]刘启月,李 勇,余向阳,等. 高效液相色谱-串联质谱法检测原桃胶中左旋肉碱的含量[J]. 江苏农业科学,2020,48(17):215-218.
[17]張鞍灵,高锦明,王姝清. 黄酮类化合物的分布及开发利用[J]. 西北林学院学报,2000,15(1):69-74.
[18]宋灿灿,周 祥,徐凡丁,等.松木材中挥发性成分对台湾乳白蚁行为的影响[J].南方农业学报,2019,50(1):74-80.
[19]刘启月,李 勇,余向阳,等.高效液相色谱-串联质谱法检测原桃胶中左旋肉碱的含量[J].江苏农业科学,2020,48(17):215-218.
[20]YAO L H, JIANG Y M, SHI J, et al. Flavonoids in food and their health benefits[J]. Plant Foods for Human Nutrition, 2004, 59(3):113-122.
[21]WEN L R, JIANG Y M, YANG J L, et al. Structure, bioactivity and synthesis of methylated flavonoids[J]. Annals of the New York Academy of Sciences, 2017, 1398(1):120-129.
(责任编辑:张震林)
