荒漠草原土壤线虫对氮沉降及降雨变化的响应
2021-07-23张宇晨赵巴音那木拉梁志伟
张宇晨,红 梅,赵巴音那木拉,叶 贺,闫 瑾,李 静,梁志伟
荒漠草原土壤线虫对氮沉降及降雨变化的响应
张宇晨,红 梅*,赵巴音那木拉,叶 贺,闫 瑾,李 静,梁志伟
(内蒙古农业大学草原与资源环境学院,内蒙古自治区土壤质量与养分资源重点实验室,内蒙古 呼和浩特 010018)
为了解氮沉降和降雨变化对短花针茅荒漠草原土壤线虫的影响, 试验设计采用主区为增雨30%(W)和减雨30%(R)、自然降雨(CK)3种水分处理,副区为0(N0)、30(N30)、50(N50)和100(N100)kg/(hm2∙a)4个氮素梯度共12个处理.结果表明:研究区共鉴定土壤线虫隶属41属,群落优势属为丽突属()和拟丽突属(),增雨较氮添加显著增加了线虫数量,且在10月份尤为明显,减雨下N50梯度更利于线虫数量增加;从功能类群来看,土壤0~10cm食细菌线虫数量最多(占总数41.00%~45.56%),并随季节动态呈上升趋势,捕杂食线虫数量最低,食细菌和食真菌线虫与氮梯度呈负相关关系;从生态指数来看,仅增雨抑制了土壤线虫多样性,单一氮添加没有改变线虫群落多样性和稳定性,但较低的氮添加会显著降低了线虫丰富度.不同季节动态处理下,土壤矿化途径受食微线虫的影响,有机质以真菌降解通道为主,减雨施氮下提高了土壤抗干扰能力;pH值、有机质、铵态氮含量是影响土壤线虫群落重要的环境因子,土壤氮含量增多及pH值降低增加了偏K策略者类群数量,降低R对策者类群数量,土壤线虫群落结构的变化,表明短花针茅荒漠草原生态系统地下食物网稳定性渐趋增强.
土壤线虫;氮沉降;降水变化;荒漠草原
当今全球环境问题日益突显[1],气候环境变化已成为生态学领域研究热点之一,大气氮沉降及降水作为全球变化的重要现象,其格局的改变带来一系列生态问题[2-3].在此背景下,我国草原生态系统也在发生变化,降水对土壤理化性质、植被生物量及群落构成均有显著影响,改变了土壤湿度和植物地下净初级生产力[4].氮素作为草原生态系统主要限制养分之一,大气氮沉降能显著影响草地营养循环及生态系统功能多样性.而降水及氮添加交互作用下土壤动物响应模式及其相关研究较少,降水及氮沉降必将通过改变土壤动物生境进而改变动物群落组成和结构.
土壤动物对维持生态系统功能至关重要.线虫作为土壤动物主要功能类群之一,种类丰富,分布广泛,在土壤腐屑食物网中占据多个营养级,维持着生态系统健康运行,一般被看做是生态环境变化的敏感性指示生物[5-6],也用来评价土壤受干扰程度.近年来,土壤线虫在生态环境中的作用越来越受到重视,土壤线虫对不同生态系统环境及生态结构转变下的响应成为研究热点[7-8].草地生态系统作为研究重点之一,不同草地类型及管理模式,土壤线虫在群落组成、结构和生态指标都有明显差异.而全球气候环境导致的CO2浓度和温度上升,氮沉降及降雨格局的改变都对线虫产生不同程度的影响[9-11].
全球气候变化由多个因子共同驱动,不同驱动因子间存在复杂的相互关系.降水格局的变化会影响氮循环过程,而大气氮沉降的增加也会影响水分循环过程.降水格局变化及大气氮沉降之间的交互作用比单一因素更复杂,在此背景下我国草地生态系统也发生改变.内蒙古短花针茅荒漠草原位于草原和荒漠的过度地带,生态关系有一定的不稳定性,生态系统较脆弱[12-13],相对于其它草原类型,更容易发生演替或退化.以此开展全球气候变化背景下草地生态系统的研究,研究环境变化对荒漠草原生态系统土壤线虫的影响,得出其对水氮交互作用下的响应模式,有利于增加对土壤地下生态系统变化的理解,对于进行草原生态系统保护、恢复有重要的理论和实践意义.
1 材料与方法
1.1 试验地概况
试验以内蒙古短花针茅温带荒漠草原为研究对象,试验区位于内蒙古乌兰察布市四子王旗短花针茅草原生态系统野外科学试验基地,在地势平坦,植被类型有代表性的地段设置样地,四周有围栏保护,地理坐标111°53′E,41°47′N,海拔1450m,地处温带干旱、半干旱大陆性季风气候区,年平均气温3.4 ℃,年降雨量280mm,蒸发量是降水量8~10倍左右,降水主要集中在6~9月份,占全年降水70%以上.试验点地形开阔,无地表径流,降雨是该区域唯一的土壤水分补充方式.土壤类型为淡栗钙土,有明显钙积层,土壤养分较差,0~10cm土壤有机碳含量为18.27g/kg,全氮含量1.83g/kg.草地类型为短花针茅()+冷蒿()+无芒隐子草().建群种为短花针茅,优势种为无芒隐子草.
1.2 试验设计
试验于2015年12月开始进行,采用裂区设计,主区水分处理分别为自然降雨(CK)、增雨30%(W)和减雨30%(R),增雨试验分别在每年5~8月的1~3日进行,通过多年对荒漠草原降雨量监测并做模型预测未来降雨量,增加量为近5a(5月(18.4%)、6月(17.0%)、7月(28.3%)、8月(36.3%))平均降雨量的30%,通过流量表加喷头模拟增雨.减雨试验通过减雨装置减少当地年平均降水量的30%.副区为4个氮素水平处理,根据本地区氮沉降情况,参考国际同类研究处理方法,分别设置氮沉降量0(N0),30(N30), 50(N50),100kg/(hm2∙a)(N100),其中不包括大气氮沉降,施氮处理按照施氮量换算成小区硝酸铵(NH4NO3)施用量,为能够尽可能均匀施氮,在生长季(5~9月)每月1次模拟湿沉降,将每个小区每次施用硝酸铵的量溶于30L水中(在增雨处理之后),均匀喷洒在每个小区内,CK喷洒相同量的水,非生长季(10月~翌年4月),将每月每个小区施氮量与风干土(直径<2mm)按肥土比1:10的比例充分混匀,在无风时以模拟干沉降的方式直接撒施,试验共12个处理,6次重复,每个小区面积为7m×7m=49m2,各小区间设置2m隔离带.
1.3 样品采集与土壤线虫鉴定
样品采集按照季节动态及植物发育期于每年4月(春季萌发期)、7月(夏季生长期)、10月(秋季凋亡期)每月取样1次.取样时,为了消除边界效应,在每个小区中间点采用环刀(高10cm,直径5cm),根据“随机”、“等量”和“多点混合”的原则对0~10cm土层进行取样.
将采集的土壤样品装入自封袋后放置于4 ℃冰箱保存,新鲜土样48h内进行线虫分离并计数鉴定.从采取的新鲜土样中取200g利用改良的浅盘法对土壤线虫进行分离保存,并进行计数和到属水平的鉴定,利用土壤含水量将线虫个体数量转化成条/100g干土.鉴定采用形态学鉴定[14],根据线虫头部形态学特征和取食生境将土壤线虫分为不同功能营养类群[15],食细菌(Ba)、食真菌(Fu)、植食性(Pp)、捕/杂食(Op)4个类群.根据土壤线虫生活史策略不同划分线虫的c-p类群,c-p值变化范围为1~5[16].
同时,取0~10cm的混合土壤样品1kg,作为土壤理化性质指标的测试.土壤pH值采用电位法(酸度计STARTER 2100型,土:水=1:5)进行测定;土壤温度采用温度计(TP101型)测定;土壤有机质(SOM)采用重铬酸钾-容量法测定;土壤含水量采用烘干称重法测定;其它测定指标具体方法参考文献[17].
1.4 数据处理与分析
根据不同类群的多度,划分不同类群的优势度,个体数占总捕获量10%以上者为极优势类群(+++++),5% ~ 10%为优势类群(++++),2% ~ 5%为次优势类群(+++),1% ~ 2%为常见类群(++),1%以下为稀有类群(+).
土壤线虫群落结构分析用以下指标:
香农-威纳多样性指数(Shannon-Weiner index):

均匀度指数(Pielou):
=¢/ln(2)
辛普森优势度指数(Simpson index):

丰富度指数(Margalef):

成熟度指数(maturity index):
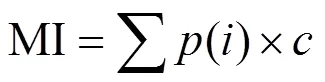
线虫通路比值(Nematode channel ratio):
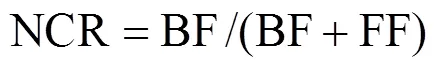
瓦斯乐斯卡指数(wasilewska index):

式中:p表示第个种属个体数占全部线虫总数的比例;表示样地内鉴定出全部物种数;表示土壤线虫多度;表示每种线虫对应的c-p值; BF代表食细菌线虫的数量, FF代表食真菌线虫的数量, Pp代表植食性线虫的数量;线虫数据经转化后采用Excel 2007和sigmapolt 12.5绘制图表,以SPSS 17.0进行方差分析,土壤理化性质与土壤线虫群落的关系采用Canoco 5.0软件进行RDA分析及作图.
2 结果与分析
2.1 土壤线虫数量
不同季节动态水氮处理下土壤线虫数量W下10月份最多,R下则表现为7月.相较氮素水平水分变化更直接决定土壤线虫数量.与CK相比W下样地整体土壤线虫数量显著增加,R则相反,这点在10月份显著(<0.05).同水分处理R下氮浓度的提高随线虫数量增多且N50更利于线虫数量的增加,而较高的N100会明显降低线虫数量,W下在不同月动态下无明显变化规律.
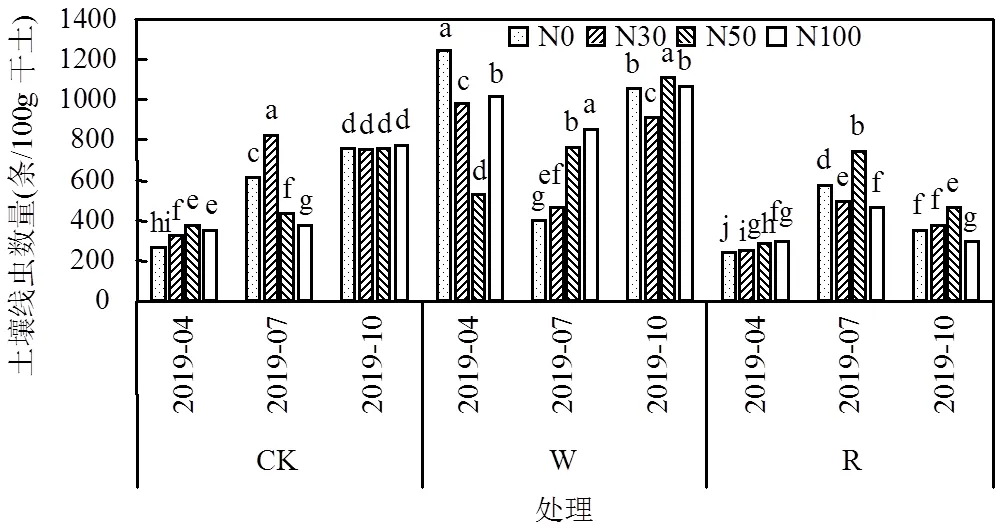
图1 不同水氮控制下土壤线虫多度(0~10cm)的变化
不同小写字母表示单月不同处理与对照间差异显著(<0.05)
2.2 水氮控制下土壤线虫群落种类组成
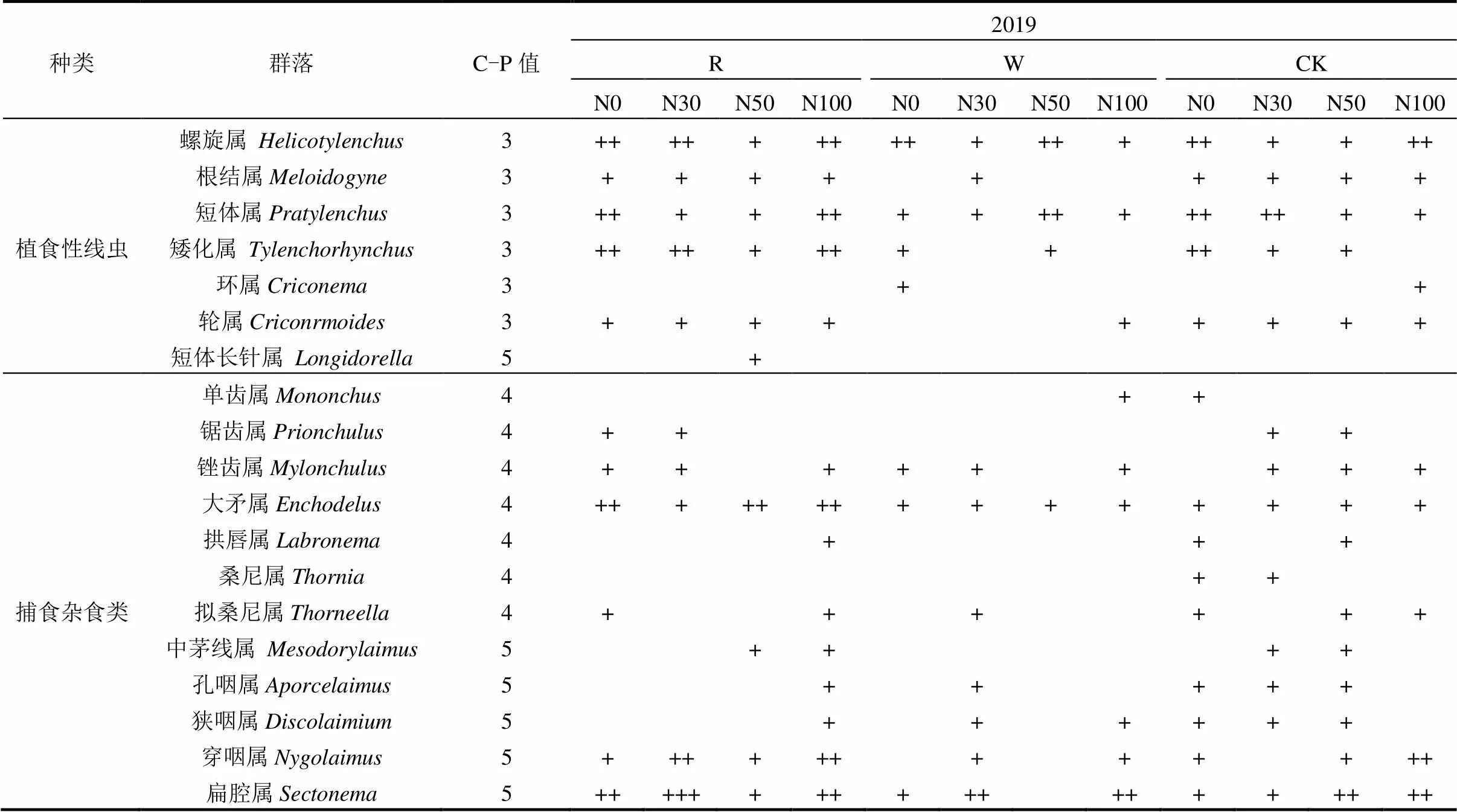
2019年在水氮交互下样地共获得土壤线虫40206条,共鉴定出41个属(表1).其中试验地W及氮素处理下鉴定为39属,食细菌线虫11属共509条,占总数的42%,群落优势类群为拟丽突属()、丽突属(),常见类群为板唇属()、似绕线属()、鹿角唇属()等.食真菌线虫7个属共247条,占总数的21%,群落优势类群为滑刃属(),常见类群为真滑刃属()、伪垫刃属()等.植食性性线虫10属共238条,占总数的20%,矮化属()、螺旋属()、裸茅属()等为常见类群.捕食/杂食性线虫11个属共206条,占总数的17%,常见类群为锉齿属()、扁腔属()、拟桑尼属()等.R及氮素处理下鉴定为40属,食细菌线虫11属共540条,占总数的45%,群落优势类群为丽突属()、拟丽突属()、鹿角唇属(),常见类群为板唇属()、似绕线属()、绕线属()等.食真菌线虫7个属共237条,占总数的20%,群落优势类群为滑刃属(),常见类群为短茅属()、细齿属()等.植食性线虫10个属共235条,占总数的20%,螺旋属()、散香属() 、轮属()等为常见类群.捕/杂食性线虫12个属共181条,占总数的15%,常见类群为拱唇属()、锉齿属()、扁腔属()等.
总体而言,不同水氮控制下丽突属()、拟丽突属()是土壤线虫群落优势属,与CK相比,月动态及水氮交互下线虫稀有属种类减少,线虫属丰度降低.
2.3 水氮控制下土壤线虫群落营养结构
土壤线虫群落受到水分、氮素、取样时间3者交互作用的影响,3因素方差分析表明: 3者对土壤线虫不同营养类群影响极其显著(<0.001)(表2).不同季节动态处理下,0~10cm土壤中食细菌线虫数量最多,占总数41.00%~45.56%,季节动态下总体百分率4~10月呈上升趋势,捕杂食类土壤线虫数量最少,占总数的11.61%~23.75%,植食性线虫和食真菌线虫数量较接近且7月份最高.不同月动态变化下,同水分处理氮梯度增加营养类群数量呈波动性变化.4月随氮梯度增加植食性线虫数量W处理显著高于R和CK,同水分处理R不施氮植食性线虫数量最多,捕杂食类线虫随氮梯度升高呈波动性变化,在N100达到峰值.7月不同水分处理随氮梯度增加R增加了食细菌线虫数量,W增加了食真菌线虫数量,10月不同水分处理随氮梯度增加R降低了食细菌、食真菌线虫数量.7,10月份W下食细菌、食真菌线虫均在N50达到峰值,R下N30达峰值(图2).
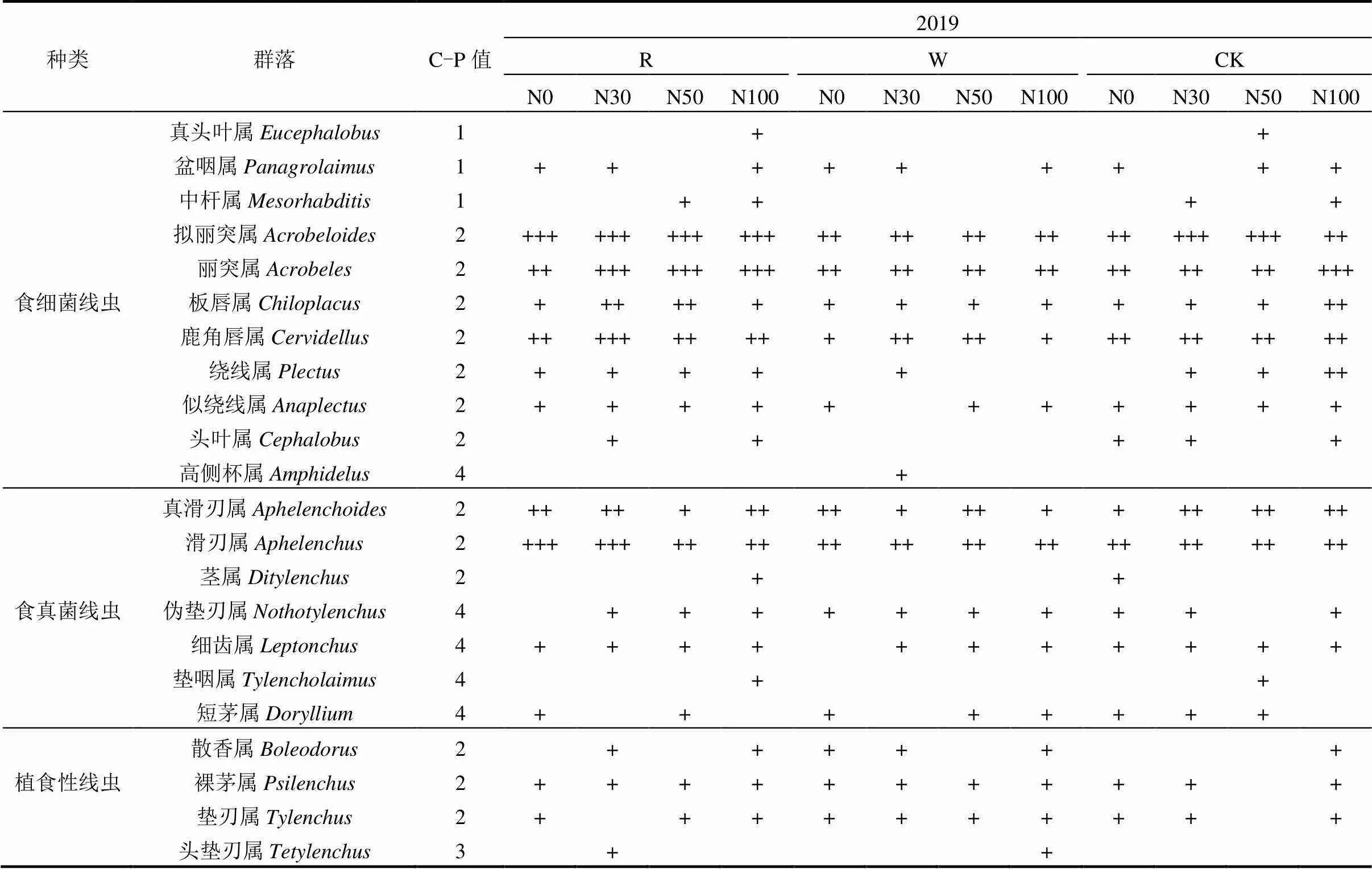
表1 水氮交互下样地土壤线虫群落优势度
续表1
注: ,Fu: 食真菌性线虫; Ba: 食细菌性线虫; Pp: 植食性线虫; OP: 杂食-捕食类线虫; 10%以上者为极优势类群(+++++), 5%~10%为优势类群(++++), 2%~5%为次优势类群(+++), 1%~2%为常见类群(++), 1%以下为稀有类群(+).
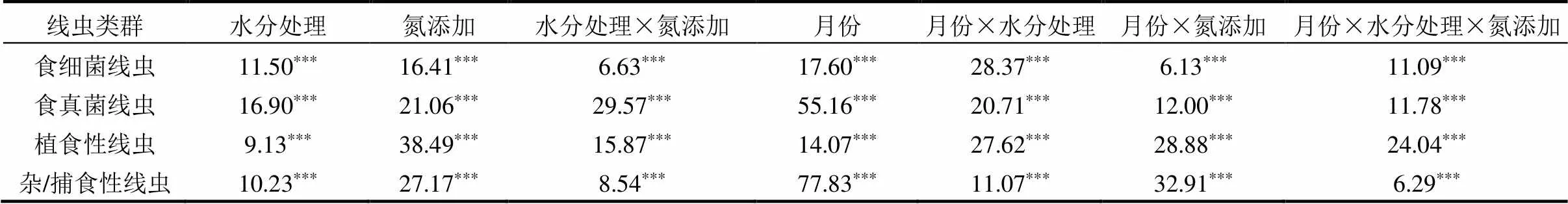
表2 水分、氮素添加及取样时间对土壤线虫营养类群三因素方差分析
注:***差异极显著(<0.0001).

图2 水氮交互下(0~10cm)土壤线虫营养类群变化
Fu:食真菌性线虫;Ba:食细菌性线虫;Pp:植食性线虫;OP:杂食-捕食类线虫
2.4 水氮控制下土壤线虫群落生态指数
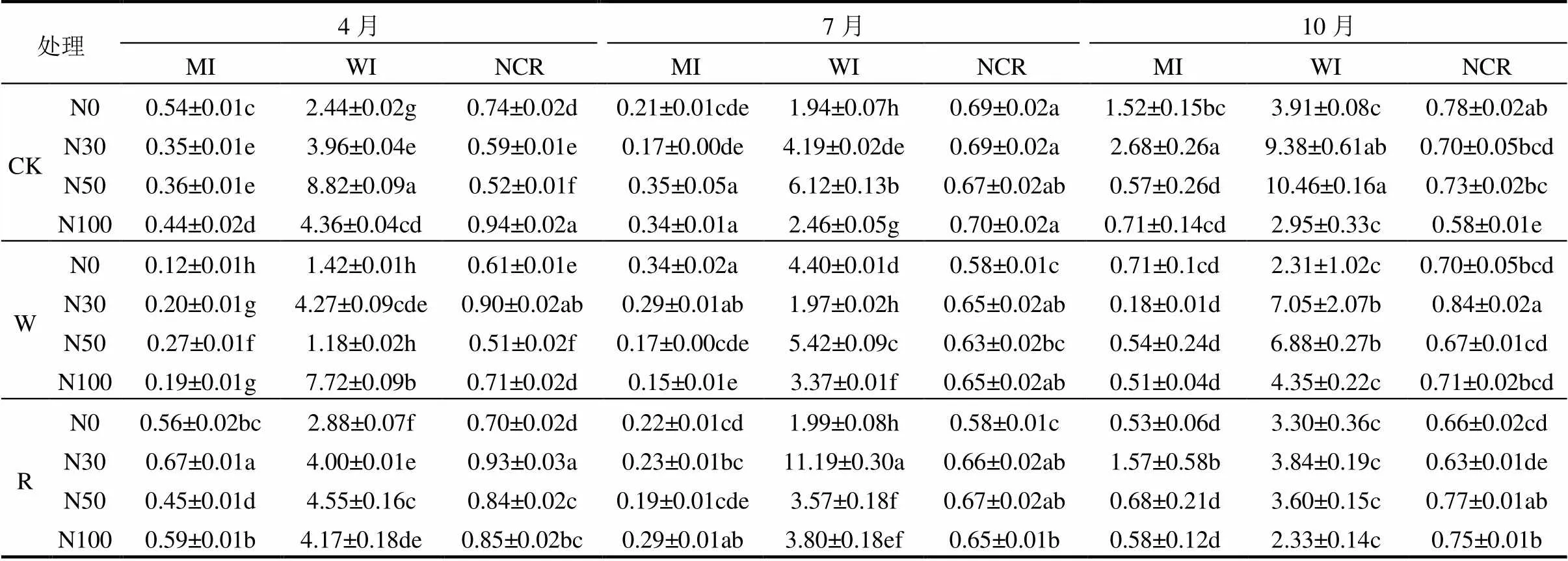
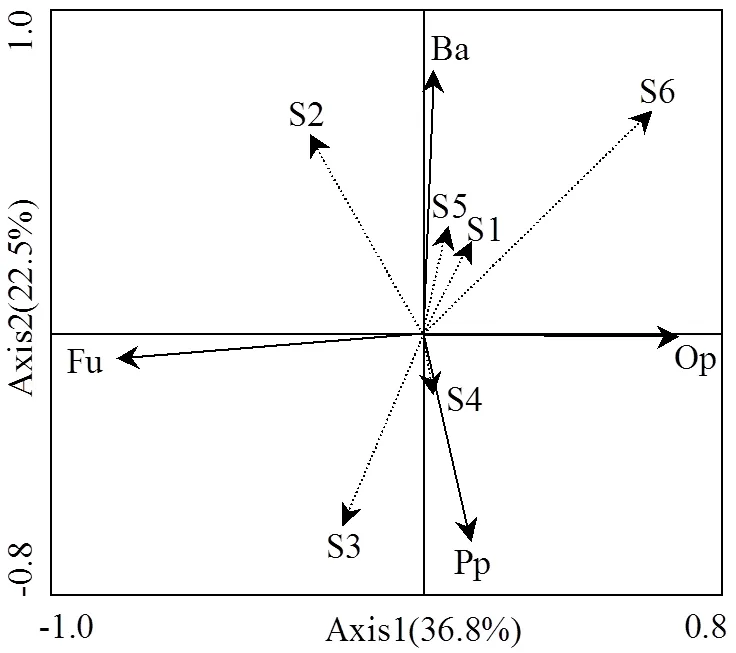
多样性指数(′)、均匀度指数()、优势度指数()及丰富度指数(SR)表示水氮交互下样地土壤线虫群落生物多样性(表3).多样性指数变化范围在1.247 ~ 2.208之间,方差分析结果表明,R样地多样性指数整体高于CK及W样地,W样地显著降低了土壤线虫群落多样性指数(<0.05),同水分处理下,随氮梯度的升高多样性指数在N50水平下最低,但梯度之间并无显著变化.优势度指数变化范围在0.001 ~ 0.011之间,均匀度指数变化范围0.491 ~ 1.303.不同水氮处理对优势度指数无明显影响,均匀度指数无显著变化.不同水氮交互处理下丰富度指数差异显著,变化范围介于8.111~11.867.总体而言不同水分条件下,与CK相比W-N100会明显降低线虫丰富度,R则相反且随着氮梯度升高 表3 土壤线虫群落多样性指数 注:数据表示为:平均值±标准偏差;同列不同小写字母表示处理与对照差异显著(<0.05),下同. 表4 土壤线虫功能性指数 成熟度指数(MI)、通路比值(NCR)、瓦斯乐思卡指数(WI)表示水氮交互下样地土壤线虫群落结构功能特征(表4).不同月动态变化下MI变化范围0.12 ~ 2.68,WI范围1.18 ~ 11.19,总体来看MI10月最大,7月最低; WI值W处理10月最高,R处理7月最高,所有水氮交互下其值都大于1,表明土壤矿化途径受食微线虫的影响.与CK相比, 4月成熟度指数W显著降低,R处理施氮则相反且N30达峰值.7月不施氮(N0)W处理显著提高成熟度指数,施氮下呈波动变化,R处理随施氮浓度增加成熟度指数缓慢升高,N100达到峰值,W则相反.10月整体W和R随氮梯度升高成熟度指数无明显变化.不同水分下,当 线虫区系分析中富集指数(EI)用于预测食物网对可利用资源的响应,结构指数(SI)表征干扰及生态恢复过程中土壤食物网结构的变化,2者结合可指示土壤环境受干扰程度和土壤食物网状况.本研究结果表明(图3),不同处理下样点都位于第三象限,即EI小于50但SI大于50,说明经过3个月不同水氮交互作用下各样地土壤环境无明显的干扰,养分富集状况中等. 图3 不同水氮处理下土壤线虫区系分析 RDA分析结果表明,土壤线虫各营养类群对土壤养分响应有明显差异(图3),土壤pH值、有机质(OM)、铵态氮(NH4+-N)是驱动土壤线虫群落的主要环境因子,其中食细菌线虫受影响尤为明显,有机质和铵态氮与食细菌线虫呈正相关关系且与植食性线虫呈负相关关系,pH值和有机质与食真菌线虫呈正相关关系,与捕杂食线虫呈负相关关系,土壤全氮(TN)、硝酸盐氮(NO3--N)、含水量对线虫营养类群影响较小. 图4 土壤线虫营养类群与环境因子的冗余分析 S1:全氮; S2:有机质; S3:pH; S4:含水量; S5:NO3--N; S6:NH4+-N 全球变化背景下,往往大气氮沉降和降水变化同时发生,水分影响氮的矿化及淋溶过程,氮沉降通过改变植物生理过程,从而改变水分循环,两者交互作用共同作用土壤生境微环境进而改变土壤线虫群落组成和结构[18-19].通过对比1a内3次取样调查发现,相比氮素水分更直接决定了土壤线虫数量的增多,土壤含水量的增加更利于寄存在土壤孔隙水中的土壤线虫运动及捕食,不同季节动态秋季(10月)最多,春夏季(4和7月)相对较低,这与前人研究一致[20],这可能受不同生长季凋落物分解矿化过程影响,生长季末凋落物分解较多,极大影响土壤线虫资源有效性,7月降雨相对频繁,土壤表层部分养分向深层淋溶损失,氮素添加则有效缓解这一过程,故减雨下适量的施氮有利于土壤线虫数量的增加.随季节动态变化,水氮交互下不同种属由32属增加为41属,物种多样性虽波动变化但总体呈上升趋势,物种多样性的上升有利于荒漠草原生态系统的稳定性,而土壤含水量增加会导致优势属占比增多,这点在7月份尤为明显. 土壤线虫种属的变化使得线虫营养结构相应改变,有研究发现草原长期施氮会降低土壤微生物活性和多样性[21],季节动态下,本试验发现4个营养类群中食细菌线虫占比最大且呈逐渐上升趋势,这与张爱林等[22]研究不相一致,究其原因在于土壤中硝酸盐氮含量积累增加会促进细菌的生长和繁殖,且食细菌线虫对细菌的捕食存在正反馈效应,从而导致食细菌线虫的增多[23-24].在氮限制、缺水的荒漠草原,增雨增加地上植被生物量,植食性线虫数量高于减雨,缺水环境一定程度会降低施氮的影响,增雨和N50处理食真菌、食细菌线虫数量最多,这不仅和当月充沛的降雨有直接关系,也表明适当的氮添加和水分有利于食微线虫的生长.而土壤线虫在减雨处理下受上行效应的影响,氮素添加导致了NH4+和NO3-浓度的增加,随着氮梯度升高,NO3-可能对土壤线虫产生毒害作用,故降低了食细菌和食真菌线虫数量,这也验证了减雨下不施氮植食性线虫的增加,也有研究表明NH4+毒害作用可能会抑制植食性线虫[25],捕杂食线虫作为对环境干扰最敏感的营养类群,减雨下随氮梯度升高波动变化但无显著差异,表明减雨和氮添加没有对土壤食物网产生明显影响. 采用线虫生态指数反映不同水氮交互下土壤线虫群落多样性、群落结构及土壤食物网差异.本试验中,不同水分条件下,增雨显著降低了多样性指数,同水分处理下,随氮梯度增加,多样性指数波动变化但不明显,整体来说,单一氮添加对多样性指数、均匀度指数、优势度指数无显著影响,氮添加并没有改变线虫群落多样性和稳定性.而在水氮交互下,低氮添加对线虫属丰富度影响强于水分因素,即存在明显负效应,这与前人的研究相一致[26],可能原因是氮添加会加剧NH4+-N的消解,氨的毒性作用影响线虫属的丰富度.成熟度指数用于评价人类活动对线虫群落结构的影响,反映土壤受干扰程度大小,其值越高,表示土壤环境受干扰程度越小[27].本试验中,4月与对照相比同氮素水平下,增雨显著降低了成熟度指数,土壤受干扰程度增加,而在降水最充余的7月,减雨下随氮梯度升高,成熟度指数呈上升趋势,土壤环境抗干扰能力增强,而增雨下则相反,过多的水分使土壤受到强烈的干扰,而10月不同处理下成熟度指数无明显变化.总的来说,成熟度指数随季节动态推移逐渐升高,表明水氮交互对土壤食物网干扰降低,增强了其稳定性和复杂性.瓦斯乐思卡指数用于分析土壤食物网矿化途径及健康状况,本试验所有水氮交互下瓦斯乐思卡指数值都大于1,表明样地土壤矿化途径受食微线虫的影响,10月增雨处理和7月减雨处理下土壤健康程度最好.试验样地中食细菌线虫数量最多,而7月不同处理下通路比值(NCR)小于0.75,即土壤有机质分解途径以真菌通道为主,这主要因为食细菌线虫和食真菌线虫相对比例的变化导致.本试验中7月所有水氮交互下,瓦斯乐思卡指数都大于1且差异显著,说明水氮因素共同影响了食真菌线虫对土壤的氮矿化作用.而在植物萌发期和生长末期(4,10月),减雨下高于N30有机质分解主要以细菌为主,增雨则相反. 本研究中通过3个月水氮交互处理,在区系分析中富集指数小于50,但结构指数大于50,样点都相对集中分布于第三象限.说明随着水氮交互处理时间的推移,土壤养分中等程度富集,食物网呈结构化,土壤环境受干扰程度逐渐降低,这点从成熟度指数在季节动态下逐渐升高也侧面反映出.这表明水氮交互对土壤食物网干扰日趋降低,土壤生态系统稳定性渐增强. 水分和氮素一直是荒漠草原生长的主要限制因子,水氮交互下土壤环境必定会发生明显的改变.冗余分析表明,pH值、有机质、铵态氮含量是决定线虫营养群落的主要因素,施氮直接增加土壤硝酸盐氮和铵态氮的含量,使土壤氮含量增多,水氮处理又加快凋落物分解[28],这都使得土壤养分和生物取食来源大大增加,有机质的增加使得土壤线虫典型机会主义者cp1类群和机会主义者cp2类群的数量显著增加[29],相对于偏养分的K策略者,cp4和cp5类群主要受pH值影响,pH值的降低会很快导致捕杂食线虫数量的减少,这也印证了有机质含量与食细菌、食真菌线虫呈正相关关系,捕杂食线虫数量降低.施氮会降低土壤pH值,特别是随着施氮量的增加,土壤逐渐酸化,研究表明土壤线虫cp类群中R策略者与pH值趋势变化呈负相关[22],而本试验中,食细菌线虫数量与pH值呈负相关关系,这与王宇彤等[30]研究不一致,可能原因是在偏碱性的土壤中,水分一定程度影响土壤生物呼吸和氧化还原反应. 4.1 水分和氮素存在交互作用, 适当的水氮添加有利于食微线虫的生长,水分提高了土壤线虫数量.而减雨环境以N50为节点土壤线虫数量最多,食细菌和食真菌线虫与氮梯度呈负相关关系,月动态水氮处理下增加了物种多样性. 4.2 而单一的氮添加没有改变线虫群落多样性和稳定性,R下低氮添加与线虫属丰富度呈负相关关系,增雨加大了土壤受干扰程度,总体对土壤食物网没有产生显著影响.这点在降水充沛的7月尤为明显且不同水氮处理土壤有机质分解途径以真菌通道为主, 2者共同影响土壤氮矿化作用. 4.3 水氮交互改变了土壤pH值、有机质、铵态氮养分含量,增加了偏K策略者cp1和cp2类群数量,降低R对策者cp4、cp5类群数量. 总体来说,季节动态下不同水氮交互处理增加了短花针茅荒漠草原土壤食物网稳定性,通过一年处理,短花针茅荒漠草原土壤系统稳定性上升. [1] Ren G Y, Ding Y H, Zhao Z C, et al. Recent progress in studies of climate change in China [J]. Advances in Atmospheric Sciences, 2012,29(5):958-977. [2] 颜 亮,周广胜,张 峰,等.内蒙古荒漠草原植被盖度的空间异质性动态分析[J]. 生态学报, 2012,32(13):4017-4024. Yan L, Zhou G S, Zhang F, et al. Spatial heterogeneity of vegetation coverage and its temporal dynamics in desert steppe, Inner Mongolia [J]. Acta Ecologica Sinica, 2014,32(13):4017-4024. [3] Luo C Y, Wang S P, Zhao L, et alEffects of land use and nitrogen fertilizeron ecosystem respiration in alpine meadow on the Tibetan Plateau [J]. Journal of Soils and Sediments, 2017,17(6):1626-1634. [4] 宋 敏,刘银占,井水水.土壤线虫对气候变化的响应研究进展[J]. 生态学报, 2015,35(20):6857-6867. Song M, Liu Y Z, Jin S S. Response of soil nematodes to climate change: a review [J]. Acta Ecologica Sinica, 2015,35(20):6857-6867. [5] 周际海,唐嘉婕,郜茹茹,等.不同种类食细菌线虫对石油污染土壤微生物的影响[J]. 中国环境科学, 2020,40(1):357-364. Zhou J H, Tang J J, Hao R R. Effects of different speices of bacterial-feeding nematodes on soil microorganisms in oil- contaminated soils [J]. China Environmental Science, 2020,40(1): 357-364. [6] 李玉娟,吴纪华,陈慧丽,等.线虫作为土壤健康指示生物的方法及应用[J]. 应用生态学报, 2005,16(8):1541-1546. Li Y J, Wu J H, Chen H L, et al. Nematodes as bioindicator of soil health: methods and applications [J]. Chinese Journal of Applied Ecology, 2005,16(8):1541-1546. [7] Zhang X K, Guan P T, Wang Y L, et al. Community composition, diversity and metabolic footprints of soil nematodes in differently- aged temperate forests [J]. Soil Biology and Biochemistry, 2015,80(1): 118-126. [8] 牟文雅,贾艺凡,陈小云,等.玉米秸秆还田对土壤线虫数量动态与群落结构的影响[J]. 生态学报, 2017,37(3):877-886. Mou W Y, Jia Y F, Chen X Y, et al. Effects of corn stover cultivation on the population dynamics and genus composition of soil nematode community [J]. Acta Ecologica Sinica, 2017,37(3):877-886. [9] Dong Z K, Hou R X, Chen Q Y, et al. Response of soil nematodes to elevated temperature in conventional and no-tillage cropland systems [J]. Plant and Soil, 2013,373(1/2):907-918. [10] Ruan W B, Sang Y, Chen Q, et al. The response of soil nematode community to nitrogen, water, and grazing history in the Inner Mongolian Steppe [J]. China Ecosystems, 2012,15(7):1121–1133. [11] Mueller K E, Blumenthal D M, Carrillo Y, et al. Elevated CO2and warning shift the functional composition of soil nematode communities in a semiarid grassland [J]. Soil Biology and Biochemistry, 2016,103(1):46-51. [12] 卫智军,韩国栋,赵 钢,等.中国荒漠草原生态系统研究[M]. 北京:科学出版社, 2013. Wei Z J, Han G D, Zang G, et al. Resaerch of chinese desert grassland ecosystem [M]. Beijing: science press, 2013. [13] 刘文亭,卫智军,吕世杰,等.放牧对短花针茅荒漠草原植物多样性的影响[J]. 生态学报, 2017,37(10):1-9. Liu W T, Wei Z J, Lv S J, et al. The impacts of grazing on plant diversity in Stipa breviflora desert grassland [J]. Acta Ecologica Sinica, 2017,37(10):1-9. [14] Bardgett R D, Usher M B, Hopkins D W. Biological diversity and function in soils [J]. Cambridge: Cambridge University Press, 2005: 117-256. [15] Yeates G W, Bongers T, De Goede R G M, et al. Feeding habits in soil nematode families and genera—An outline for soil ecologists [J]. Journal of Nematology, 1993,25(3):315-331. [16] Bongers T. The maturity index: an ecological measure of environmental disturbance based on nematode species composition [J]. Oecologia, 1990,83(1):14-19. [17] 鲍士旦主编.土壤农化分析[M]. 第3版.北京:中国农业出版社, 2000:189-196. Bao S d. Soil Agro-chemistrical Analysis [M]. Beijing: China Agriculture Press Chinese Agricultural Press China agriculture Publishing House, 2000:189-196. [18] Landesman W J, Dighton J. Response of soil microbial communities and the production of plant-available nitrogen to a two-year rainfall manipulation in the New Jersey Pinelands [J]. Soil Biology and Biochemistry, 2010,42(10):1751-1758. [19] Chen D, Lan Z, Bai X, et al. Evidence that acidification-induced declines in plant diversity and productivity are mediated by changes in below-ground communities and soil properties in a semi-arid steppe [J]. Journal of Ecology, 2013,101(5):1322-1334. [20] 宋 敏.增加降水及施氮对弃耕草地土壤线虫和小型节肢动物的影响[J]. 生态学杂志, 2017,36(3):631-639. Song M. Effects of water and nitrogen addition on soil nematodes and small arthropods in an old field grassland of north China [J]. Chinese Journal of Ecology, 2017,36(3):631-639. [21] Dijkstra F A, Hobbie S E, Reich P B, et al. Divergent effects of elevated CO2, N fertilization, and plant diversity on soil C and N dynamics in a grassland field experiment [J]. Plant and Soil, 2005, 272(1/2):41-52. [22] 张爱林,赵建宁,刘红梅,等.氮添加对贝加尔针茅草原土壤线虫群落特征的影响[J]. 生态学报, 2018,38(10):3616-3627. Zhang A L, Zhao J N, Liu H M, et al. Effects of nitrogen addition on soil nematode community characteristics in Stipa baicalensis steppe [J]. Acta Ecologica Sinica, 2018,38(10):3616-3627. [23] Wang J, Bao J, Su J, et al. Impact of inorganic nitrogen additions on microbes in biological soil crusts [J]. Soil Biologyand Biochemistry, 2015,88:303-313. [24] 刘雨迪,陈小云,刘满强,等.不同稻作年限下土壤微生物学性质和线虫群落特征的变化[J]. 生物多样性, 2013,21(3):334-342. Liu Y D, Chen X Y, Liu M Q, et al. Changes in soil microbial properties and nematode assemblage over time during rice cultivation [J]. Biodiversity Science, 2013,21(3):334-342. [25] Sun X M, Zhang X K, Zhang S X, et al. Soil nematode responses to increases innitrogen deposition and precipitation in a temperate forest [J]. Plos One, 2013,8(12):e82468. [26] 张 瑶.放牧与施氮对草甸草原土壤线虫群落的作用研究[D]. 长春:东北师范大学, 2016. Zhang Y. Effects of grazing and nitrogen addition on soil nematode community in meadow grassland [M]. Changchun: Northeast Normal University, 2016. [27] Yeates G W, Newton P C D, Ross D J. Significant changes in soil microfauna in grazed pasture under elevated carbon dioxide [J]. Biology and Fertility of Soils, 2003,38(5):319–326. [28] 叶 贺,红 梅,赵巴音那木拉,等.水氮控制对短花针茅荒漠草原根系分解的影响[J]. 应用与环境生物学报, 2020,26(5):1169-1175. Ye H, Hong M, Zhao B Y N M L, et al. Effects of water and nitrogen treatments on root decomposition in Stipa breviflora desert steppa [J]. Chinese Journal of Applied and Environmental Biology, 2020,26(5): 1169-1175. [29] Bongers T, Bongers M. Functional diversity of nematodes [J]. Applied Soil Ecology, 1998,10(3):239-251. [30] 王宇彤,牛克昌.青藏高原高寒草甸土壤环境对线虫功能多样性的影响[J]. 生物多样性, 2020,28(6):707-717. Wang Y T, Niu K C. Effect of soil environment on functional diversity of soil nematodes in Tibetan alpine meadows [J]. Biodiversity Science, 2020,28(6):707-717. Response of soil nematodes in desert steppe to nitrogen deposition and rainfall changes. ZHANG Yu-chen, HONG Mei*, ZHAO Bayinnamula, YE He, YAN Jin, LI Jing, LIANG Zhi-wei (Inner Mongolia Key Laboratory of Soil Quality and Nutrient Resources, College of Grassland, Resources and Environment, Inner Mongolia Agricultural University, Hohhot 010018, China)., 2021,41(6):2788~2797 A twelve-treatment experiment with the main plot(three water treatments: 30% increase (W), 30% reduction (R),and natural rainfall (CK) and split-plot (0 (N0), 30 (N30), 50 (N50) and 100 (N100) kg/(hm2∙a)4nitrogen gradients was designed indesert steppe to investigate the impact of nitrogen deposition and rainfall changes on soil nematodes. A total of 41 genera of soil nematodes were identified in the study area, and the dominant community genera weres and. Compared with nitrogen addition, the number of nematodes wasincreased significantly in precipitation and that influences were especially obvious in October. N50 gradient was more beneficial to increase the number of nematodes under the situation of reduced rain. In terms of functional groups, the largest part bacterial-eating nematodes in the 0~10cm soil were 41.00% to 45.56% of the total and an upward trend was shown in the seasonal dynamics, while the lowest part was the number of omnivorous nematodes. Bacteria-eating and fungus-eating nematodes were negatively correlated with nitrogen gradients. According to the ecological index, soil nematode diversity would be inhibited by only increasing rainfall, and the nematode community diversity and stability was not changedby single nitrogen addition. However, the abundance of nematodes was terrifically cut down by lower nitrogen addition. Under dynamic treatments in different seasons, the soil mineralization pathway was affected by micro-nematodes, and the organic matter was mainly degraded by fungi. Under reduced rainfall and nitrogen application, soil anti-interference ability was improved. Important environmental factors affecting soil nematode communities were pH, organic matter, and ammonium nitrogen content. The number of K-strategist groups was increased in increasing soil nitrogen content and decreasing in pH, while the number of R-strategist groups was reduced. Changing in soil nematode community structure was indicated that the stability of the underground food web in thedesert steppe ecosystem was gradually increased. soil nematode;nitrogen deposition;precipitation change;desert steppe X171,S154.5 A 1010-6923(2021)06-2788-10 张宇晨(1994-),男,内蒙古巴彦淖尔市人,内蒙古农业大学硕士研究生,主要从事草原土壤利用与保护研究.发表论文4篇. 2020-10-25 国家自然科学基金(31860136,31560156);内蒙古自治区自然科学基金(2017MS0350);内蒙古自治区研究生教育创新计划资助项目(S20191157Z) * 责任作者, 教授, nmhm1970@sina.com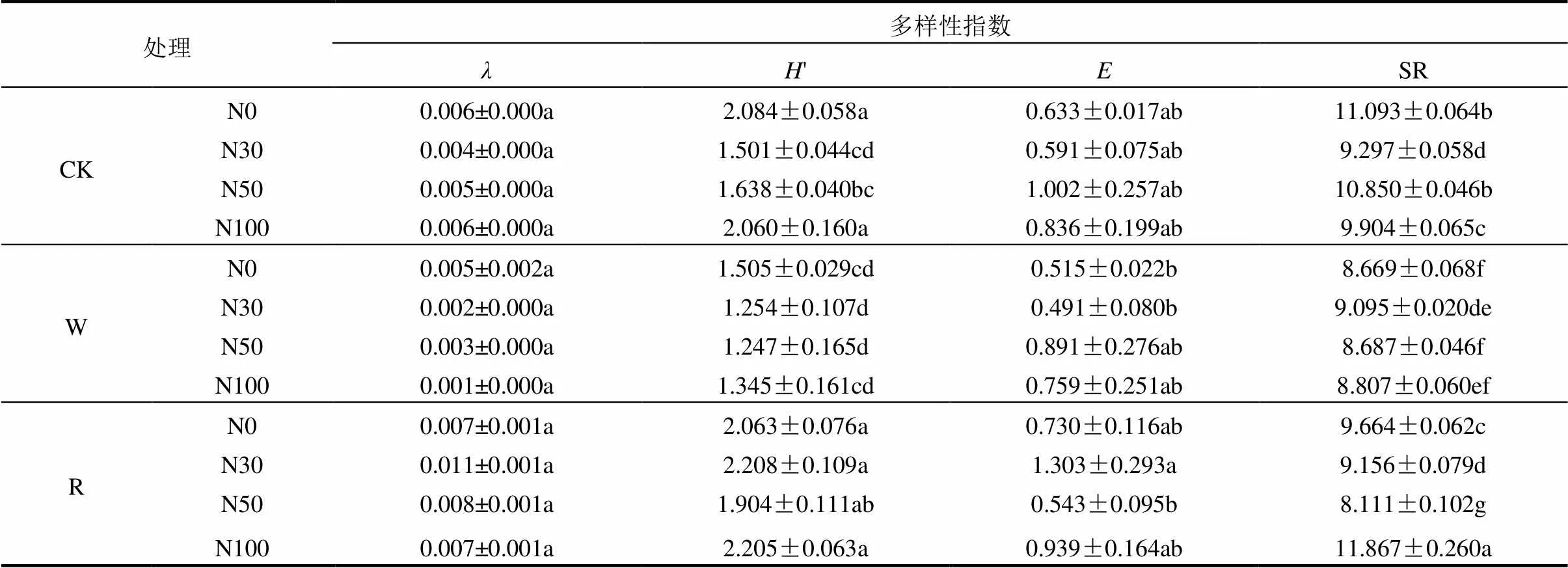
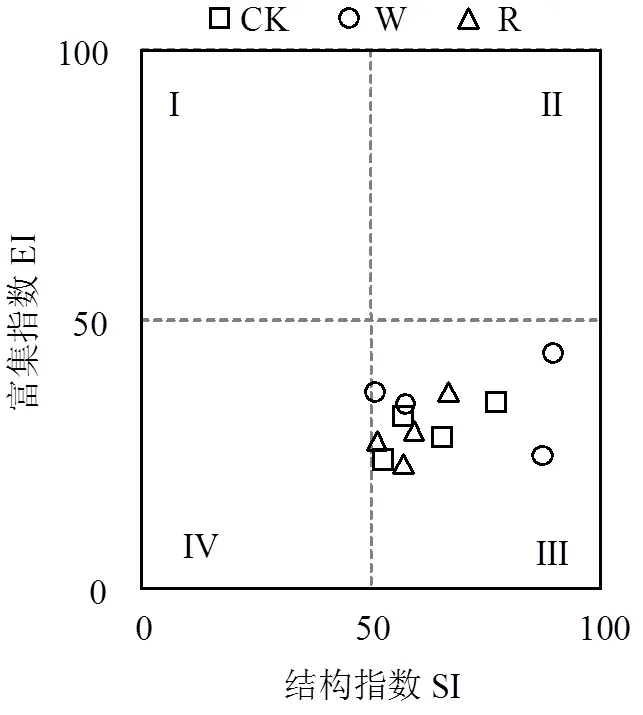
2.5 草原土壤线虫与土壤理化性质的关系
3 讨论
3.1 水氮添加对土壤线虫群落组成和营养类群的影响
3.2 水氮添加对土壤线虫生态指数的影响
3.3 土壤线虫群落不同营养类群与土壤理化因子的关系
4 结论
