密斑刺鲀(Diodon hystrix) gnrh基因的克隆及表达分析*
2021-07-22陈华谱黄春仁何睿祺戴明姝张明真李智渊李广丽
陈华谱 黄春仁 何睿祺 戴明姝 张明真 李智渊 黄 海 李广丽①
密斑刺鲀()基因的克隆及表达分析*
陈华谱1黄春仁2何睿祺1戴明姝1张明真1李智渊1黄 海3李广丽1①
(1. 广东省名特优鱼类生殖调控与繁育工程技术研究中心 广东省海水养殖生物育种工程实验室 广东海洋大学水产学院 湛江 524088; 2. 海南晨海水产有限公司 三亚 572000; 3. 热带海洋生物资源利用与保护教育部重点实验室 海南省热带海洋渔业资源保护与利用重点实验室 海南热带海洋学院 三亚 572022)
密斑刺鲀()不仅具有食用价值, 同时也是传统的中药及保健食品, 但目前关于密斑刺鲀的生殖内分泌调控研究较少, 限制了密斑刺鲀的人工繁育基础理论的发展。总所周知, 促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)是生殖内分泌调控的关键因子之一。利用转录组分析及分子克隆技术, 获得密斑刺鲀促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)和基因的cDNA开放阅读框(Open Reading Frame, ORF)序列, 并利用生物信息学的方法, 获得密斑刺鲀cDNA开放阅读框共279 bp, 可编码92个氨基酸残基; 密斑刺鲀cDNA开放阅读框共270 bp, 可编码89个氨基酸残基。通过系统进化分析表明, 密斑刺鲀GnRH与鲀科类的鱼具有较近的亲缘关系。通过聚合酶链式反应(Polymerase Chain Reaction, PCR)半定量的方法检测和基因在密斑刺鲀各组织中的分布, 结果发现和基因在脾、鳃和垂体中的表达量较高, 而在心脏中的表达量最低。此外, 利用实时荧光定量的方法检测了密斑刺鲀和基因在性腺发育不同时期的表达模式, 结果显示密斑刺鲀基因在不同的性腺发育时期中没有显著性的变化, 而基因随着性腺发育成熟而不断升高。研究主要获得两个创新性的重要结果: 首先是证实了密斑刺鲀存在两种基因(和), 其次是提示了基因可能是密斑刺鲀生殖调控的主要类型。研究结果可为深入研究密斑刺鲀生殖内分泌调控机理提供研究方向和基础。
密斑刺鲀(); GnRH; 分子克隆; 组织分布
密斑刺鲀()属于鲀形目(Tetraodontiformes)、二齿鲀科(Diodontidae), 主要分布于热带海域, 如大西洋、太平洋、地中海、印度洋等地, 模式产地在印度, 主要栖息于沙石或砾石底质海域(Bandyopadhyay, 2014)。该种鱼身体表面含有长刺, 正常情况下刺向后折叠, 受到攻击时会使身体膨胀, 将刺竖起用以保护自己, 背部、侧面和鳍有许多黑斑点, 主要呈浅棕色(陈燕等, 2019)。尽管密斑刺鲀被认为含有毒素(Trevett, 1997), 但因其肉质鲜美, 鱼皮富含胶原蛋白, 属于传统的海洋药用生物, 深受太平洋岛屿国以及中国海南南部地区的欢迎(Bandyopadhyay, 2014; 马军等, 2020)。当前, 由于过度捕捞, 密斑刺鲀野生资源受到了破坏, 由此急需开展密斑刺鲀的人工繁育及资源增殖。
在自然资源下降的情况下, 开发新的海洋鱼类资源是人类获取优质食物蛋白的重要途径, 开发新的海洋鱼种并成功实现其人工养殖, 首要前提是认识该鱼种的生殖特性, 以控制其生殖周期和产卵(柳学周等, 2013)。鱼类的生殖受到脑-垂体-性腺轴的调控, 最先由下丘脑分泌合成促性腺激素释放激素(GnRH), GnRH属于一种多肽类激素, 是性腺发育与性激素合成的关键内分泌调控因子, 同时也是“下丘脑-垂体-性腺”轴的原始动力(Zohar, 2010)。它是以脉冲的方式进行分泌, 之后进入垂体门脉系统, 到达垂体前叶和GnRHR特异性结合激活信号传导机制, 刺激垂体黄体生成素(LH)和卵泡刺激素(FSH)的合成及释放, 最后通过血液循环调节性腺的活动(张树芳, 2018; Muñoz-Cueto, 2020)。
目前, 研究人员们在脊椎动物中共鉴定出15种不同分子形式的基因, 在硬骨鱼类中发现了8种不同分子形式的GnRH。不同分子形式的GnRH都具有共同的核心十肽结构, 并在长期的进化过程中显示出保守的结构特征, 从而组成了GnRH多肽家族(Somoza, 2002)。在大多数脊椎动物中, GnRH有两种形式, 即GnRH1 (Mammalian-GnRH)和GnRH2 (Chicken GnRH), 部分硬骨鱼除了GnRH1和GnRH2, 还有GnRH3 (Salmon GnRH) (Okubo, 2008; 李婉茹等, 2020)。GnRH2主要功能是调控动物的食欲和性行为, 集中于中脑部位, 聚集在中脑前端和间脑后端的交汇处, 紧挨动眼神经(Tostivint, 2011), 但是关于GnRH2的确切功能现今依然存在很大的争议, 一般认为是发挥了神经递质的作用(Kanda, 2010)。GnRH3主要分布于前脑并能延伸到神经末端, 精确定位是在嗅神经和端脑的融合处, 可能间接参与刺激垂体激素释放的生理过程, 虽然GnRH3不能直接刺激垂体, 但是在嗅觉泡和前视觉形成处等区域有和GnRH1共表达的区域, GnRH1的作用是刺激促性腺激素的释放(Wirsig-Wiechmann, 2001)。目前关于GnRH的生理功能在多种鱼类中开展了研究(Chen, 2020), 但在鲀形目鱼类中的研究相对较少(Muñoz-Cueto, 2020), 有待于进一步研究。
密斑刺鲀虽含有毒素, 但因肉质鲜美而被很多人喜爱, 但目前对于密斑刺鲀的研究较少, 人工繁育也未见报道, 阻碍了密斑刺鲀产业的发展(陈燕等, 2019; 马军等, 2020), 因此, 研究其生长生殖调控并作为人工育种工作的指导是必要的。本研究克隆了密斑刺鲀和基因, 并分析了其表达模式, 探究了基因的特性, 分析序列结构特征, 本研究结果为深入探索密斑刺鲀的基因在生长发育中的调控机理提供了研究基础。
1 材料与方法
1.1 实验材料
密斑刺鲀()实验鱼为三亚近海捕捞, 活体运回实验室后经冰上深度麻醉后取适量脑、垂体、性腺、肌肉、肝脏、心脏、脾、肾脏和鳃组织, 经液氮速冻后转入–80°C冰箱保存, 用于总RNA提取及后续实验。
1.2 实验试剂
总RNA提取Trizol试剂盒; PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒; DNAMarker2000; rTaq酶; 克隆用载体pMD19-T Vector; 无菌水; DEPC水(0.1%); 1×TAE电泳缓冲液; LB液体培养基; 氨苄青霉素(AMP)溶液; 含AMP抗性的LB固体培养基。
1.3 总RNA的提取和cDNA的合成
总RNA的提取采用Trizol试剂盒进行, 对密斑刺鲀的肌肉、精巢、垂体、肾脏、脑、肝脏、心脏、脾和鳃组织进行提取。RNA检测采用1% (质量体积分数)的琼脂糖凝胶电泳, 使用Nanodrop 2000超微量核酸蛋白测定仪测定其浓度和质量。所有RNA样品各取1 μg, 按照PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒合成cDNA。
1.4 gnrh2和gnrh3基因的cDNA克隆
1.4.1 引物设计 通过利用高通量测序的方法, 构建密斑刺鲀全脑的转录组文库, 并通过同源比对, 同时也结合密斑刺鲀基因组数据(数据未发表)的比对, 获得密斑刺鲀和基因的片段scaffold, 根据scaffold序列设计引物进行开放阅读框ORF克隆(表l), 获得和基因cDNA序列。
1.4.2 分子克隆 取等量的密斑刺鲀全脑的cDNA作为模板进行PCR克隆。PCR体系为10 μL: 5 μL rTaq酶, 0.4 μL上游引物, 0.4 μL下游引物, 0.4 μL混合cDNA模板, 3.8 μL双蒸水。PCR程序: 预变性95°C、5 min; 变性95°C、30 s, 退火59°C、30 s, 延伸72°C、30 s, 共32个循环; 延伸72°C、10 min; 4°C保存。将PCR产物使用1%琼脂糖凝胶进行电泳, 切取目的片段回收, 连接到pMD19-T Vector载体, 转化到感受态细胞。挑取阳性菌落, 送生物公司测序。
表1 密斑刺鲀和基因克隆以及组织分布的引物

Tab.1 Primers for cloning and distribution of gnrh2 and gnrh3
1.5 生物信息学分析
运用DNAstar软件预测密斑刺鲀和基因的开放阅读框序列, 翻译成氨基酸序列, 然后与其他脊椎动物GnRH蛋白前体序列进行同源比对。运用在线软件SignalP 4.1 Server (http://www.cbs.dtu.dk/ services/SignalP/)预测信号肽。运用SMART软件(http://smart.embl-heidelberg.de/)分析GnRH2和GnRH3的蛋白质结构。运用SoftBerry在线预测工具(http://linux1.softberry.com/berry.phtml? Topic = psite&group= programs & subgroup = proloc)预测GnRH2和GnRH3氨基酸序列的功能位点。运用Mega 7.0软件对密斑刺鲀的基因进行系统进化树分析。通过软件Swiss-model进行蛋白质三级结构进行预测与结构分析。
1.6 组织分布
以密斑刺鲀肌肉、精巢、垂体、肾脏、脑、肝脏、心脏、脾和鳃的cDNA作为模板, 进行PCR扩增, 完成和基因组织分布的半定量分析, 内参为基因。PCR体系为10 μL: 5 μL Taq酶, 0.4 μL上游引物, 0.4 μL下游引物, 0.4 μL cDNA模板, 3.8 μL双蒸水。目标基因PCR程序: 预变性95 °C、5 min; 变性95 °C、30 s, 退火59°C、30 s, 延伸72 °C、30 s, 共40个循环; 延伸72°C、10 min; 4 °C保存。PCR产物使用1.5%的琼脂糖凝胶电泳检测, 然后对电泳结果进行拍照, 完成半定量分析。
1.7 性腺组织学
将实验鱼经麻醉剂深度麻醉后, 快速取出卵巢, 参考经典石蜡切片的方法进行组织学分析(Chen, 2020)。根据性腺的发育时期进行样本的分析与归类。
1.8 实时荧光的定量
参照SYBR®Green Realtime PCR Master Mix (TOYOBO, Japan)试剂盒说明书准备反应体系, 利用RocheLight Cycler 480 real time PCR system检测和在下丘脑中的表达。具体反应程序为: 首先95 °C预变性1 min; 95 °C变性5 s, 58 °C退火10 s, 72 °C延伸20 s, 84 °C收集荧光10 s, 共40个循环; 溶解曲线: 95 °C 1 min, 52 °C 1 min, 95 °C延伸。每个样品3次重复, 目标基因的相对定量利用=2–∆∆Ct的方法进行计算, 并通过SPSS16.0数据分析软件进行统计分析。
2 结果
2.1 密斑刺鲀gnrh cDNA克隆及序列分析
2.1.1cDNA克隆及序列分析 本研究从密斑刺鲀中克隆得到基因的cDNA序列, 密斑刺鲀cDNA开放阅读框(ORF)共279 bp, 可编码92个氨基酸, 分子量为10.30 kDa。密斑刺鲀GnRH2前体蛋白由4部分组成: 信号肽(30个氨基酸)、GnRH2核心十肽(QHWSHGWYPG)、酶切位点(GKR)以及GnRH相关肽(49个氨基酸) (图1)。并预测GnRH2前体蛋白具有SCOP domain d1rype功能位点。
2.1.2基因的cDNA克隆及序列分析 本研究从密斑刺鲀中克隆得到基因的cDNA序列, 密斑刺鲀由325个核苷酸组成, cDNA开放阅读框(ORF)共270 bp, 可编码89个氨基酸, 分子量为9.94 kDa。密斑刺鲀GnRH3前体蛋白由4部分组成: 信号肽(23个氨基酸)、GnRH3核心十肽(QHWSYGWLPG)、酶切位点(GKR)以及GnRH相关肽(56个氨基酸)(图2)。并预测GnRH3前体蛋白具有SCOP domain d1oaca4以及d1kcgc两个功能位点。

图1 密斑刺鲀gnrh2基因开放阅读框序列及其推测的氨基酸序列

2.2 密斑刺鲀GnRH氨基酸序列比对及同源性分析
2.2.1 GnRH2的氨基酸序列比对及同源性分析 本实验采用Clustal X法对密斑刺鲀与其他物种GnRH2氨基酸序列进行比对。与密斑刺鲀GnRH2氨基酸序列作比较的物种有银大麻哈鱼()、大西洋鲑()、白鲑()、红点鲑()、虹鳟()、竹筴鱼()、铅点东方鲀()等13种动物。同源性分析结果发现密斑刺鲀GnRH2核心肽区域(QHWSHGWYPG)与其他物种具有极好的同源性(图3)。
2.2.2 GnRH3的氨基酸序列比对及同源性分析 本实验采用Clustal X法对密斑刺鲀与其他物种GnRH3氨基酸序列进行比对。与密斑刺鲀GnRH3氨基酸序列作比较的物种有莫桑比克罗非鱼()、革首南极鱼()、大弹涂鱼()、三刺鱼()、斑纹隐小鳉()、军曹鱼()等16种生物。同样, 同源性分析结果发现密斑刺鲀GnRH3核心肽区域(QHWSYGWLPG)与其他物种具有极好的同源性(图4)。
2.3 密斑刺鲀GnRH氨基酸序列其他功能位点预测
2.3.1 GnRH2氨基酸序列其他功能位点预测 利用SoftBerry在线预测工具预测GnRH2氨基酸序列的其他功能位点, 包括: 酪蛋白激酶II磷酸化位点、酰基化位点、酰胺化位点、内质网靶向序列、促性腺激素释放激素特征(表2)。
2.3.2 GnRH3氨基酸序列其他功能位点预测 利用SoftBerry在线预测工具预测GnRH3氨基酸序列的其他功能位点, 包括: N-糖基化位点、蛋白激酶C磷酸化位点、酪蛋白激酶II磷酸化位点、酰基化位点、酰胺化位点、微体C-末端靶向信号、促性腺激素释放激素特征(表3)。
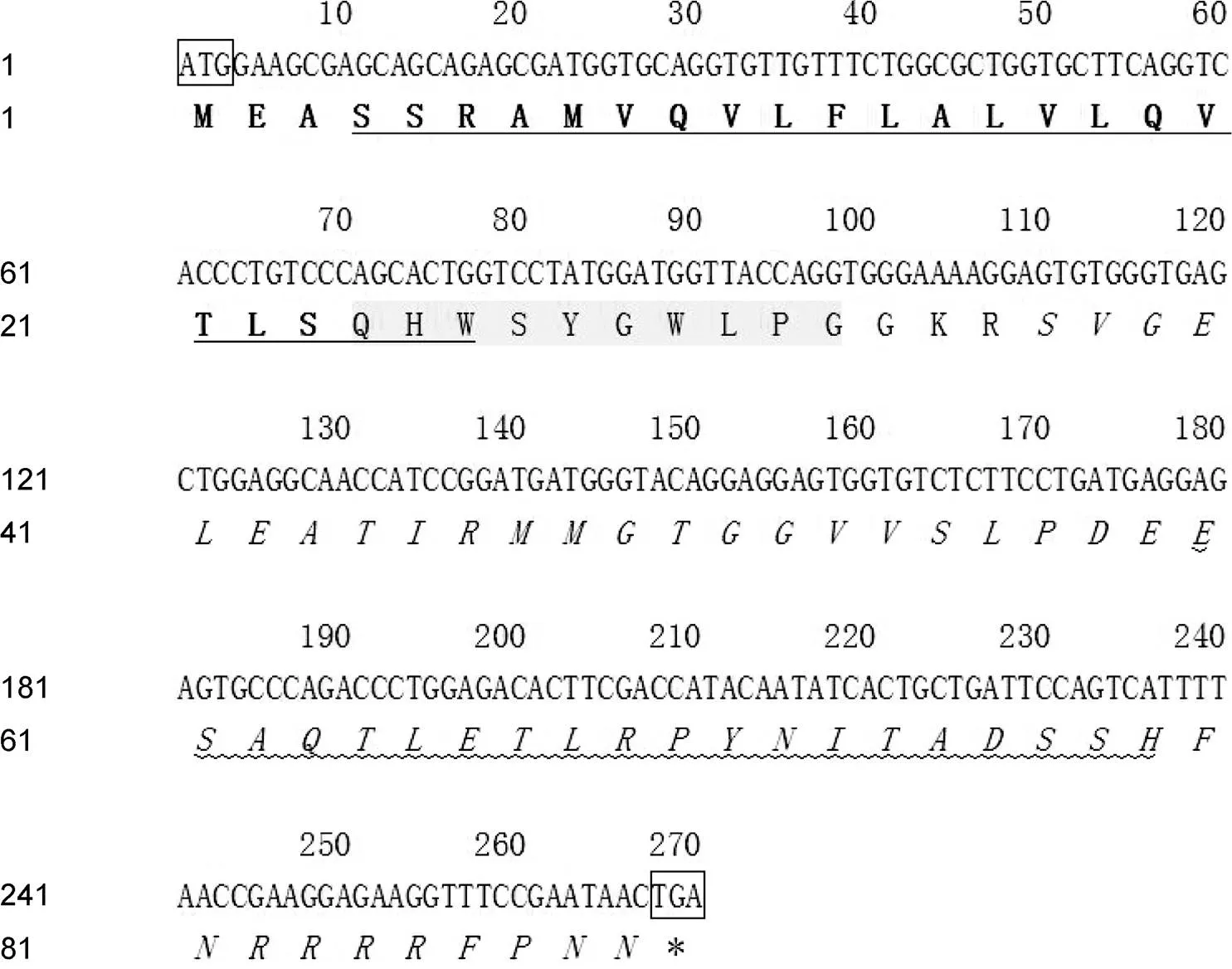
图2 密斑刺鲀gnrh3基因开放阅读框序列及其推测的氨基酸序列

2.4 密斑刺鲀GnRH2和GnRH3系统进化树分析
使用Mega7.0软件的邻位相连法(Neighbor-joining)构建GnRH蛋白系统发育树, 以确定密斑刺鲀GnRH2和GnRH3的进化关系。进化树分析结果显示, 密斑刺鲀GnRH2和GnRH3分别与其他物种的GnRH2和GnRH3聚类在一起, 其中密斑刺鲀GnRH2与竹筴鱼()、绿河鲀()、红鳍东方鲀()和铅点东方鲀()在一个分支上, 而密斑刺鲀GnRH3与虾虎鱼()和大弹涂鱼()在一个分支上, 结果表明: 与其他物种相比, 密斑刺鲀GnRH2与竹筴鱼、绿河鲀、红鳍东方鲀和铅点东方鲀有较近的亲缘关系, 而密斑刺鲀GnRH3与虾虎鱼和大弹涂鱼有较近的亲缘关系(图5)。
2.5 密斑刺鲀gnrh2和gnrh3基因的组织表达
本实验采用RT-PCR方法, 对密斑刺鲀和基因在脑、垂体、精巢、肌肉、肝脏、心脏、脾、肾脏和鳃组织的表达模式进行分析。电泳结果显示, 密斑刺鲀和基因在各组织中都有分布, 在脾、鳃和垂体中表达量较高, 在脑和精巢中表达量中等, 而在心脏表达量最低(图6)。
2.6 密斑刺鲀GnRH2和GnRH3蛋白质三级结构预测
构建GnRH2和GnRH3的蛋白质核心十肽的三级结构(图7)。结果表明密斑刺鲀GnRH蛋白质结构和人类的GnRH核心肽结构相同, 均呈现α螺旋, 其中密斑刺鲀的GnRH2与人类的mGnRH的结构更加相似。
2.7 密斑刺鲀gnrh2和gnrh3基因在性腺发育过程中的表达模式
根据密斑刺鲀的卵巢和精巢发育的特征进行发育时期的分期与归类, 分别获得密斑刺鲀卵巢和精巢的早、中和晚期3个发育阶段的下丘脑样本(图8), 每个时期5个样本(=5)。然后利用实时荧光定量的方法检测密斑刺鲀下丘脑中的和基因在不同性腺发育时期中的表达模式, 结果显示密斑刺鲀基因在卵巢和精巢不同的发育时期中没有显著性变化, 而基因随着性腺的发育成熟而不断升高(图9)。

图3 密斑刺鲀与其他物种GnRH2氨基酸序列的多重比对
注: 以上各物种在NCBI登录号:(银大麻哈鱼) XP_020349613.1,(大西洋鲑) XP_013987737.1,(白鲑) AAP57219.1,(红点鲑) XP_023847647.1,(虹鳟) NP_001117717.1,(竹筴鱼) AGP75910.1,(绿河鲀) BAE45690.1,(红鳍东方鲀) XP_003973604.1,(铅点东方鲀) BAJ07189.1,(斑马鱼) NP_852104.3,(草鱼) ACH78253.1,(青海湖裸鲤) ATO59775.1,(人) AAI15401.1
3 讨论
鱼类的生殖系统从不成熟转变为成熟的整个过程就是其性腺发育的过程, 整个生殖过程共分两个阶段, 首先是神经联系起主要作用, 是指感觉器官捕获外界刺激, 并将其传送到脑, 再通过神经联系传递到下丘脑; 接下来是下丘脑、垂体、性腺三个水平上的激素起主要作用, 下丘脑分泌促性腺激素释放激素(GnRH), 激发垂体分泌促性腺激素, 促性腺激素作用于性腺并促使其分泌性类固醇激素, 以促使性腺发育成熟并排出精子和卵子(王蕴, 2006)。

图4 密斑刺鲀与其他物种GnRH3氨基酸序列的多重比对
注: 以上各物种在NCBI登录号:(莫桑比克罗非鱼) AAO11648.1,(革首南极鱼) XP_010782456.1,(大弹涂鱼) XP_020776969.1,(三刺鱼) AFY12650.1,(黑海鲈) AHB89706.1,(虾虎鱼) BBD05664.1,(斑纹隐小鳉) XP_017287543.1,(蓝线鳍鱼) ABW86800.1,(许氏平鲉) AFS52223.1,(玉丽体鱼) ADV31311.2,(斑马鱼) NP_878307.2,(伯氏朴丽鱼) NP_001273267.1,(尖吻鲈) AGE13360.1,(军曹鱼) AAT80332.1,(点带石斑鱼) ACZ51151.1,(鲻鱼) AAQ83268.1
表2 GnRH2的其他功能位点

Tab.2 Other functional sites in GnRH2
表3 GnRH3的其他功能位点
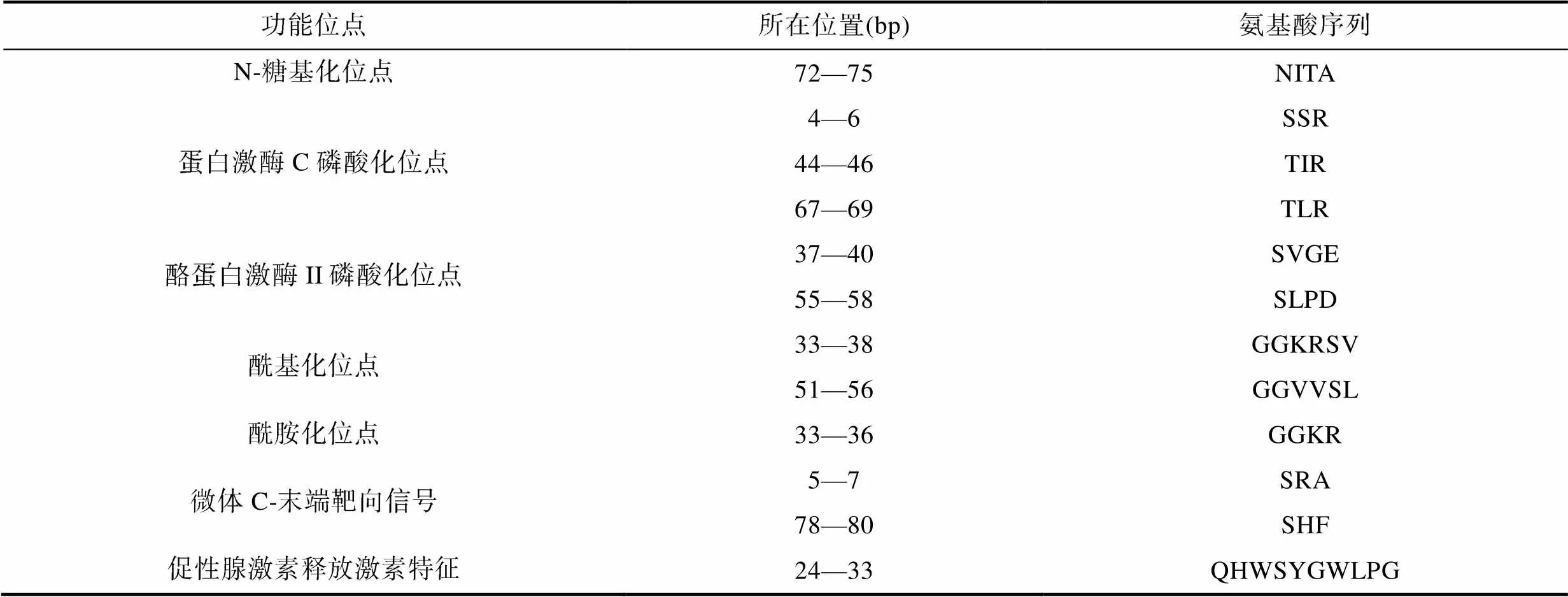
Tab.3 Other functional sites in GnRH3
本研究对密斑刺鲀的和基因进行克隆和分析, 并通过密斑刺鲀转录组文库和基因组数据比对, 发现密斑刺鲀只存在两种GnRH类型, 与其他鲀型目鱼类一样(Muñoz-Cueto, 2020)。利用软件预测密斑刺鲀和基因的开放阅读框序列, 翻译成氨基酸序列, 然后进行生物学信息分析。密斑刺鲀cDNA开放阅读框(ORF)共279 bp, 可编码92个氨基酸, GnRH2核心十肽(QHWSHGWYPG)位于31—40 aa位置, 具有SCOP domain d1rype功能位点; 密斑刺鲀cDNA开放阅读框(ORF)共270 bp, 可编码89个氨基酸, GnRH3核心十肽(QHWSYGWLPG)位于24—33 aa位置, 具有SCOP domain d1oaca4以及d1kcgc_两个功能位点。通过在线预测氨基酸序列功能位点, 密斑刺鲀GnRH2和GnRH3的核心十肽均被定义为促性腺激素释放激素特征。与其他脊椎动物GnRH蛋白前体序列进行同源比对, 结果发现密斑刺鲀GnRH2和GnRH3核心肽区域有极好的同源性, 这与其他物种的GnRH研究结果一致(吴旭等, 2005; 丁炜东等, 2006; 王滨等, 2017; Wang, 2019)。
表达量的组织分布结果显示, 密斑刺鲀和基因在各组织中都有分布, 在脾、鳃和垂体中表达量较高, 在脑和精巢中表达量中等, 而在心脏表达量最低。在经典理论中,主要在脑中表达(周晓苏, 2012), 在多种鱼类中也发现主要表达于脑部, 如: 圆斑星鲽() (柳学周等, 2013)、许氏平鲉() (周晓苏, 2012)、半滑舌鳎() (周晓苏, 2012)和金钱鱼() (Chen, 2020)。但有研究发现, 在多组织中有基因表达(Kovacs, 2001), 鱼类中鲽形目的牙鲆()在脑、胃、脾脏、眼、垂体、肌肉、肠、卵巢和肾脏中均有较高表达分布(房保海, 2006)。在不同组织中,具不同的生物学功能(Huang, 2001)。本研究发现密斑刺鲀和除了在脑和精巢外, 还在多组织中有表达, 说明密斑刺鲀和与生殖调控有关的同时还存在其他生物功能。
密斑刺鲀下丘脑的和基因在卵巢和精巢发育不同时期中的表达显示出不同的表达模式和特征。密斑刺鲀在卵巢和精巢发育不同时期中的表达没有显著性的变化, 从中暗示了可能不是调控密斑刺鲀性腺发育的主要类型。研究表明, 在虹鳟的性腺发育和成熟过程中, 检测到下丘脑有低浓度的mRNA表达, 但是整个发育过程的表达量变化不明显(Madigou, 2000), 结果与本文的研究结果相吻合。密斑刺鲀基因随着卵巢和精巢的发育成熟而不断显著升高, 与纵痕平鲉() (Collins, 2001)、真鲷() (Senthilkumaran, 1999)、大菱鲆() (Andersson, 2001)和金钱鱼(Chen, 2020)等鱼类的表达模式相类似, 从中表明GnRH3可能是密斑刺鲀生殖调节的主要GnRH亚型。

图5 GnRH系统进化树
注: 以上各物种在NCBI登录号: GnRH1:(美国红鱼) AAT80331.1,(大黄鱼) NP_001290285.1,(波纹绒须石首鱼) AAQ16501.2,(军曹鱼) AAT80334.1,(岩石斑鱼) AEI54997.1,(金眼狼鲈) AAY17516.1,(云纹犬牙石首鱼) AAV74401.1; GnRH2:(银大麻哈鱼) XP_020349613.1,(大西洋鲑) XP_013987737.1,(白鲑) AAP57219.1,(红点鲑) XP_023847647.1,(虹鳟) NP_001117717.1,(竹筴鱼) AGP75910.1,(绿河鲀) BAE45690.1,(红鳍东方鲀) XP_003973604.1,(铅点东方鲀) BAJ07189.1,(斑马鱼) NP_852104.3,(草鱼) ACH78253.1,(青海湖裸鲤) ATO59775.1,(人) AAI15401.1,(小鼠) AAI16898.1; GnRH3:(莫桑比克罗非鱼) AAO11648.1,(革首南极鱼) XP_010782456.1,(大弹涂鱼) XP_020776969.1,(三刺鱼) AFY12650.1,(黑海鲈) AHB89706.1,(虾虎鱼) BBD05664.1,(斑纹隐小鳉) XP_017287543.1,(蓝线鳍鱼) ABW86800.1,(许氏平鲉) AFS52223.1,(玉丽体鱼) ADV31311.2,(斑马鱼) NP_878307.2,(伯氏朴丽鱼) NP_001273267.1,(尖吻鲈) AGE13360.1,(军曹鱼) AAT80332.1,(点带石斑鱼) ACZ51151.1,(鲻鱼) AAQ83268.1; 黑三角表示研究的物种密斑刺鲀

图6 密斑刺鲀gnrh2和gnrh3基因在不同组织中的表达
注: G. 鳃, P. 垂体, T. 精巢, H. 心脏, S. 脾, K. 肾脏, B. 脑, L. 肝脏, M. 肌肉, NC. 空白对照

图7 人和密斑刺鲀GnRH蛋白质核心肽的三级预测结构
注: a. 人mGnRH蛋白质核心肽的三级预测结构; b. 密斑刺鲀GnRH 2核心肽的三级预测结构; c: 密斑刺鲀GnRH 3核心肽的三级预测结构
4 结论
综上所述, 本研究克隆获得了密斑刺鲀和基因的ORF序列, 并通过生物信息学分析, 密斑刺鲀GnRH2核心十肽(QHWSHGWYPG)和GnRH3核心十肽(QHWSYGWLPG)具有促性腺激素释放激素特征, 且在进化过程中表现出高度的保守性。和除了在密斑刺鲀脑和精巢有表达外, 还在多组织中有表达, 说明了和在密斑刺鲀中与生殖调控有关的同时还存在其他生物功能。此外, 进一步研究了密斑刺鲀和基因在卵巢和精巢发育不同时期中的表达模式, 表明了GnRH3可能是密斑刺鲀生殖调节的主要GnRH亚型。本研究通过对密斑刺鲀和基因的探索, 为密斑刺鲀的人工繁殖提供理论基础。

图8 密斑刺鲀的性腺发育组织切片图
注: a. 卵巢发育早期, b. 卵巢发育中期, c. 卵巢发育成熟期, d. 精巢发育早期, e. 精巢发育中期, f. 精巢发育成熟期。O1. 初级卵母细胞(primary-growth stage oocyte); O2. 皮层小泡卵母细胞(cortical-alveolus stage oocyte); O3. 卵黄形成卵母细胞(vitellogenic stage oocyte); SG. 精原细胞(spermatogonia); SCⅠ. 初级精母细胞(spermatocyteⅠ); SCⅡ. 次级精母细胞(spermatocyteⅡ); ST. 精子细胞(spermatid); SZ. 精子(spermatozoa)。标尺为200 μm

图9 密斑刺鲀gnrh2和gnrh3基因在性腺发育不同时期中的表达
注: a和b分别表示和基因在卵巢发育过程中的表达模式; c和d分别表示和基因在精巢发育过程中的表达模式。相对表达量用平均值±平均标准方差表示; 上标不同字母表示组间的显著性差异(<0.05,=5)
丁炜东, 曹丽萍, 李建林等, 2006. 奥利亚罗非鱼促性腺激素释放激素及相关肽基因的克隆与表达. 大连水产学院学报, 21(3): 207—211
马 军, 刘嘉鑫, 江智景等, 2020. 基于RNA-seq数据的密斑刺鲀SSR分子标记开发及鉴定. 南方水产科学, 16(1): 127—136
王 滨, 柳学周, 刘 权等, 2017. 半滑舌鳎()2基因克隆、组织分布及卵巢成熟过程中表达分析. 渔业科学进展, 38(1): 63—72
王 蕴, 2006. 鲤鱼()促性腺激素的纯化及其α亚基新转录本的发现. 武汉: 中国科学院研究生院(水生生物研究所)硕士学位论文
李婉茹, 张玲玲, 张美溦等, 2020. 海湾扇贝促性腺激素释放激素基因克隆及表达分析. 中国海洋大学学报(自然科学版), 50(2): 68—74
杨宪宽, 赵会宏, 林权卓等, 2015. 双棘黄姑鱼促性腺激素释放激素基因的克隆及系统进化分析. 水产科学, 34(4): 245—250
吴 旭, 陈宽维, 王金玉等, 2005. 促性腺激素释放激素及其基因表达调控. 黄牛杂志, 31(3): 49—52
张树芳, 2018. 中华绒螯蟹促性腺激素释放激素受体(GnRHR)同系物的克隆及其表达特征. 上海: 上海海洋大学硕士学位论文
陈 燕, 马 军, 郑 军等, 2019. 密斑刺鲀胶原蛋白的提取和成分分析. 海南热带海洋学院学报, 26(5): 12—17
周晓苏, 2012. 许氏平鲉和半滑舌鳎促性腺激素释放激素(GnRH)基因的克隆和表达分析. 青岛: 中国海洋大学博士学位论文
房保海, 2006. 牙鲆促性腺激素释放激素及其免疫影响的研究. 青岛: 中国海洋大学博士学位论文
柳学周, 徐永江, 廖梅杰等, 2013. 圆斑星鲽促性腺激素释放激素基因克隆及表达特性. 中国水产科学, 20(1): 12—24
Andersson E, Fjelldal P G, Klenke U, 2001. Three forms of GnRH in the brain and pituitary of the turbot,: immunological characterization and seasonal variation. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 129(2/3): 551—558
Bandyopadhyay S A, 2014. On the record of a spot-fin porcupine fish,(Linnaeus, 1758) from Mandarmani, Bay of Bengal Coast of West Bengal, India. Proceedings of the Zoological Society, 67(2): 175—177
Chen H P, Cui X F, Wang Y R, 2020. Identification, functional characterization, and estrogen regulation on gonadotropin-releasing hormone in the spotted scat,. Fish Physiology and Biochemistry, 46(5): 1743—1757
Collins P M, O’Neill D F, Barron B R, 2001. Gonadotropin-releasing hormone content in the brain and pituitary of male and female grass rockfish () in relation to seasonal changes in reproductive status. Biology of Reproduction, 65(1): 173—179
Huang W Q, Yao B, Sun L, 2001. Immunohistochemical andhybridization studies of gonadotropin releasing hormone (GnRH) and its receptor in rat digestive tract. Life Sciences, 68(15): 1727—1734
Kanda S, Nishikawa K, Karigo T, 2010. Regular pacemaker activity characterizes gonadotropin-releasing hormone 2 neurons recorded from green fluorescent protein-transgenic medaka. Endocrinology, 151(2): 695—701
Kovacs M, Schally A V, 2001. Comparison of mechanisms of action of luteinizing hormone-releasing hormone (LHRH) antagonist cetrorelix and LHRH agonist triptorelin on the gene expression of pituitary LHRH receptors in rats. Proceedings of the National Academy of Sciences of the United States of America, 98(21): 12197—12202
Madigou T, Mañanos-Sanchez E, Hulshof S, 2000. Cloning, tissue distribution, and central expression of the gonadotropin-releasing hormone receptor in the rainbow trout (). Biology of Reproduction, 63(6): 1857—1866
Muñoz-Cueto J A, Zmora N, Paullada-Salmerón J A, 2020. The gonadotropin-releasing hormones: lessons from fish. General and Comparative Endocrinology, 291: 113422
Okubo K, Nagahama Y, 2008. Structural and functional evolution of gonadotropin-releasing hormone in vertebrates. Acta Physiologica, 193(1): 3—15
Senthilkumaran B, Okuzawa K, Gen K, 1999. Distribution and seasonal variations in levels of three native GnRHs in the brain and pituitary of perciform fish. Journal of Neuroendocrinology, 11(3): 181—186
Somoza G M, Lescheid D W, Miranda L A, 2002. Expression of pejerrey gonadotropin-releasing hormone in three orders of fish. Biology of Reproduction, 67(6): 1864—1871
Tostivint H, 2011. Evolution of the gonadotropin-releasing hormone (GnRH) gene family in relation to vertebrate tetraploidizations. General and Comparative Endocrinology, 170(3): 575—581
Trevett A J, Mavo B, Warrell D A, 1997. Tetrodotoxic poisoning from ingestion of a porcupine fish () in Papua New Guinea: nerve conduction studies. American Journal of Tropical Medicine and Hygiene, 56(1): 30—32
Wang W Q, Chen J, Fang Y, 2019. Identification ofandand their expression during brood pouch growth and short-term benzo(a)pyrene exposure in lined seahorse (). Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 225: 108579
Wirsig-Wiechmann C R, 2001. Function of gonadotropin-releasing hormone in olfaction. The Keio Journal of Medicine, 50(2): 81—85
Zohar Y, Muñoz-Cueto J A, Elizur A, 2010. Neuroendocrinology of reproduction in teleost fish. General and Comparative Endocrinology, 165(3): 438—455
CLONING AND EXPRESSION OFGENE IN
CHEN Hua-Pu1, HUANG Chun-Ren2, HE Rui-Qi1, DAI Ming-Shu1, ZHANG Ming-Zhen1, LI Zhi-Yuan1, HUANG Hai3, LI Guang-Li1
(1. Guangdong Research Center on Reproductive Control and Breeding Technology of Indigenous Valuable Fish Species, Guangdong Provincial Engineering Laboratory for Mariculture Organism Breeding, Fisheries College, Guangdong Ocean University, Zhanjiang 524088, China; 2. Hainan Chenhai Aquatic Products Co., Ltd, Sanya 572000, China; 3. Key Laboratory of Utilization and Conservation for Tropical Marine Bioresources, Ministry of Education, Hainan Key Laboratory for Conservation and Utilization of Tropical Marine Fishery Resources, Hainan Tropical Ocean University, Sanya 572022, China)
is an edible fish with commercial value and additional value for traditional Chinese medicine and health care. However, studies on its endocrinology and artificial breeding are few, which hinders the practice of artificial breeding. It is known that gonadotropin-releasing hormone (GnRH) is a key regulation factor of reproduction. In the present study, two subtypes ofgenes, named asand, were cloned form the brain ofby transcriptome analysis and molecular cloning. Results show that the open reading frame (ORF) ofgene cDNA was 279 bp, encoding 92 amino acids, and the ORF ofgene cDNA was 270 bp, encoding 89 amino acids. The phylogenetic analysis showed thatGnRHs are closely related to the GnRHs of pufferfish family.andgenes were expressed under different levels in all the detected tissues with semi-quantitative polymerase chain reaction (PCR) method, showing the lowest expressions in heart and the rather high expressions in spleen, gill, and pituitary. Furthermore, real-time quantitative PCR was used to detected the expression profiles ofandgenes during the ovarian and testicular developments, showing no significant change in the expressions ofin both of ovarian and testicular developments, while the expression ofshowed gradual significant increase with the maturation processes of ovarian and testicular. Two important facts were revealed in this study. First, twogenes (and) were confirmed in; and secondly, thegene was the maintype of reproductive regulation in. The present study provides a reference for future study on the mechanism of the reproductive endocrine regulation in.
; GnRH; molecular cloning; tissue distribution
* 海南省重点研发计划项目, ZDYF2018225号; 热带海洋生物资源利用与保护教育部重点实验室2020年开放课题, UCTMB20201号; 海南省重大科技计划项目, ZDKJ2016009号; 海南热带海洋学院2016年学科带头人和博士研究生科研启动项目, RHDXB201612号。陈华谱, 博士, E-mail: chpjwx@163.com
李广丽, 教授, E-mail: ligl@gdou.edu.cn
2021-01-25,
2021-02-28
S965.3
10.11693/hyhz20210100022
