抗增殖蛋白2在皮肤鳞状细胞癌中的表达及其对A431细胞增殖的影响
2021-07-22孔晓芸张冬梅崔恒祥刘念念
孔晓芸 缪 旭 张冬梅 崔恒祥 施 健 刘念念
南通大学第二附属医院,江苏南通,226000
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma, CSCC)起源于表皮或附属器角质形成细胞,是最常见的皮肤恶性肿瘤之一,占所有皮肤恶性肿瘤的20%[1],具有较强的迁移力和侵袭性。日光性角化病(actinic keratosis, AK)被认为是CSCC的癌前病变,鲍温病(Bowen’s disease, BD)则是表皮全层角质形成细胞不典型增生的原位CSCC[2],两者均可向CSCC转化。CSCC的病因主要包括紫外线辐射、免疫抑制、HPV感染等,目前局部外科手术为最常用的治疗方法[3],但部分患者存在复发、转移和死亡的不良预后,并且其发病率呈逐年增加的趋势,因此对于CSCC的治疗在临床中仍然面临挑战。抗增殖蛋白2(prohibitins 2, PHB2)属于抗增殖蛋白家族,是一类高度保守并广泛表达的蛋白,具有多种生物学功能,包括转录调节、维持线粒体功能、调节细胞增殖等[4],并且在食管鳞状细胞癌、非小细胞肺癌、乳腺癌、前列腺癌等恶性肿瘤中已有相关研究[5-8],证实了PHB2在癌症组织及细胞中存在差异表达,并参与多种肿瘤发生发展的生物学过程,而对于PHB2在CSCC中的研究国内外尚未见相关报道。CSCC是具有高度突变性的人类癌症之一,其致病相关分子基础的研究有助于我们更深入地了解并开发新的治疗靶点。蛋白激酶B(protein kinase B, PKB/AKT)的过度活化是人类恶性肿瘤的常见分子特征,研究发现AKT和PHB2在细胞内定位及功能中存在重叠,参与不同肿瘤发展过程。本研究通过免疫组织化学的方法研究了PHB2在CSCC、BD、AK以及正常皮肤组织(normal tissue, NT)中的表达情况,分析其在CSCC中的表达与临床资料的相关性,并研究了PHB2敲除对CSCC细胞A431细胞增殖的影响,对AKT的蛋白表达及其磷酸化产物水平进行分析,以初步阐述这种调控效应产生的分子机制,为CSCC的靶向治疗提供可能的理论基础。
1 材料和方法
1.1 研究对象 收集2015年3月至2020年8月南通大学第二附属医院皮肤科资料完整且病理诊断明确的标本蜡块,其中AK组织17例,BD组织18例,CSCC组织40例,NT 9例,所有患者术前均未经过放疗、化疗或光动力等治疗,记录患者一般信息,CSCC组织病理分级为高、中、低分化,Broder分级为I至IV级:I级,未分化细胞数<25%;II级,未分化细胞数25%~50%;III级,未分化细胞数50%~70%;IV级,未分化细胞数>70%。
1.2 主要试剂 免疫组化试剂盒(#SP-9000,北京中杉金桥),人CSCC细胞株A431(#ZQ0043,上海中乔新舟),兔抗人PHB2多克隆抗体(#12295-1-AP,武汉Proteintech)、鼠抗β-actin抗体(#20536-1-AP,武汉Proteintech),CCK8试剂盒(#PF00004,武汉Proteintech),AKT抗体(#9272s,美国CST),p-AKT抗体(#4060L,美国CST),DMEM培养基(#C11995500BT,美国Gibco),0.25%胰蛋白酶(#25200-056,美国Gibco),胎牛血清(#A511-001,乌拉圭lonsera),100 U/mL青霉素和100 g/L链霉素双抗(#C0222,江苏碧云天)、蛋白上样缓冲液(2×)(#P0015B,江苏碧云天)、化学发光试剂盒(#P0018S,江苏碧云天)、嘌呤霉素(#ST551,江苏碧云天),PAGE凝胶快速制备试剂盒(#PG113,上海雅酶),Lipofectamine 2000试剂(#11668019,美国Invitrogen),质粒小提试剂盒(#D6943-03,美国Omega),胶回收试剂盒(#D0056,江苏碧云天),EcoRI限制性核酸内切酶(#R3101S,美国Biolab),CutSmart Buffer(#B7204S,美国Biolab),6xDNA上样染料(#R1161,美国Thermo Scientific),T4 DNA连接酶(#D2011A,日本Takara)。人胚肾细胞HEK293T、感受态细胞DH5α、慢病毒载体系统lentiCRISPR v2、psPAX2、pMD2.G均为本实验室保存。
1.3 主要仪器 切片机(RM2245,德国Leica),烘片机(HI1220,德国Leica),摊片机(HI1210,德国Leica),离心机(5424R,德国Eppendorf),电热恒温鼓风干燥箱(DK-500S,上海精宏)、电热恒温水浴箱(DK-500S,上海精宏),显微镜(ECLIPSE Ni-U,日本Nikon),蛋白电泳仪(PowerPac Basic Power Supply,美国BIO-RAD),凝胶采集成像系统(Chemi Doc MP,美国BIO-RAD)、PCR仪(T100,美国BIO-RAD),电热恒温细胞培养箱(HERACELL 240i,美国Thermo Scientific),微量分光光度计(Nanodrop one,美国Thermo Scientific),摇床(TS-92,江苏其林贝尔),恒温金属浴仪(#K30,北京佳源兴业),震荡培养箱(ZQZY-85CN,上海知楚),多功能微孔板检测仪(H1M,美国Biotek)。
1.4 实验方法
1.4.1 免疫组织化学染色 切片机切取4 μm厚石蜡组织切片,粘贴于载玻片上,60℃烘箱烘片30 min,经松节油、梯度浓度酒精脱蜡后于柠檬酸盐溶液中进行高压抗原修复,冷却后PBS冲洗3次,滴加过氧化物酶封闭30 min,PBS冲洗3次,甩干后滴加PHB2抗体,4℃湿盒孵育过夜,次日室温复温1 h,滴加二抗,37℃烘箱放置30 min,PBS冲洗3次,DAB显色,苏木素复染,盐酸乙醇分化,自来水冲洗,经梯度浓度酒精脱水、松节油透明,中性树胶封片。
1.4.2 判读方法 免疫组织化学结果采用半定量评分法。将染色后的切片置于显微镜下观察,在40倍物镜下随机挑选5个视野,计数阳性细胞百分比(<25%为1分、25%~50%为2分、51%~75%为3分、>75%为4分)及染色强度(无色为0分、淡黄色为1分、黄色为2分、棕黄色或棕色为3分),两者乘积即为其免疫组织化学评分,按其评分分为阴性(-,0~3分),弱阳性(+,4~6分),阳性(++,7~9分),强阳性(+++,10~12分)。其中阴性、弱阳性表达按低表达计,阳性、强阳性表达按高表达计。
1.4.3 gRNA设计 利用NCBI获得PHB2完整基因序列,利用CRISPER线上设计工具依据设计原则[9],最终选择该基因的299 bp及320 bp起始的序列作为sgRNA构建两组敲除PHB2-sgRNA表达质粒。设计序列分别为:sgRNA-KO299 5'-GGGAGATATTCACCATCTGT-3';sgRNA-KO320 5'-TGGGTCGAGACAACACTCGC-3'。开始碱基不是G,则在最前加入碱基G,在正向序列前加入碱基CACC,在反向序列前加入碱基AAAC。
1.4.4 表达载体构建 由擎科生物公司合成sgRNA,将引物经过退火后,形成具有黏性末端的双链DNA,利用EcoRI核酸内切酶得到酶切产物,经凝胶电泳鉴定、胶回收,得到gRNA/cas9质粒与双链DNA进行连接,连接产物转化大肠杆菌,摇菌、培养获得单克隆,质粒小提试剂盒提取重组质粒获得重组表达载体lentiCRISPRv2-PHB2-KO。
1.4.5 细胞培养 将A431细胞培养于含10%胎牛血清的DMEM培养液中,放入37℃、5% CO2的培养箱中,定期换液。
1.4.6 嘌呤霉素浓度筛选 在6孔板内每孔种1.5×105个293T细胞,次日起更换按照浓度梯度(0.4 μg/mL、0.6 μg/mL、0.8 μg/mL、1.0 μg/mL、1.2 μg/mL、1.5 μg/mL)制备的含有嘌呤霉素的完全培养基,将3天后细胞全部死亡的剂量作为嘌呤霉素筛选浓度。
1.4.7 细胞转染 取对数生长期293T细胞移植于培养皿中,待细胞生长至融合度达80%以上时,转染按照Lipofectamine 2000操作说明,将慢病毒gRNA/cas9载体(Addgene-52961,Zhangfeng Lab)包装质粒psPAX2和pMD2.G一起转染到293T细胞中,6~8 h后换液。
1.4.8 细胞感染及筛选 取对数生长期A431细胞移植于培养皿中,待细胞生长至融合度达40%~50%时,开始进行感染。293T细胞转染48 h后,用0.45 μm分离的滤器过滤,收集含病毒上清,每个10 cm培养皿中加10 mL含病毒上清液,加入嘌呤霉素(根据预实验最佳筛选浓度1.0 μg/mL)进行药物筛选。
1.4.9 CCK8细胞计数实验 取感染筛选后A431细胞(PHB2敲除组与对照组)分别移植于96孔板,细胞数为3000个/孔,继续培养24 h,每孔加入10 μL CCK8溶液,培养箱内孵育2 h,酶标仪测定450 nm处的OD值。实验重复3次。
1.4.10 细胞克隆形成实验 取感染筛选后A431细胞(PHB2敲除组与对照组)分别移植于35 mm培养皿,细胞数为50个/皿,继续培养2周,肉眼观察培养皿中出现克隆后中止培养,弃去培养基,PBS洗涤,4%多聚甲醛固定,0.1%结晶紫染色,计算克隆形成数。实验重复3次。
1.4.11 免疫印迹检测蛋白表达 取蛋白质样品进行聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,脱脂奶粉封闭,膜使用相应一抗4℃孵育过夜,TBST漂洗3次,加入二抗室温孵育1 h,TBST漂洗3次,暗室显影,采用Image J分析软件处理,测定各组蛋白条带灰度值,以目的条带和内参条带的比值作为蛋白表达水平(或p-AKT和AKT条带的比值)。每个蛋白样品重复3次。
2 结果
2.1 PHB2在CSCC、BD、AK及NT组织中的表达情况 免疫组织化学染色结果显示,PHB2的表达定位大多位于细胞核,少量定位于胞质中。在NT中PHB2少量表达于表皮基底层细胞中,在AK中主要表达于基底层及棘层中下1/3细胞的细胞中,在BD中主要表达于表皮全层非典型性增生角质形成细胞中,在CSCC中主要在鳞状细胞癌巢中弥漫表达(图1a)。根据阳性细胞百分比及染色强度进行免疫组化组织学评分,并把阳性、强阳性表达定义为高表达,PHB2在CSCC、BD、AK及NT组织中的高表达率依次为90.00%、66.70%、41.18%、0.00%(图1b),可见PHB2的表达在四组之间呈现逐渐递增的表达趋势,有统计学差异(P<0.01),见表1。接下来对两两组间进行表达强度比较,结果提示AK与NT、BD与NT、CSCC与NT以及AK与CSCC之间表达强度差异有统计学意义(P<0.05),说明了PHB2在CSCC、BD、AK组织中的表达均显著高于NT组织,并且CSCC组织中的表达显著高于AK组织,见表2。
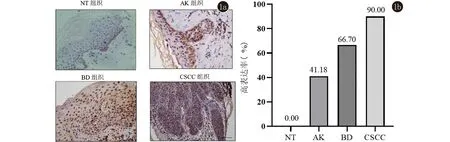
1a:免疫组化结果(SP法,×400);1b: PHB2在四组中的高表达率
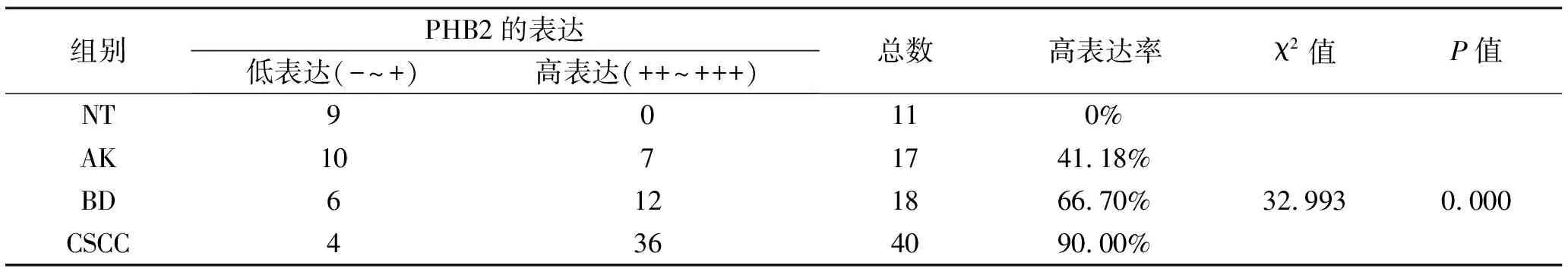
表1 PHB2在NT、AK、BD、CSCC组织中的表达差异
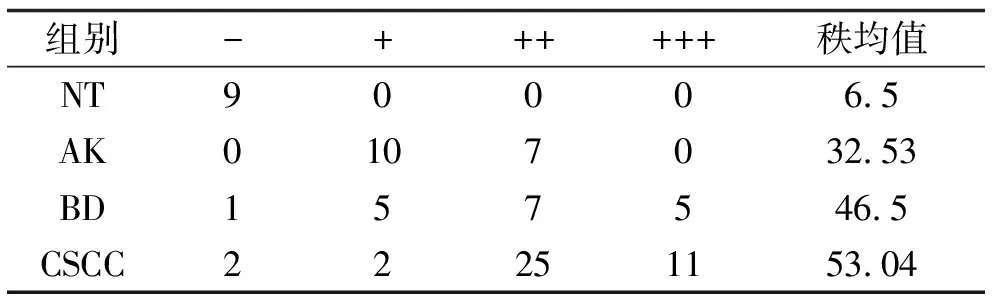
表2 PHB2在NT、AK、BD、CSCC组织中的表达强度比较
2.2 PHB2在CSCC中的表达与临床病理参数相关性 PHB2表达与性别、年龄、部位、病程、肿瘤直径、浸润深度、分化、Broder分级等临床病理资料均无显著相关性(P>0.05),见表3。
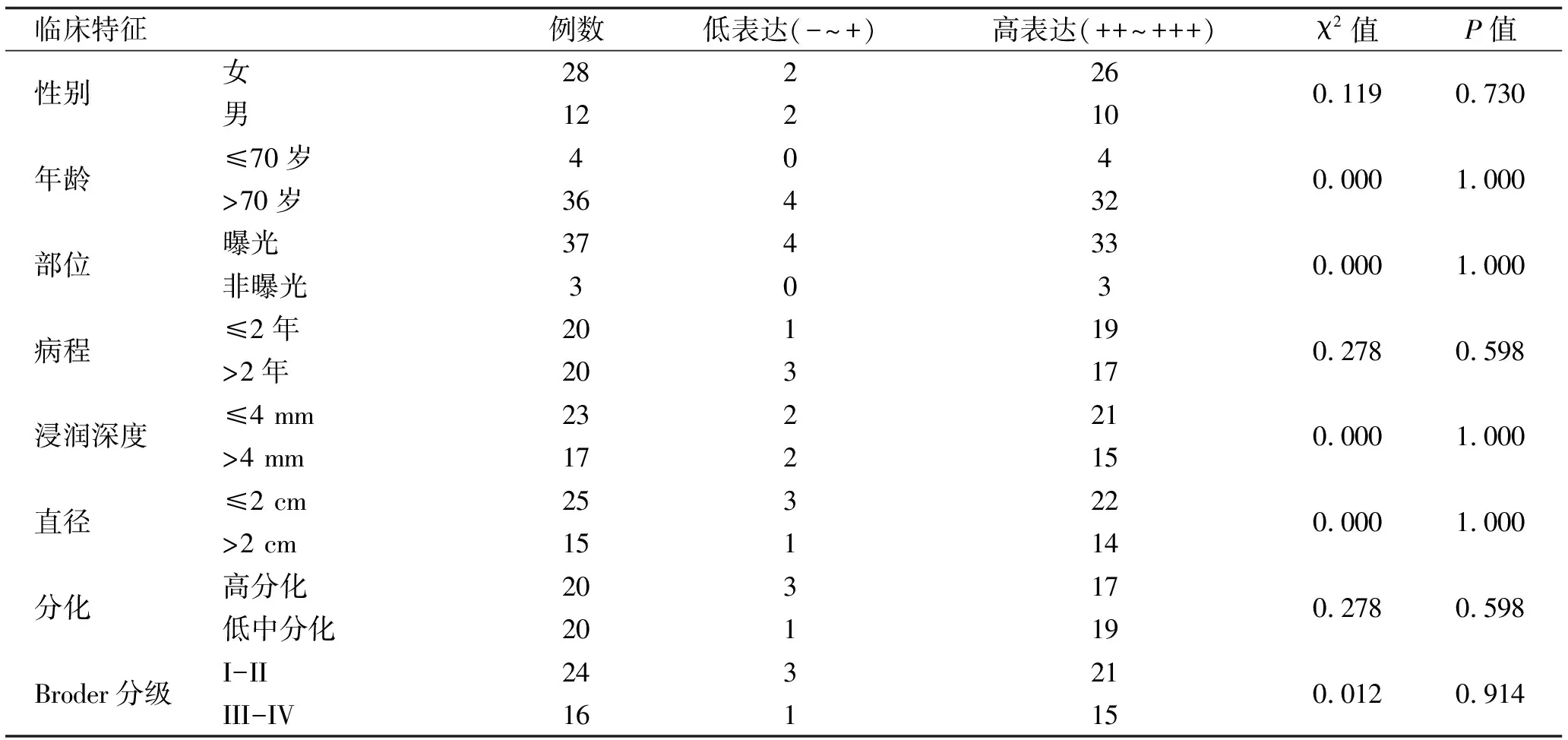
表3 CSCC组织标本中PHB2的表达与临床特征的关系
2.3 构建PHB2敲除的CSCC细胞A431细胞 运用CRISPR-Cas9系统构建了两组靶向敲除PHB2的CSCC A431细胞(KO299组以及KO320组),以空载体转染的NC组为对照细胞。Western印记结果显示,NC组与KO299组PHB2与内参β-actin比率为1.478±0.276和0.461±0.165,t=5.485,P<0.01;NC组与KO320组PHB2与内参β-actin比率为1.565±0.413和0.658±0.070,t=3.752,P<0.05,均有统计学差异,验证了PHB2的敲除效果,见图2。
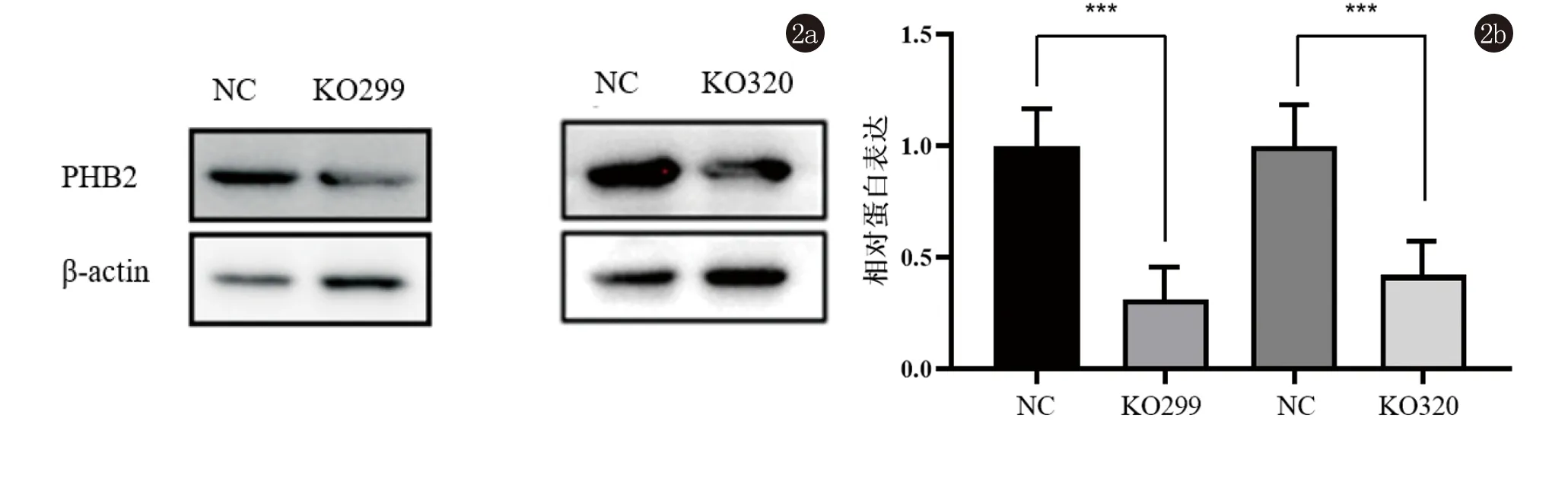
图2 Western印迹法分析PHB2蛋白在敲除组与对照组细胞中的表达情况(***,P<0.05)
2.4 PHB2敲除对CSCC细胞A431细胞增殖的影响 通过CRISPR-Cas9法构建了两组靶向敲除PHB2的CSCC细胞A431细胞模型(KO299组以及KO320组),以空载体转染的NC组为对照细胞。CCK8细胞增殖实验结果显示,细胞培养24 h后,NC组细胞相对活力为0.996±0.144,两组敲除组中,KO299组细胞相对活力为0.339±0.023,与NC组比较A431细胞活力显著下降,t=7.820,P<0.01;KO320组细胞相对活力为0.475±0.079,与NC组比较A431细胞活力显著下降,t=5.502,P<0.01,见图3。细胞克隆形成实验结果显示,细胞培养2周后,NC组细胞克隆形成数为139.333±24.947,两组敲除组中,KO299组细胞克隆形成数为41.667±5.132,与NC组比较细胞克隆形成数显著下降,t=6.642,P<0.01;KO320组细胞克隆形成数为42.667±9.292,与NC组比较细胞克隆形成数显著下降,t=6.290,P<0.01,见图4。

图3 CCK8细胞增殖实验验证PHB2敲除对A431细胞增殖的影响(***,与NC组比较P<0.01)图4 细胞克隆形成实验验证PHB2敲除对A431细胞增殖的影响(***,与NC组比较P<0.01)
2.5 PHB2敲除对AKT蛋白磷酸化的影响 Western印迹结果验证了NC组与KO299组之间的p-AKTSer473/AKT比率分别为1.319±0.283和0.387±0.081,t=5.472,P<0.01;NC组与KO320组之间的p-AKTSer473/AKT比率分别为1.383±0.242和0.648±0.031,t=5.221,P<0.01,初步说明了p-AKT表达随PHB2表达水平的降低而显著下调,见图5。
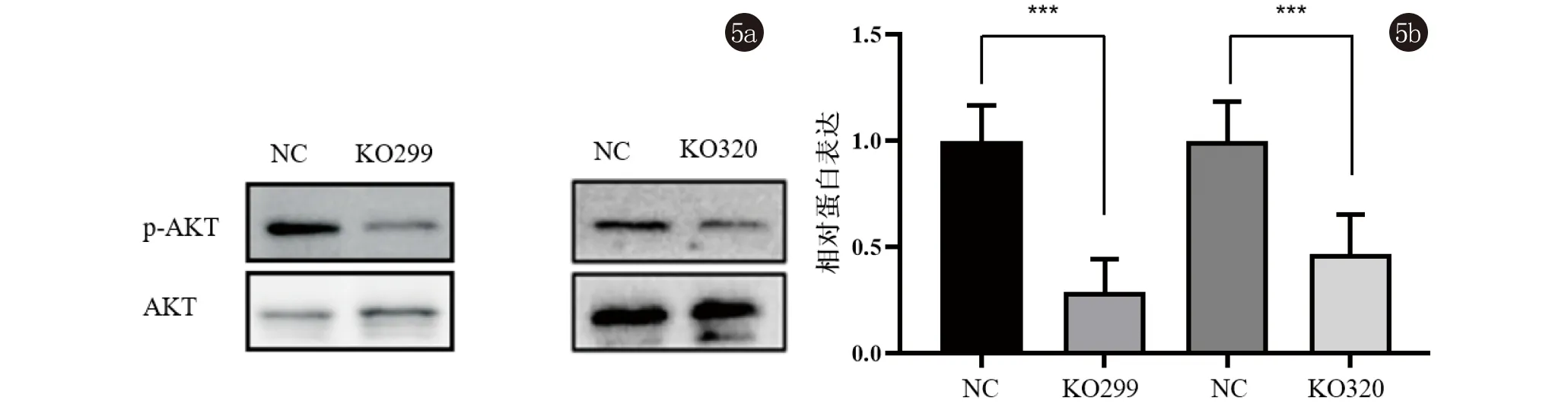
图5 Western印迹法分析PHB2敲除对A431细胞AKT蛋白表达及其ser473位点磷酸化产物水平的影响(***,P<0.01)
3 讨论
抗增殖蛋白家族包括PHB1以及PHB2,均在生物体细胞内分布广泛,包括细胞核、线粒体和细胞质,不同的亚细胞定位使其表现出独特的生物学功能,在调节转录、核信号传导、维持线粒体结构与功能、细胞增殖与凋亡中产生重要作用,在癌症、神经肌肉病变和其他代谢性疾病等病理过程中发挥关键调节因子的作用[10-12]。目前,PHB2对于肿瘤的调控机制尚存在争议,一种解释是肿瘤细胞通过提高线粒体呼吸作用维持能量代谢,导致线粒体受到氧化损伤,而线粒体中PHB2的增加提高了肿瘤细胞线粒体的稳定性,另一种解释则是细胞核定位的PHB2可以直接或间接调节转录因子,调控肿瘤细胞增殖、凋亡、细胞周期等[4]。来自癌症基因组图谱和人类蛋白质图谱的数据表明,PHB2在食管鳞癌、前列腺癌、非小细胞肺癌等肿瘤中均在mRNA和蛋白质水平上广泛表达,促进相关肿瘤的发生发展。
在食管鳞状细胞癌中,2018年Cai等[5]对229例患者通过免疫组织化学证实了肿瘤组织中的PHB2表达明显高于癌旁组织,临床病理特征中,PHB2的表达与年龄、性别、肿瘤分化、TMN分期等因素无关,高水平的PHB2表达与总生存期相关,提示PHB2的低表达可能提高了食管鳞癌患者的总生存期。本研究中,我们对CSCC、BD、AK组织石蜡切片进行免疫组织化学染色,观察到了PHB2主要的胞核以及少量胞质定位,在CSCC癌巢细胞中呈现弥漫表达,其表达与正常组织之间有显著差异。此外,AK及BD作为临床上有可能向CSCC演化的疾病,其组织中PHB2表达也高于正常组织。在临床病理资料方面,我们结果表明PHB2与年龄、性别、肿瘤直径及分化程度等临床病理特征没有显著相关,我们推测其可能原因是PHB2与CSCC的发生相关,而不参与其恶性发展,需后期扩大样本量进一步证实。
PHB2在许多肿瘤细胞如食管鳞癌、乳腺癌、前列腺癌等中高表达[5,7,8],在肝细胞癌细胞中,PHB2的表达在肿瘤早期上调,而在晚期表达下调[13]。在细胞生物学功能方面,已有研究通过siRNA建立PHB2敲减的食管鳞癌细胞模型,细胞计数和transwell实验证实了PHB2的敲减可以抑制肿瘤细胞的增殖和侵袭能力[5]。在2017年Shen等[8]对前列腺癌的研究中,以siRNA干扰PHB2表达,通过细胞划痕及transwell实验证实了PHB2的表达敲减可以抑制肿瘤细胞的迁移。在CSCC中,通过CCK8细胞增殖实验和细胞克隆形成实验,我们同样发现PHB2敲除后,A431细胞的增殖能力显著降低,此结果初步证实了PHB2与CSCC的发生相关。
AKT是PI3K/AKT信号转导通路中重要的蛋白激酶,为PI3K下游的靶分子之一,Ser473是其主要的磷酸化位点之一[14],其在细胞存活和凋亡中起重要作用,研究证实,AKT相关通路的激活在CSCC发生发展中起重要作用[15]。值得注意的是AKT和PHB2在细胞内定位以及调节细胞功能过程中存在一些重叠,表明它们之间可能存在潜在的功能相关性。在食管鳞癌中,PHB2通过增加p-AKT的表达促进了肿瘤细胞的增殖和转移[5]。在前列腺癌中,已有研究证实了PHB2可能通过抑制AKT2的表达来促进肿瘤细胞迁移[8]。在CSCC的A431细胞中,我们的研究发现,PHB2敲除抑制了肿瘤细胞增殖能力,并且p-AKT表达显著降低,因此,PHB2可能通过调节AKT蛋白活化从而影响CSCC的发生。
综上所述,PHB2在CSCC组织中较正常组织表达上调,可能与CSCC的发生相关。此外,PHB2可以促进CSCC肿瘤细胞增殖,其机制可能与促癌基因AKT蛋白活化相关。本研究为CSCC的治疗靶点提供了理论基础,但需进一步扩大临床样本量、就分子机制进行更加深入的研究,为设计具有临床价值的治疗CSCC的靶向药物奠定基础。
