524例青春期后女性痤疮患者的性激素和血脂分析
2021-07-22郭独一杨诗源张春雷
郭独一 任 昀 杨诗源 张春雷 姜 薇
北京大学第三医院,北京,100191
皮肤是一种内分泌器官,可合成多种激素和激素受体。目前,按性激素的化学结构和临床功能可将其大致分为三类:类固醇激素,如雄激素、雌激素、孕激素;糖蛋白类激素,如促黄体生成素(luteinizing hormone, LH)、促卵泡生成素(follicle-stimulating hormone, FSH)、促性腺激素释放激素;肽类激素,如催乳素(prolactin, PRL)、缩宫素等[1]。皮脂腺是皮肤中雄激素代谢和作用的主要场所,常见的雄激素包括睾酮(testosterone, TT)、雄烯二酮(4-androstene-3-17-dione, A4)、硫酸脱氢表雄酮(dehydroepiandrosterone sulfate, DHEAS)等。雄激素与痤疮的发病密切相关,多囊卵巢综合征被认为是青年女性痤疮患者中高雄激素血症最常见的病因[2]。除雄激素以外,其他性激素在痤疮发病中的作用尚不清楚。近年来,雄激素与肥胖和血脂的关系也逐渐得到关注,有研究指出雄激素在降低血脂和肥胖的风险方面发挥着一定作用[3]。虽然既往已有部分研究探讨了痤疮、性激素和血脂的关系,但直接证据仍较匮乏。本研究旨在通过大样本研究,从多个角度分析青春期后女性痤疮患者临床、性激素和血脂的关联,丰富痤疮的病因学理论,为其内分泌或代谢诊疗提供更多线索。
1 资料与方法
1.1 临床资料 我们于2019年3月至2020年8月在北京大学第三医院皮肤科门诊连续收集了青春期后(18~30岁)女性寻常痤疮患者524例,同时从我院体检中心连续收集50名年龄、性别相匹配,无痤疮和多囊卵巢综合征病史的健康女性作为对照。聚合性痤疮,玫瑰痤疮,化妆品、润油剂、药物等所致的特殊类型的痤疮已被除外,所有研究对象均无吸烟、慢性失眠、肝脏疾病、恶性肿瘤、内分泌疾病(如甲状腺疾病、库欣综合征)或妇科肿瘤等疾病。怀孕、哺乳期或在6个月内口服激素、抗生素或异维A酸等药物治疗痤疮者均被除外。我们详细记录了所有受试者的病史并对其进行全面的体格检查,包括身高、体重和腰围(呼气末髋骨以上的腹围),计算身体质量指数(BMI)=体重(kg)/身高2(m2),根据中国成人超重和肥胖症预防与控制指南[4],将BMI<18.5 kg/m2定义为偏瘦组,18.5 kg/m2≤BMI<24 kg/m2定义为正常组,由于青年女性肥胖人数较少,故将BMI≥24 kg/m2统一归为超重组。采用全球痤疮分级系统(Global Acne Grading System, GASS)[5]评估痤疮患者前额、左颊、右颊、鼻部、下颌和胸部/上背部六个部位的痤疮严重程度,每个部位以0~4分进行分级,该部位内最严重的皮损决定局部评分,总体评分是六个部分评分加权后的总和。所有患者均接受了盆腔超声检查,根据鹿特丹诊断标准[6],符合以下两项及以上特征者即可诊断为多囊卵巢综合征(polycystic ovarian syndrome, PCOS):(1)高雄激素的临床和(或)生化表现;(2)稀发排卵或无排卵;(3)超声检查提示卵巢体积≥10 mL,和(或)直径2~9 mm的卵泡数≥12个。
采集受试者及健康对照者早期卵泡期(自发月经出血后第1~4天)空腹血样,检测其甘油三酯(triglyceride, TG)、高密度脂蛋白(high-density lipoprotein cholesterol, HDL-C)、PRL、FSH、LH、TT、A4和DHEAS浓度。本研究已获得北京大学第三医院伦理委员会批准,所有参与者均签署知情同意书,同意入组并将血液标本用于本研究。
1.2 统计学方法 采用Kolmogorov-Smirnov检验分析连续变量的正态性。正态分布参数采用均值±标准差表示,使用单因素方差分析(ANOVA)和LSD事后检验分析不同组间参数的差异。非正态参数采用中位数和四分位数表示,使用Kruskal-Wallis检验(Bonferroni校正)检测不同组间的差异。轻、中、重度痤疮患者中多囊卵巢综合征的患病率差异采用卡方检验。本研究使用SPSS 24.0统计软件进行统计分析,P<0.05为差异有统计学意义。
2 结果
在524例痤疮患者中,轻、中、重度痤疮患者分别为239例、207例和78例,三组痤疮患者和健康对照的临床特征及激素水平见表1。各组研究对象在年龄、身高方面无统计学差异。重度痤疮患者的体重和BMI显著高于中度痤疮患者,腰围和TG显著高于轻、中度痤疮患者。三组痤疮患者的PRL、A4和DHEAS水平均显著高于健康对照,且中、重度痤疮患者的A4水平显著高于轻度痤疮患者。轻、重度痤疮患者的FSH水平显著高于健康对照。轻、中、重度痤疮患者中PCOS的患病率分别为25.94%,27.05%和34.62%,三组间的患病率无统计学差异。
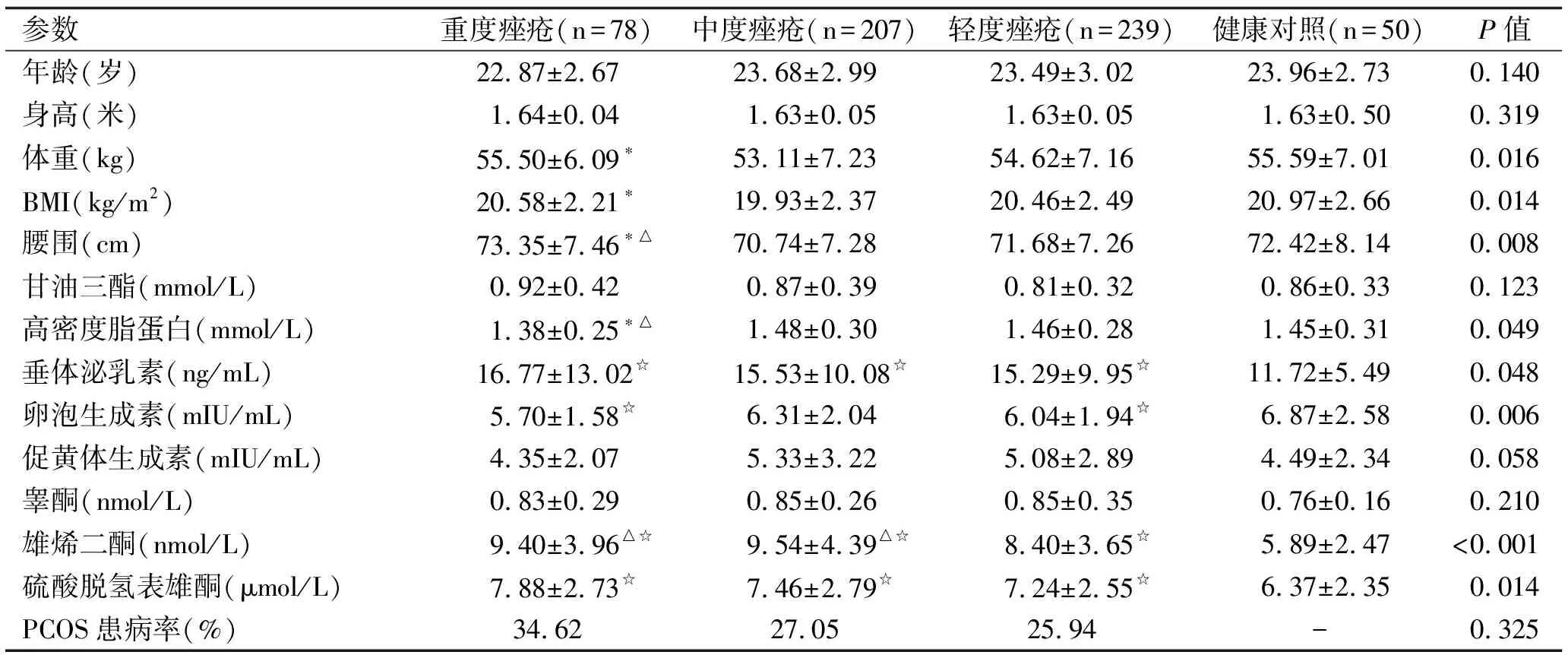
表1 三组痤疮患者和健康对照组临床、血脂和性激素情况
为了除外PCOS对性激素的多重影响,我们对不合并PCOS的379例单纯痤疮进行了性激素分组分析。按照我院检验科正常范围参考值,将上述痤疮患者分为高A4组(>11.5 nmol/L,62例)和正常A4组(≤11.5 nmol/L,317例),两组的临床特征、性激素和血脂水平见表2。由研究结果可知,与正常A4组相比,高A4组的痤疮严重程度总评分无统计学差异,但其前额皮损显著加重。高A4组痤疮患者的TG水平显著降低,HDL-C水平显著升高,且其PRL、LH、TT及DHEAS水平也均显著升高。同时我们也发现,高PRL组(>25 ng/mL,36例)的痤疮患者其A4水平也显著高于正常PRL水平(≤25 ng/mL,343例)的痤疮患者(图1)。此外,我们也将痤疮患者按FSH, LH水平高低分组进行比较,均未发现有统计学差异的指标;按TT、DHEAS水平的高低分组进行比较,组间除了雄激素水平的差异,无其他统计学差异,故未在结果中展示。另一方面,我们将524例痤疮患者按BMI分组进行比较,其中偏瘦组有110例,正常体重组有382例,偏重组有32例。正常组[(7.60±2.71)μmol/L]和超重组[(7.72±2.93)μmol/L]的DHEAS水平均显著高于偏瘦组[(6.72±2.36)μmol/L](图2)。
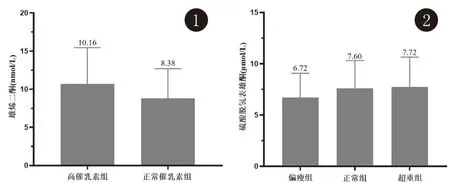
图1 高催乳素组和正常催乳素组痤疮患者的雄烯二酮比较:前组的雄烯二酮水平显著高于后组(P=0.009) 图2 不同体重组痤疮患者的硫酸脱氢表雄酮比较:正常体重组和超重组的硫酸脱氢表雄酮水平显著高于偏瘦组(P=0.007),但两组之间无显著统计学差异

表2 高雄烯二酮与正常雄烯二酮的痤疮患者临床、血脂和性激素(除外PCOS)情况
3 讨论
目前普遍认为雄激素与痤疮的发病密切相关,但雄激素尤其总TT水平在痤疮患者和健康对照间有显著差异的报道并不多。2013年,一项包含38例女性寻常型痤疮患者和36名健康对照的研究发现,痤疮组黄体期的血清TT水平显著高于对照组[7]。同年,另一项包含835例女性痤疮患者(平均年龄27岁)的研究发现,轻、中、重度痤疮患者之间游离TT、A4和DHEAS水平无统计学差异,但该研究未对激素检测时间做限定,没有考虑月经周期对雄激素的影响[8]。2016年,Kiayani等[9]对531例女性痤疮患者(平均年龄21岁)进行研究,发现极轻度、轻度和中度痤疮患者的总TT亦无统计学差异,该研究亦未限定激素检测时间。2020年,国内一项包含190例青春期后女性痤疮患者和80名健康对照的研究表明,青春期后女性痤疮患者卵泡期的TT水平显著高于健康对照,但未发现FSH水平的差异[10]。在我们的研究中,虽然轻、中、重度痤疮患者的TT均值高于健康对照,但差异不具有统计学意义,结合既往研究结果,我们认为血清总TT可能不是痤疮患者高雄激素血症较为敏感的指标。我们研究发现三组痤疮患者的A4、DHEAS水平显著升高,且在不同严重程度的痤疮病例组间,A4水平出现了显著差异(表1)。2010年,国内一项包含30例青春期后女性痤疮患者和30名健康对照的研究也发现,痤疮组的A4和DHEAS显著高于健康对照,与我们的结果较为一致[11]。为了除外PCOS对多种激素和代谢的影响,我们仅对不合并PCOS的单纯痤疮患者进行讨论。我们发现,A4水平较高的痤疮患者前额皮损会明显加重(表2),推测可能与面部T区(油脂分泌旺盛区)皮脂腺细胞中雄激素受体和mRNA的表达水平较U区(油脂分泌水平较低区)显著增加有关[12]。由研究结果可知,痤疮患者是否存在高雄激素血症检测A4的水平可能更有临床价值。我们发现,A4与多种性激素存在相关性,除雄激素外,痤疮患者的PRL水平较健康对照也显著升高。既往研究表明,A4主要由肾上腺和性腺产生,是类固醇性激素的重要中间代谢体。DHEAS仅可由肾上腺合成,在外周组织中可部分转化为A4,A4又可进一步转化为TT而发挥相应的生物学效应[13]。此外,高水平的PRL可选择性作用于肾上腺皮质,刺激DHEAS等雄激素的合成[14]。另一方面,LH可通过激活雷帕霉素复合-1介导的信号级联反应,参与雄激素生物合成中类固醇生成酶的调节[15],还可以通过激活环磷酸腺苷依赖途径刺激卵巢间质细胞合成雄激素。多种激素间相关作用,在不同程度上影响着痤疮发病。在我们的研究中,以FSH和LH浓度高低进行分组,未发现组间性激素的显著统计学差异,这可能与高FSH(24例)和高LH(27例)的痤疮患者比例较小有关,我们将扩大样本量继续进行研究。
不仅如此,我们的研究表明,高A4组的痤疮患者TG水平显著降低而HDL-C水平显著升高。2019年,Wang等提出雄激素可能通过增加内皮细胞脂肪酶的表达抑制饮食诱导的高胆固醇血症,从而起到降脂的作用[3]。此外,DHEAS被发现有促进胰岛素分泌的功能,并能增加肝脏、脂肪组织和肌肉的胰岛素敏感性,从而降低糖尿病和中心型肥胖的风险[16]。在我们的研究中,体重、腰围和BMI在不同浓度的A4和DHEAS组中未发现统计学差异,但BMI较高的痤疮患者DHEAS水平显著高于BMI偏低者。有研究发现,在学龄儿童中肥胖和DHEAS呈正相关,肥胖可影响肾上腺功能促使DHEAS分泌,增多的DHEAS对肥胖和潜在的代谢紊乱可能是一种保护机制[17]。结合既往研究,我们认为肥胖与雄激素有一定关联,A4等雄激素在降低血脂方面可能发挥着积极作用。
青春期后女性痤疮患者易合并多种性激素异常,尤其是雄激素水平的升高。性激素间相互作用,在不同程度上影响痤疮发病。A4较高的痤疮患者前额皮损偏重,此外A4在降低血脂方面可能发挥了积极作用。通过本研究,我们对青春期后女性痤疮患者的临床、性激素和血脂的关联有了更丰富的认识,但具体机制还需更多深入的研究进一步阐明。
