马褂木母树林与不同来源无性系的遗传多样性比较分析
2021-07-22祝园青白天道王晓波蒋维昕黄寿先
祝园青,白天道,王晓波,胥 猛,蒋维昕*,黄寿先
(1.广西大学 林学院/国家林业与草原局中南速生材繁育重点实验室,广西 南宁 530004;2.全州县咸水林场,广西全州 541500;3.南京林业大学 南方现代林业协同创新中心,江苏 南京 210037)
【研究意义】鹅掌楸属(Liriodendron)树种隶属木兰科(Magnoliaceae),大部分已经灭绝,现存2 个种,中国马褂木(Liriodendron chinense(Hemsl.)Sarg.)和北美鹅掌楸(L.tulipiferaL.),因其叶形似马褂又似鹅掌而得名[1-2]。其树干挺拔,树姿优美,是优良的用材及园林绿化树种。中国马褂木星散间断分布于浙江、江西、福建、湖北、湖南、广西、陕西、四川、贵州、云南等地,越南北部也有分布,资源相对较为稀少,属渐危种,已被列为国家二级濒危保护树种[3]。与中国马褂木濒危状态不同,北美鹅掌楸连续成片分布于美国东部各州及加拿大东南部地区,其群体规模普遍较大,资源保存较为丰富[3-6]。【前人研究进展】由于鹅掌楸属2个树种的用途及其分布特性,国内学者先后对其开展较多的研究,主要涉及系统地理进化、群体遗传多样性、资源收集保存与评价、杂交育种、栽培技术等。在系统进化与遗传多样性方面,刘玉壶[7]于1984 年在木兰科分类系统的初步研究中利用形态标记对马褂木进行了形态学水平上的比较,表明中国马褂木较原始,而北美鹅掌楸是次生的。Parks和Wendel[8]利用等位酶标记和RFLP技术比较中国马褂木和北美鹅掌楸遗传多样性,研究得出中国马褂木的遗传多样性低于北美鹅掌楸的遗传多样性。基于分子标记群体遗传研究表明,中国马褂木在天然群体中具有较高的遗传多样性[9-12],且种群间的遗传分化程度较高[13]。在马褂木杂交育种方面,Xu 等[14]表明马褂木在自由授粉过程中,存在着自交、种内交配和种间交配等多种交配方式,研究发现杂交马褂木的遗传多样性较高,且马褂木亲本遗传距离及子代杂合度可能并非马褂木杂种优势形成的主要原因[15-17],优良杂种后代可能有较多的遗传信息来自北美鹅掌楸[18]。因此,开展中国马褂木及北美鹅掌楸优良遗传资源收集和保存,有助于该属树种的杂交改良和扩繁利用。【本研究切入点】遗传多样性评价是良种选育的前提和基础,开展马褂木优良种质资源遗传多样性评价,以为其科学管理和有效利用提供指导。【拟解决的关键问题】基于此,本研究利用SSR分子标记,对广西全州县咸水林场收集保存的中国马褂木及北美鹅掌楸嫁接优树以及实生采种母树林进行遗传多样性分析,以为其育种利用及良种生产提供参考。
1 材料与方法
1.1 试验地概况及试验材料
试验地位于广西桂林市全州县咸水林场,地理位置为E110°42'12″,N25°47'27″,地貌主要为低山、丘陵,土壤以红壤土为主。全年光照充足,雨量充沛,年平均气温17.9 ℃,年平均降雨量1 454 mm,年均相对湿度78%,属中亚热带季风气候[19]。
试验材料分为两部分,第一部分是中国马褂木(LC)及北美鹅掌楸嫁接优树(LT)(2019年3月嫁接)。其中LC 共9 个无性系,接穗材料来源于咸水林场种源试验林选育的优良单株。LT 共10 个无性系,接穗材料来源于南京林业大学北美鹅掌楸种源试验林。砧木为广西全州种源1 年生实生苗。第二部分为中国马褂木全州种源人工林(LCS),面积共10 hm2,造林时间2011年3月,因其生长表现较好且已进入开花结实期,于2018年初步通过样方调查、去劣疏伐、抚育施肥等措施,将其改建为采种母树林。在全林范围内随机选择了53 株母树作为样本,株间间隔30 m 以上。此外,为了验证SSR 扩增的稳定性及嫁接管理过程中是否出现错漏,针对部分优树无性系采集了2个样本(嫁接分株),共计获得35个样本(表1)。

表1 嫁接优树基本信息Tab.1 Basic information of grafting plus trees
1.2 DNA的提取及PCR扩增
采用改良CTAB 法提取马褂木叶片的DNA[20],用微量核酸蛋白检测仪(ScanDrop200,耶拿,德国)进行DNA 浓度和纯度测定,并用10 g/L 琼脂糖凝胶电泳检测DNA 完整性。基于文献检索[20],引物初筛,最终获得扩增稳定,多态性较高的25 个SSR 位点(表2),SSR 引物由生工生物科技有限公司(上海)合成。PCR扩增体系参见文献[20]。

表2 SSR引物基本信息Tab.2 Information table of of SSR primers

续表Continued tab.
1.3 数据处理
将PCR 产物经8%聚丙烯酰胺胶电泳并银染,拍照保存。利用凝胶DNA 片段识别软件GelAnalyzer 19.1(http://www.gelanalyzer.com/index.html)对每张胶图上的目的条带数量及片段大小进行判读,将判读结果导出为Excel文件。利用POPGENE32[21]计算各群体的等位基因数(na)、有效等位基因数(ne)、Shannon多样性指数(I),各位点的观测杂合度(Ho)、期望杂合度(He),基因多样度(Nei)。利用群体遗传分析软件GenAlEx6.5[22]AMOVA计算F-统计量和基因流(Nm)。利用R3.6.1[23]及其相关R数据包[24-25]分析参试马褂木材料的遗传多样性、遗传结构、计算个体遗传距离并进行聚类。
2 结果与分析
2.1 遗传多样性
遗传多样性分析结果显示(图1),北美鹅掌楸嫁接无性系(LT)的等位基因数(na)为4.840 0,有效等位基因数(ne)为3.338 6,香农信息指数(I)为1.271 0,观测杂合度(Ho)为0.399 3,期望杂合度(He)为0.662 7,基因多样度(Nei)为0.642 6,高于中国马褂木嫁接无性系(LC)的遗传多样性(na=4.040 0,ne=2.828 9,I=1.108 0,Ho=0.359 6,He=0.611 5,Nei=0.591 0)。相较于嫁接无性系LT 和LC,中国马褂木母树林(LCS)遗传多样性较低(na=4.160 0,ne=2.450 2,I=0.963 4,Ho=0.313 5,He=0.514 1,Nei=0.508 8)。
对遗传多样性指标进行Kruskal-Wallis检验(图1),发现除na,Ho外,其他指标在群体间均有显著差异。
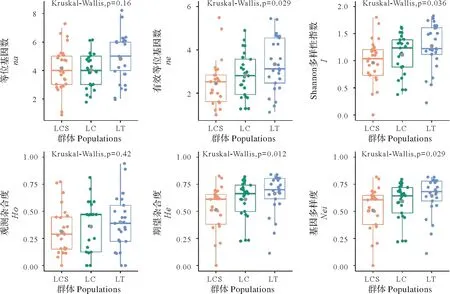
图1 马褂木优树无性系与母树林遗传变异参数比较Fig.1 Comparison of genetic variation parameters between superior clones and seed stands of L.chinense
2.2 遗传分化
AMOVA 分析表明,3 组材料(LCS、LC 及LT)间的Fst值为0.143,即有14.3%的遗传变异存在于群体间,大部分变异(85.7%)存在于群体内,说明群体间存在中等程度的遗传分化[26]。马褂木群体间的存在一定程度的基因流(Nm=1.496)可能是其维持中等程度分化原因之一。参试3组材料间的成对遗传分化系数显示(表4),LC 和LT 之间的遗传分化系数最低,其次是LT 和LCS 之间,而LC 和LCS 之间的遗传分化系数最高。
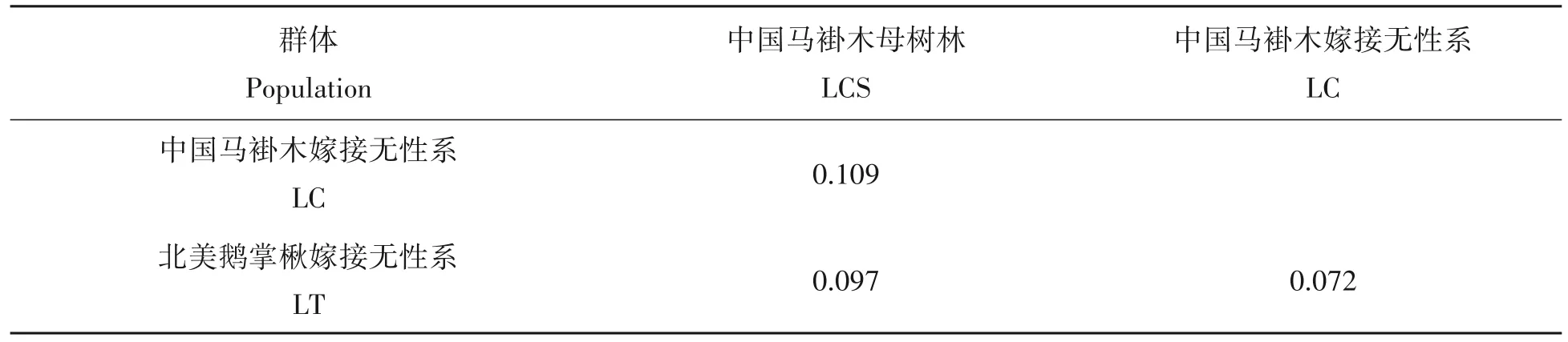
表4 参试3组材料间的成对遗传分化系数(Pairwise Fst)Tab.4 The coefficient of genetic differentiation between populations

表3 马褂木材料的遗传分化程度分析Tab.3 Genetic differentiation of L.chinense
基于个体共祖系数的遗传结构分析表明,参试材料的共祖群体数(K)为3 时,其最小交叉熵值出现拐点(图2A),由此认为供试材料可分为3 个组。共祖系数图显示(图2B),第一类群主要由LCS 构成(红色),第二类群主要由LC 构成(绿色),第三类则主要为LT(蓝色)。需要指出的是,在K=2 时,发现LC 和LT中个体的共祖比例更高(蓝色)。这可能意味着用于分析的SSR位点可能与生长性状相关基因有着密切关联,在人为表型趋同选择(均为种源试验林中表型优良的个体)下,使得LC 和LT 个体的等位基因及其频率具有较高的相似性,一定程度上掩盖自然状态下两者的真实遗传差异。

图2 参试马褂木材料群体结构分析Fig.2 Population structure analysis of L.chinense
基于Ward 最小方差法对个体间遗传距离[27]进行聚类,发现聚类数等于3 时,可将参试的3 组材料(LCS、LC、LT)较好的区分(图3)。除LT-MSL 2 与母树林聚在一起,LT-MSL 1,LT-MSL 3 与中国嫁接优树聚在一起外,同一来源的基因型大多聚为一类。同时,从遗传距离上看,LC和LT距离更近,聚在一起,这与上述推测一致。
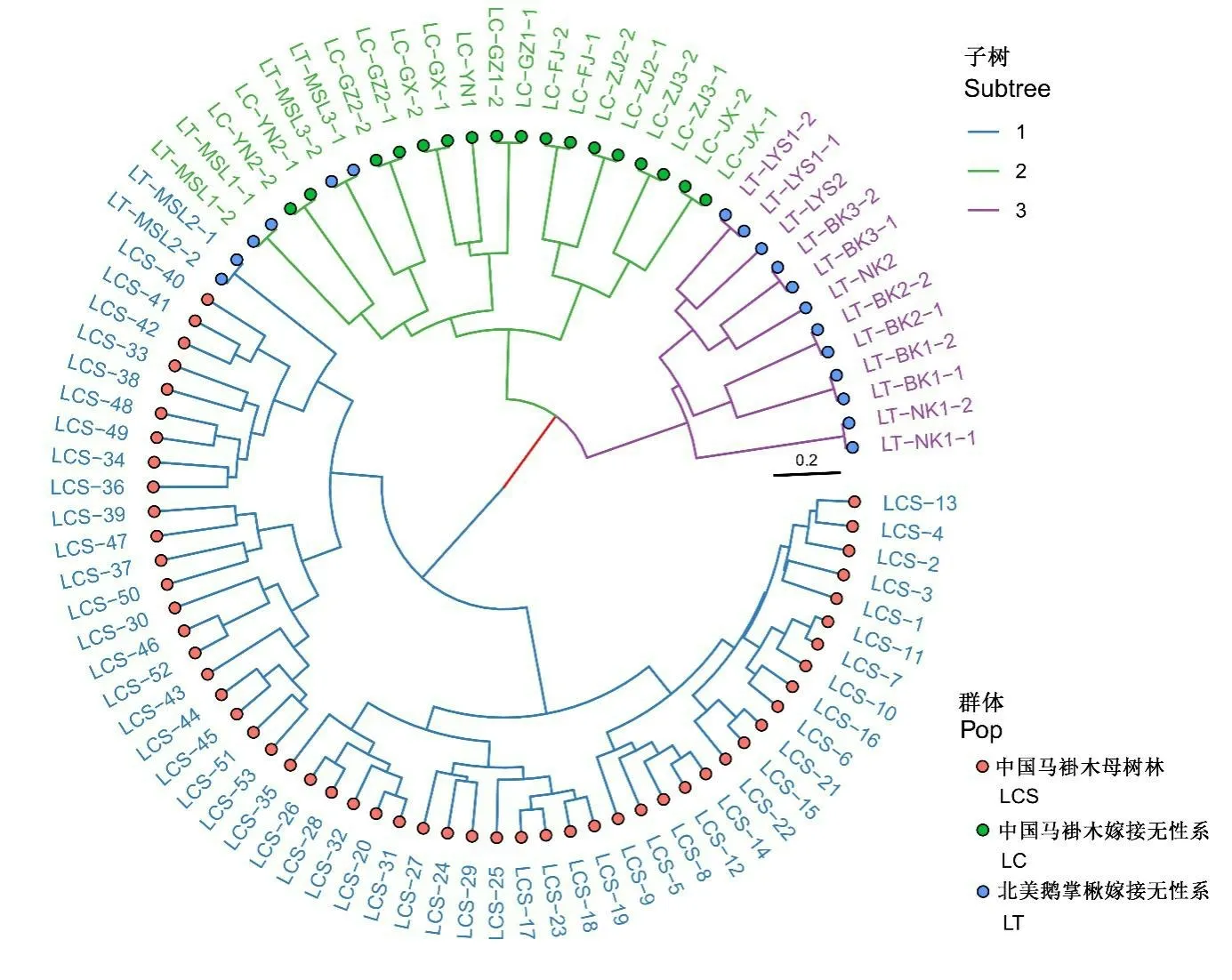
图3 参试中国马褂木及北美鹅掌楸个体的聚类(Ward.D2)Fig.3 Hierarchical cluster of individuals of L.chinense and L.tulipifera(Ward.D2)
3 结论与讨论
3.1 遗传多样性
丰富的遗传多样性是林木群体遗传改良的前提和基础。本研究利用25对SSR引物对中国马褂木和北美鹅掌楸嫁接无性系,以及中国马褂木种源人工母树林进行遗传多样性比较分析,结果发现母树林的遗传多样性(I=0.963 4,He=0.514 1)低于优树无性系;而优树无性系中北美鹅掌楸的遗传多样性(I=1.271 0,He=0.662 7)高于中国马褂木(I=1.108 0,He=0.611 5)。与罗光佐[28]等利用RAPD 技术和李康琴[29]利用SSR 分子标记发现北美鹅掌楸的遗传多样性在天然、种源群体均高于中国马褂木的结果一致。表明中国马褂木异交水平普遍低于北美鹅掌楸。推测主要由于中国马褂木呈星散分布,居群间隔离较大,基因流动相对较少,同时居群内个体数量普遍较少,加剧了居群内个体的近交及自交程度,使得纯合位点增加,遗传多样性下降。相反,北美鹅掌楸呈大面积连续分布,居群间基因流动频繁,异交更为充分。而从中国马褂木嫁接无性系与母树林比较来看,尽管无性系样本数较少,在观测等位基因数上低于母树林,但其观测及期望杂合度、香农指数等指标等均高于母树林,这表明表型优良马褂木个体可能更多来自异交个体,即马褂木具有明显的近交或自交衰退[30]。
马褂木作为国家Ⅱ级濒危保护树种,尽管其遗传多样性不如北美鹅掌楸,但与同为木兰科的珍稀树种红花玉兰(Magnolia wufengensis)相比,其遗传多样性整体高于红花玉兰(I=0.304 2,He=0.248 8)[31],且也明显高于同科的武当木兰(Magnolia sprengeri)的种群遗传多样性(I=0.198,He=0.128)[32]。中国马褂木具有较高遗传多样性的原因可能是马褂木属于孑遗植物,历史悠久,个体生命周期长,在进化过程中积存了较高水平的遗传变异,且存在着高水平的地理分化。中国东、西部的马褂木也可能起源于不同的避难所,在冰期后再向不同方向扩散,形成了丰富的多样性[33]。此外,其维持相对较高杂合度的重要原因可能与其强烈的近交、自交衰退效应有关,由于环境对近/自交子代强烈的选择淘汰作用,使得最终成林植株多数来自异交个体,使得林分(通过样本检测)维持着一定水平的杂合度。而近交、自交子代的大量淘汰,也进一步解释了当前中国马褂木天然群体普遍规模较小的原因。
3.2 遗传分化
AMOVA 分析结果发现,参试材料的Fst值为0.143,说明组内的遗传变异程度较高,组间的遗传分化程度相对较低。马褂木组间存在较高基因流(Nm=1.496),高于前人对马褂木天然群体研究的结果(Nm=1.044)[11]。这与中国马褂木和北美鹅掌楸存在较大的地理隔离矛盾,推测造成这种组间基因流偏高和分化较小的原因可能并非完全来自居群间的花粉流动,而与人为基于表型的趋同选择有关,LC 和LT 无性系均选自种源试验林生长表现优良(树高及胸径较大,树干较通直圆满)的个体,LCS 则来自单一种源天然林(广西全州)优树子代,在基因构成上与前两组差异较大,同时参试SSR 位点可能与控制这些人为偏好的性状的基因紧密关联(连锁),使得LC 和LT 的SSR 基因及基因型频率相对于LCS 群体更为相似,进而造成两者遗传分化较小的现象。
基于个体遗传距离的聚类结果与组间分化水平基本一致,LCS 独立一组,优树无性系LT、LC 各一组,但距离更近。有研究表明,北美鹅掌楸与中国马褂木东部种源的遗传分化小于中国马褂木东西部种源间的差异,从进化上北美鹅掌楸介于中国马褂木东西部种群分化之间[34]。这与组间成对分化系数变化趋势一致。因此,LC 中部分无性系来自东部种源可能是造成其与LT遗传上更近的原因之一。Shen[35]的研究表明,马褂木在中国东部和西部是分离的2个类群,在历史上虽然有一定的基因交流,但随着第四纪气候的波动,生境和扩散廊道被暖温带常绿林所占据,这可能使得马褂木的生境变得支离破碎,加剧了东西部种群的分化,最终形成了如今星散分布于部分山区的局面。并且随着近年来人们的乱砍滥伐,对马褂木天然群体造成了一定的破坏,人为的选择也加剧了马褂木种群的分化。需要指出的是,其中LT中的LT-MSL 2与LCS聚为一组,LT-MSL 1,LT-MSL 3与LC 聚为一组,可能原因除了其自生遗传特性与中国马褂木较接近外,不排除错把紧靠砧木接口的萌条当作了接穗的可能性。
