梓树对淹水胁迫的适应性研究
2021-07-22倪天虹赵天宇张新叶杜克兵裴云霞耿若楠
倪天虹,赵天宇,张新叶,杜克兵*,裴云霞,耿若楠,胡 倩
(1.华中农业大学 园艺林学学院/湖北省林业信息技术研究中心,湖北 武汉 430070;2.湖北省襄阳市林业科学研究所,湖北 襄阳 441052;3.湖北省林业科学研究院,湖北 武汉 430075)
【研究意义】梓树(Catalpa ovata)为紫葳科(Bignonicaceae)梓树属的落叶乔木,广泛分布于我国长江流域及以北地区。梓树具有耐寒、耐干旱瘠薄、耐轻盐碱和抗污染性强的特点,是城乡绿化的重要乡土树种之一[1-3]。同时,梓树因为种子多,繁殖容易,与楸树的亲和性好,还被广泛用作楸树嫁接生产中的砧木。楸树喜水肥,在江汉平原生长表现良好,但水分过多亦显著抑制了其生长,严重时甚至导致植株死亡[4]。大量研究表明,砧木的特性会影响嫁接植株的生理活性与抗逆性[5-6]。梓树对淹水胁迫的适应性如何,其作为砧木时对楸树嫁接苗的抗涝性会产生什么样的影响,这些目前还不清楚。因此,系统研究梓树对淹水胁迫的适应性显得十分有意义,其结果将对江汉平原等涝渍地区梓树与楸树(以梓树为砧木)的栽培提供指导。【前人研究进展】在水分胁迫方面,目前国内外在梓树的抗旱性研究上已经取得了一些进展,而关于抗涝性方面的研究报道则很少[4,7]。在抗旱性方面,于晓池等[7]通过对生理生态特征的测定,比较了黄金树、梓树、灰楸、滇楸和楸树的抗旱性,认为楸树和灰楸的抗旱能力较强,滇楸和梓树的抗旱能力次之,黄金树的抗旱能力最差。在梓树的抗涝性研究方面,目前仅张烨然等[4]通过淹水胁迫下生长量与叶片气体交换参数的观测,比较了楸树、滇楸和梓树各一个无性系的抗涝性差异,认为滇楸的抗涝性最强,楸树居中,而梓树最差。已有报道仅局限于淹水胁迫对梓树光合特性的影响,未对其生理代谢进行研究,导致梓树对淹水胁迫的适应性还不明晰,因此系统研究梓树对淹水胁迫的生理响应具有重要意义。【本研究切入点】梓树为肉质根树种,对淹水胁迫较敏感。在江汉平原楸树的栽培实践中,发现以梓树为砧木的楸树嫁接苗在地下水位较高以及季节性积水的地区植株长势弱,生长量小,甚至成片死亡。因此,本文对梓树在淹水胁迫下的生理响应开展研究,以期了解梓树对淹水胁迫的适应性。【拟解决的关键问题】通过对梓树优良无性系在淹水胁迫下的表型、生长量、生物量、生理生态特征和生理生化指标的分析,系统解析梓树对淹水胁迫的适应性,为涝渍地区的梓树和楸树(以梓树为砧木)的栽培提供参考。
1 材料与方法
1.1 试验材料
以梓树优良无性系1#(简称ZS1)为试验材料。ZS1为从襄阳市林业科学研究所培育的梓树实生苗中筛选的超级苗,其特点是与普通苗木相比,其苗高生长更快。
1.2 植株培养
试验于湖北省武汉市的华中农业大学校园内(30°28'N,114°21'E)进行。该地区气候温和,年平均气温16.3 ℃,无霜期240 d,年降水量1 269 mm,6—8月份为降水集中期。
3 月中旬,以ZS1 高3~4 cm 的生根试管苗为试材,洗净根部培养基后,移栽于装有营养土(山东商道生物科技股份有限公司,中国)的棕色塑料钵中(18 cm×14 cm×16 cm),并覆盖透明塑料杯保湿,每钵移栽1 株,钵底有12 个直径约1.2 cm 的排水孔。15 d 植株成活后,移除塑料杯,让苗木自然生长。所有苗木均于温室内进行移栽和培养,植株成活后每周浇1 次改良的1/2 Hoagland 营养液和2 次自来水。
1.3 淹水处理
待ZS1 的平均高度为40~50 cm 时,筛选生长状况良好且长势一致的苗木开始淹水试验。将全部苗木随机分配到2 个处理中:(1)对照处理(CK):正常浇水,保持土壤含水量为田间最大持水量的70%~75%;(2)淹水处理:植株置于水箱中淹水,使水面高出土壤表面10 cm,保持土壤含水量过饱和,以模拟涝害。将每个处理的植株随机分为2组:第一组用于表型、生长量、生理生态等对植株无损伤的指标的观测,植株随机区组排列,5个区组,3株/小区,共计15株/处理;第二组用于叶片与细根的采集,进行相关生理指标的测定,植株完全随机排列,共24株。淹水处理14 d,植株出现明显受害症状后结束淹水,将植株从水箱中取出,排水恢复7 d,以模拟自然界实际水分变化,试验总时长为21 d。
1.4 测定方法
1.4.1 形态 试验期间,每天观察ZS1 各个处理第一组植株的形态变化,包括叶片的颜色和数量、皮孔的膨大、不定根的产生以及死亡等情况。
1.4.2 苗高与地径 试验的第0天和21天,分别测定ZS1各个处理第一组植株的苗高和地径,计算试验期间苗木的生长量。
1.4.3 叶片气体交换与叶绿素荧光 试验的第1、7、14 和21 天,分别测定ZS1 第一组植株的叶片气体交换参数与叶绿素荧光,每个小区固定选择一棵植株进行测定,共5 次重复/处理。测定于09:00—11:00 进行,选取植株顶端第6 片完全展开的健康叶片测量。叶片气体交换参数采用LI-6400 光合测定系统(LI-COR Inc.,Lincoln,NE,USA)测定,光照强度1 500 μmol/(m2·s),气体流速500 μmol/s。测定内容包括净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度/环境CO2浓度(Ci/Ca)、潜在水分利用效率RWUEi=Pn/Gs等[5]。采用LI-6400 荧光测定系统(LI-COR Inc.,Lincoln,NE,USA)测定叶绿素荧光。测定前,让叶片在自然条件下先暗适应20 min,然后测定其初始荧光(Fo)、可变荧光(Fv)和最大荧光(Fm)等参数。
1.4.4 生理指标 淹水处理的第0 天(CK)、7 天(PS7)、14 天(PS14)和21 天(PS21),分别采用SPAD-502plus 型便携式叶绿素测定仪(Konica Minolta Inc,Japan)测定第二组植株叶片的叶绿素含量(SPAD值),并采集其叶片与细根,用于相对电导率(RMP)、丙二醛(MDA)、脯氨酸(Pro)和根系活力的测定。叶片采集植株顶端完全展开的第6~7 片叶,去除主脉;细根以蒸馏水快速洗净,滤纸吸干表面水分。一部分鲜叶样品用于相对电导率的测定,另一部分叶片样品与全部细根采集后用液氮速冻,于-80 ℃冰箱中保存备用。RMP、MDA 含量、Pro 含量、根系活力的测定,参照王学奎[8]的方法进行:叶片RMP 采用3173 便携式电导率仪(Jenco Instruments,Inc,USA)测定;叶片MDA 含量采用TBA 法(硫代巴比妥酸)测定;叶片与细根Pro 含量采用酸性茚三酮比色法测定;根系活力采用TTC 法(2,3,5-三苯基氯化四氮唑)测定。
1.5 数据分析
图表中的数据均为平均值±标准误(n=3~5)。采用SAS8.1 统计软件进行方差分析(ANOVA)和多重比较(Duncan’s),所有百分数均进行反正弦转换之后进行方差分析。采用淹水变化率评价淹水胁迫对植株造成的影响,淹水变化率=[(对照处理-淹水处理)/对照处理]×100%。
2 结果与分析
2.1 植株形态
试验期间,ZS1的所有对照植株均正常生长,未出现落叶和死亡现象,至试验结束时(21 d)植株存活率为100%。淹水植株的形态发生了明显变化,出现叶片生长减缓、黄化和萎蔫,皮孔膨大等现象。淹水第4天,植株开始出现茎基部皮孔膨大的现象;第10天叶片开始黄化;第11天开始出现叶片萎蔫;至第21 天时,植株均未出现不定根(图1)。排水恢复期间,植株表型恢复不明显。至试验结束时,淹水植株的存活率仅为53%。

图1 ZS1淹水胁迫下的表型变化Fig.1 Phenotypic change of ZS1 under flooding stress
2.2 生长量
淹水胁迫对ZS1 苗高的生长产生了显著抑制作用(图2,P<0.05),而对地径生长的影响不显著(P>0.05)。至试验结束时,ZS1 苗高和地径的淹水变化率分别为66.97% 和37.88%。可见,淹水胁迫对ZS1 苗高的生长影响较大,而对地径的生长影响较小。

图2 淹水胁迫下ZS1苗高与地径的生长量Fig.2 Height and root-collar diameter growth of ZS1 seedlings under partial submergence treatment
2.3 叶片气体交换参数
淹水胁迫显著影响了ZS1 叶片的Pn、Gs、Tr、Ci/Ca和RWUEi(图3,P<0.05)。Pn、Gs、Tr随着淹水时间的延长逐渐降低,至14 d 时达到最小值,排水恢复期间变化不明显,至21 d 时仍极显著地低于对照值。Ci/Ca随着淹水时间的延长逐渐降低,在淹水7 d 时达到最低值,随后迅速上升,并于14 d 时达到最大值,排水恢复期间开始下降,至21 d 时接近对照值。RWUEi随着淹水时间的延长逐渐上升,在淹水7 d 时达到最高值,随后开始迅速降低,于14 d 时达到最低值,排水恢复期间略有上升,但至21 d 时仍极显著低于对照值。Pn、Gs、Tr、Ci/Ca和RWUEi在各个时间点的淹水变化率具有一定的差异,其中Pn、Ci/Ca、RWUEi在淹水14 d时的淹水变化率最大,分别为104.66%、-116.75%和270.15%;Gs、Tr在淹水21 d时的淹水变化率最大,分别为99.06%和99.71%(表1)。

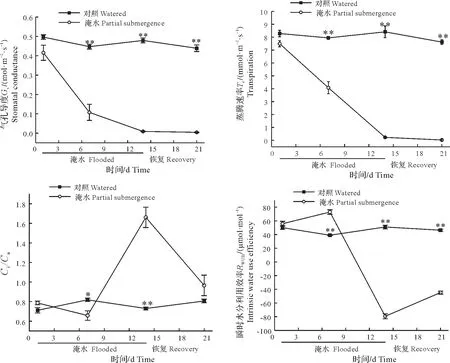
图3 淹水胁迫下ZS1的叶片气体交换参数Fig.3 Gas exchange parameters in leaves of ZS1 seedlings under partial submergence treatment

表1 淹水胁迫下ZS1叶片气体交换参数与叶绿素荧光的淹水变化率Tab.1 Rates of change due to partial submergence of gas exchange parameters and chlorophyll fluorescence in leaves of ZS1 seedlings under partial submergence treatment
2.4 叶片叶绿素荧光
淹水胁迫显著降低了ZS1 叶片的叶绿素荧光参数Fv、Fv/Fm和Fv/Fo(图4,P<0.05)。其中,Fv反映了光系统Ⅱ(PSⅡ)光化学活性的大小;Fv/Fm(PSⅡ最大光化学量子产量)反映了PSⅡ利用光能的能力和光抑制程度;Fv/Fo则反映了PSⅡ的潜在活性[9-12]。Fv、Fv/Fm和Fv/Fo随着淹水时间的延长逐渐降低,至淹水7 d 时小幅度下降,至14 d 时达到最低值,排水恢复后快速上升,但至21 d 时仍显著低于对照值。Fv、Fv/Fm和Fv/Fo在各个时期的淹水变化率具有一定的差异,其中Fv、Fv/Fm和Fv/Fo在淹水14 d时淹水变化率最大,分别为69.90%、30.90%和68.58%(表1)。

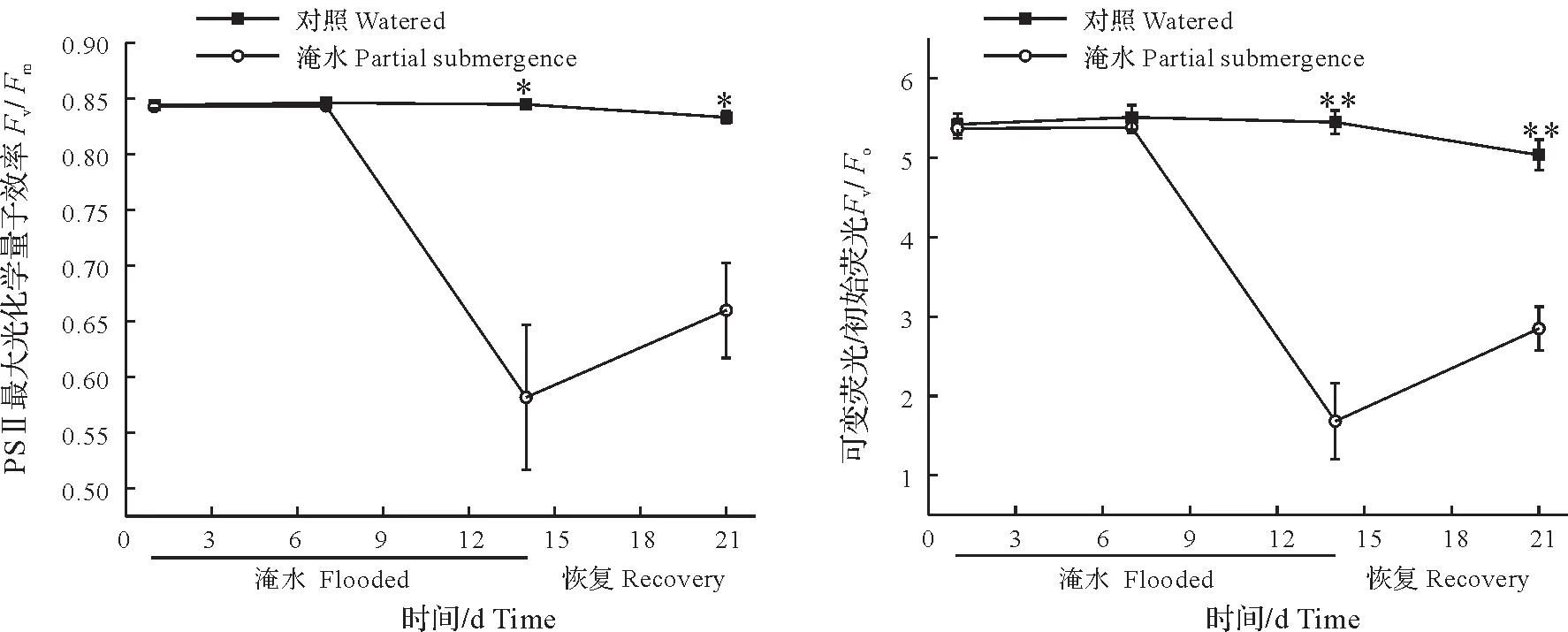
图4 淹水胁迫下ZS1的叶片叶绿素荧光参数Fig.4 Chlorophyll fluorescence parameters in leaves of ZS1 seedlings under partial submergence treatment
2.5 叶片与细根的脯氨酸含量
淹水胁迫显著提高了ZS1 叶片与细根中的脯氨酸(Pro)含量(图5,P<0.05)。随着淹水时间的延长,叶片与细根中的Pro 含量逐渐升高,并于14 d 时达到最高值。在淹水7 d 时,叶片和细根中Pro 含量的淹水变化率分别为-68.96%和-76.19%;14 d 时,淹水变化率分别为-115.00%和-245.94%;排水恢复期间,叶片与细根中的Pro 含量均有所下降,但至21 d 时仍高于对照值,且叶片中Pro 含量下降的幅度较细根小,此时两者的淹水变化率分别为-83.98%和-66.64%。可见,在淹水胁迫下,细根中Pro 含量的上升幅度高于叶片,而排水恢复期间,细根的恢复程度比叶片更好。
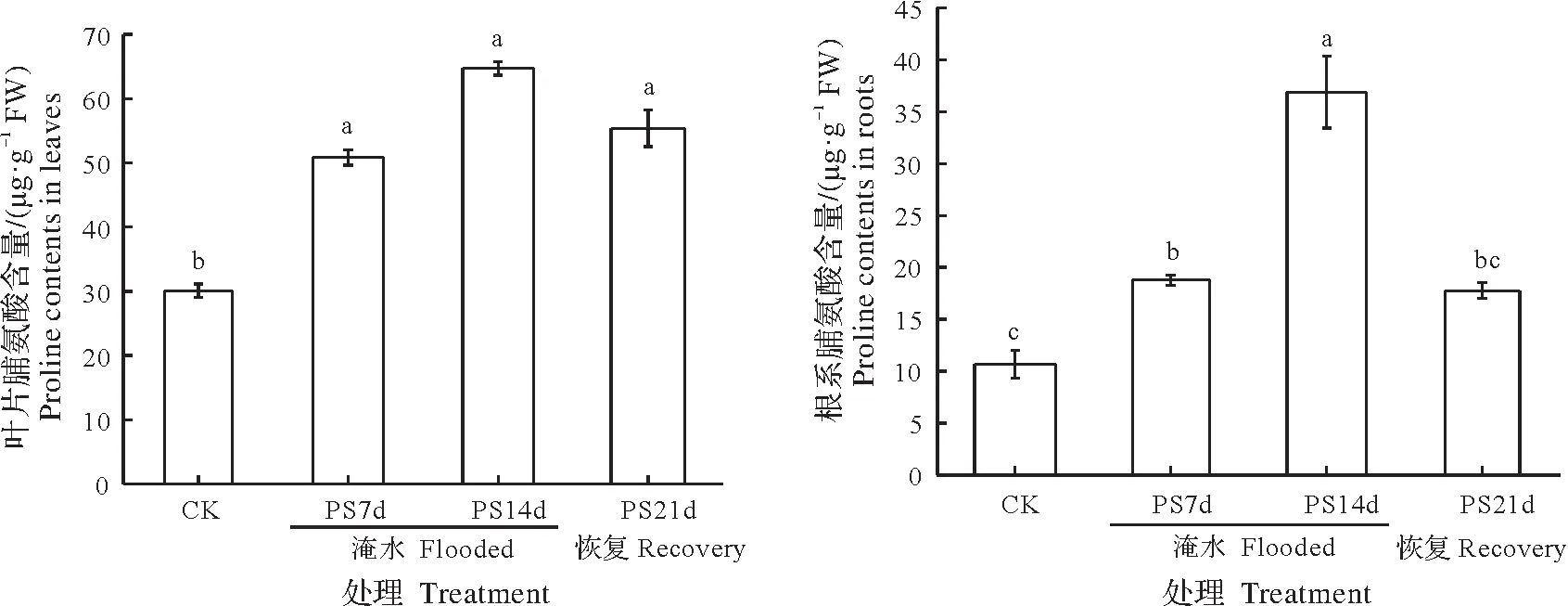
图5 淹水胁迫下ZS1的叶片与细根中的脯氨酸含量Fig.5 Proline contents in leaves and fine roots of ZS1 seedlings under partial submergence treatment
2.6 叶片相对电导率与丙二醛含量
淹水胁迫导致ZS1 叶片的相对电导率(RMP)和丙二醛(MDA)含量显著上升(图6,P<0.05)。随着淹水时间的延长,叶片的RMP 值与MDA 含量均持续增加,并于14 d 时达到最高值。淹水7 d 时,RMP 值和MDA 含量的淹水变化率分别为-77.72%和-87.05%;14 d 时,分别为-141.42%和-145.61%。排水恢复期间,叶片RMP 值和MDA 含量均有所下降,但至21 d 时仍显著高于对照值,此时两者的淹水变化率分别为-122.78%和-70.35%。可见,淹水胁迫对ZS1 叶片的RMP 与MDA 影响很大,排水恢复后这两指标仍难以恢复到对照水平。

图6 淹水胁迫下ZS1的叶片相对电导率与MDA含量Fig.6 Relative membrane permeability and malonaldehyde contents in leaves of ZS1 seedlings under partial submergence treatment
2.7 叶片的叶绿素含量
淹水胁迫显著降低了ZS1 叶片的叶绿素含量(SPAD 值,图7,P<0.05)。随着淹水时间的延长,叶片的叶绿素含量逐渐降低,并于14 d 时达到最小值。淹水7 d 和14 d 时,SPAD 值的淹水变化率分别为19.96%和31.39%。排水恢复期间SPAD 值略有上升,但至21 d 时仍显著低于对照值,此时淹水变化率为26.71%。

图7 淹水胁迫下ZS1的叶片叶绿素含量Fig.7 Chlorophyll contents in leaves of ZS1 seedlings under partial submergence treatment
2.8 根系活力
淹水胁迫导致ZS1的根系活力显著降低(图8,P<0.05)。随着淹水时间的延长,根系活力持续降低,并于14 d 时达到最小值。在淹水7 d 时,根系活力的淹水变化率为32.46%;至14 d 时,变化率达到54.03%。排水恢复期间呈现小幅度上升,但至试验结束时(21 d)时仍显著低于对照值,此时的淹水变化率为46.03%。
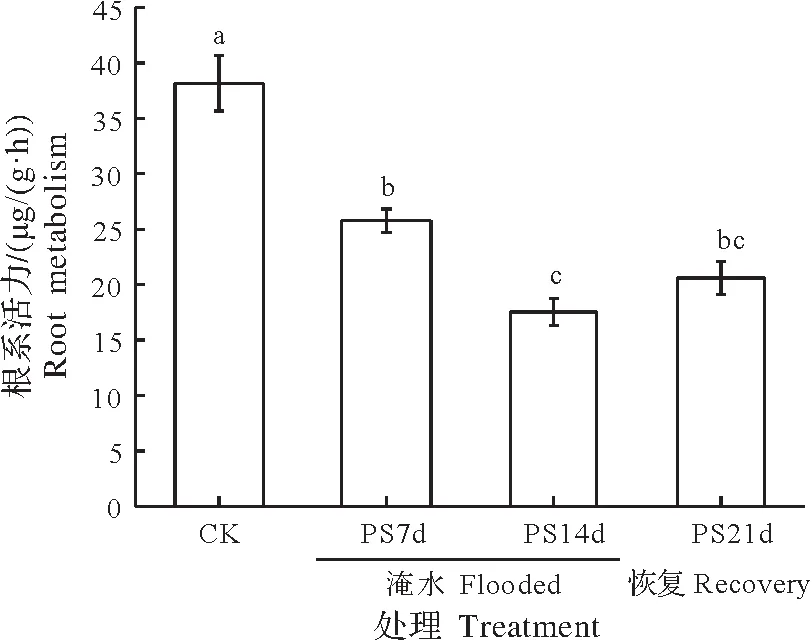
图8 淹水胁迫下ZS1的根系活力Fig.8 Root metabolism of ZS1 seedlings under partial submergence treatment
3 讨论与结论
淹水胁迫对植物造成损伤的主要原因是土壤缺氧以及乙烯、CO2、锰和铁等元素的过量积累[13-14]。在淹水胁迫下,植物的形态、解剖结构、光合作用、呼吸作用和生理代谢等多个方面会受到影响[15-17]。
形态结构是反映植物受害程度最直接的指标。淹水胁迫下植物形态的变化,主要包括叶片黄化、萎蔫与脱落、生长变缓、根系死亡、皮孔膨大、不定根诱导等[18]。其中,皮孔膨大、不定根诱导、通气组织形成与植物的抗涝性密切相关,可以增强地上部氧气向地下根际的输送,在一定程度上缓解淹水胁迫导致的低氧损害[19-20]。本试验中,ZS1 出现明显的叶片黄化和萎蔫症状(10~11 d),有明显的皮孔膨大现象(4 d),但是始终没有诱导形成不定根,这可能是梓树难以适应长时间淹水胁迫的重要原因之一。至试验结束时(21 d),ZS1淹水植株的存活率仅为53%,可见梓树对淹水胁迫很敏感。
苗高与地径生长量、叶片的叶绿素含量是反映植物受害程度的间接指标。本试验中,淹水胁迫造成ZS1 的叶绿素含量显著降低,这与北美枫香对淹水胁迫的响应一致,这可能是因为淹水胁迫抑制了叶绿素的合成,加快了叶绿素的降解[21]。本试验中,淹水胁迫对苗高的生长产生了显著的抑制作用(P<0.05),但对地径生长的影响不显著(P>0.05)。至试验结束时,苗高与地径的淹水变化率分别为66.97%和37.88%,这说明淹水胁迫对梓树苗高生长的影响更大,这与杨树等树种的研究结果一致,这可能是因为淹水胁迫通过抑制叶片和根系生长、降低水分与矿质营养吸收、改变叶绿素含量和组分、破坏光合作用的结构与性能等,降低植物光合同化能力,进而抑制其生长[5,9]。
叶片气体交换参数反映了逆境胁迫下光合系统受损的程度。在淹水胁迫下,植物会通过关闭气孔,提高水分利用效率等方式,应对水分吸收减少、光合酶类活性降低、叶绿体等细胞器降解、光合能力下降等不利影响[22-23]。本试验中,随着淹水胁迫时间的延长,ZS1 逐渐降低叶片的Pn、Gs和Tr,这与杨树、玉米和海棠等植物在淹水胁迫下的表现一致[11,24-26]。Gs的变化是导致Pn、Tr、Ci/Ca和RWUEi等变化的直接原因[27-28]。Farquhar 等的观点是植物的光合抑制源自气孔限制和非气孔限制两种原因。若Pn、Gs和Ci/Ca同时下降,则Pn降低主要受气孔限制;若Pn与Gs呈下降趋势,而Ci/Ca却上升,则Pn降低主要受非气孔限制[22]。本试验中,淹水胁迫前7 d,Pn的降低主要由气孔原因造成,因为气孔关闭,导致气孔导度下降,CO2供应不足。淹水胁迫7 d 后,Pn的降低主要由非气孔原因造成,因为叶肉细胞光合活性下降致使同化力不足,这与杨树、白桦和海棠等的研究结果一致[9,26,29]。淹水7 d 时ZS1 的Pn、Gs和Tr大幅降低,14 d 时RWUEi显著减小,说明ZS1 的光合系统对淹水胁迫十分敏感,与其表型变化一致。排水恢复结束后,ZS1 的Pn、Gs、Tr、RWUEi仍极显著低于对照值,表明淹水胁迫造成的伤害严重,难以在短时间内恢复正常。
叶绿素荧光参数Fv、Fv/Fo和Fv/Fm是检测植物光化学反应状况的3个重要参数,可准确揭示植物光系统对光能的吸收、传递、耗散和分配等情况[12,30]。本试验中,ZS1 在淹水14 d 时的Fv、Fv/Fo和Fv/Fm均显著低于对照值,表明淹水胁迫导致叶绿体光合机构受损,光合作用原初反应过程受抑制,光合CO2同化效率降低[12]。ZS1 的Fv、Fv/Fo和Fv/Fm在淹水1 d 和淹水7 d 时下降幅度不显著,而在14 d 时大幅降低,说明淹水时间对其光合机构的影响很大,这可能与植株茎基部未能诱导形成不定根有关,这和抗涝性较差的小叶杨的研究结果一致,Fv、Fv/Fo和Fv/Fm在淹水15 d时显著降低,淹水期间也始终未形成不定根[9]。恢复期结束后,ZS1的Fv、Fv/Fo和Fv/Fm虽有上升,但仍显著低于对照值,同样说明淹水胁迫的伤害难以在短时间内恢复正常,这与其叶片气体交换参数的表现基本一致。
脯氨酸是一种重要的渗透调节物质,揭示了逆境胁迫下对植物代谢过程的影响[31]。本试验中,在淹水14 d时,叶片和细根脯氨酸含量的淹水变化率分别为-115.00%和-245.94%,而排水恢复后,两者脯氨酸含量的淹水变化率分别为-83.98%和-66.64%,这说明受到淹水胁迫时,ZS1通过提高脯氨酸含量以维持细胞渗透压,降低受害程度,但叶片和细根的响应程度不同,恢复能力也有所差异,这与‘纽荷尔脐橙’/枳[32]和冬青[33]的研究结果类似。
叶片MDA含量与RMP均为显示植物在逆境胁迫下受害程度的重要指标,揭示了逆境胁迫下对细胞膜结构的影响。MDA反映膜脂过氧化的程度,从而间接反映植物组织抗氧化的能力。RMP显示了细胞膜结构的受损程度[9]。本试验中,ZS1 淹水植株的叶片MDA 含量与RMP 均随着淹水时间的延长持续上升,排水恢复后,虽有下降,但仍高于对照,这说明随着淹水时间的延长,叶片细胞质膜透性增大,细胞各项功能紊乱,膜质过氧化作用加剧,这与其叶片气体交换参数和叶绿素荧光的反应一致,亦与桑树、紫树的研究结果一致[34-35]。
根系活力是植物根系的吸收能力、合成能力、氧化能力和还原能力等的综合反映,是一种能够较客观反映植物根系生命活动和活力水平的重要生理指标[36]。本试验中,ZS1淹水植株在7、14和21 d时,根系活力的变化率分别为32.46%、54.03%和46.03%,随着淹水时间的延长,根系活力呈降低趋势,这与桢楠和玉米的研究结果一致[37-38],其原因可能是长时间淹水使根系缺氧,造成根系损伤和生理代谢水平严重降低,且难以在短时间内恢复。
综上所述,通过对淹水胁迫下ZS1的16个形态和生理生化指标响应的分析,认为ZS1是一种对淹水胁迫较敏感的无性系。由于本文仅以ZS1 一个无性系为材料进行研究,要系统深入地揭示梓树对淹水胁迫的适应性,后续还需要针对不同的梓树种质资源进行更广泛的抗涝性评价。
