雷公藤红素单用和联用抗肿瘤作用机制的研究进展
2021-07-21徐资怡石金凤章津铭
徐资怡,石金凤,鲜 静,张 晨,章津铭
成都中医药大学药学院,四川 成都 611137
近年来,全球肿瘤发病率和死亡率正在迅速增长,恶性肿瘤严重危害了人们的健康,影响了人们的正常生活[1]。化疗是目前肿瘤治疗的主要方式,但大多数化疗药物水溶性较差、生物利用度不高且化疗药物对正常细胞的非选择性作用,大多数常规化疗患者出现严重的不良反应[2]。中药活性成分具有高效、低毒、作用广和靶点多等优势,可有效克服或弥补化疗药物严重的不良反应和肿瘤耐药性[3],这使得中药活性成分逐渐成为研究热点,通过研究中药活性成分以获得更好的肿瘤治疗。
雷公藤红素又名南蛇藤素,是从卫矛科植物雷公藤Tripterygium wilfordiiHook.f.中提取的五环三萜类单体化合物,除了具有抗炎、抗风湿、止痛、治疗神经性退化疾病等多种药理活性,还具有显著的抗肿瘤活性,对前列腺癌、肺癌、肝癌、白血病、胶质瘤、结肠癌、卵巢癌、乳腺癌、胃癌等细胞均有抑制作用[4-8]。现代研究表明,雷公藤红素具有广谱、高效的抗肿瘤活性,与传统抗肿瘤药物相比,自身细胞毒性作用轻,抗肿瘤活性更强,并能表现出明显的放疗及化疗增敏作用[9]。随着近年来雷公藤红素研究的深入,其广泛的应用和独特的优势使其有望成为抗肿瘤的有效药物。本文综述了近几年雷公藤红素单用及联用抗肿瘤作用机制及其递药系统的研究进展,以期为今后雷公藤红素的深入研究和广泛应用奠定基础。
1 抗肿瘤作用机制
1.1 抑制肿瘤细胞增殖
肿瘤细胞具有无限增殖的特性,雷公藤红素可以通过促进肿瘤细胞凋亡、诱导肿瘤细胞自噬、阻滞细胞周期等抑制肿瘤细胞增殖,从而达到治疗肿瘤的作用。
1.1.1 诱导肿瘤细胞凋亡 细胞凋亡是指为维持内环境稳定,由基因控制的细胞程序性死亡,通过一系列基因的激活、表达以及调控等作用,其异常功能是肿瘤生长和抗肿瘤发展的基础。由雷公藤红素介导的细胞凋亡主要通过3种通路实现:线粒体参与的内源性信号通路、外源性信号通路和内质网应激(endoplasmic reticulum stress,ERS)介导的细胞凋亡。
线粒体参与的内源性信号途径主要是由关键调节因子B淋巴细胞瘤-2(B-cell lymphoma 2,Bcl-2)家族蛋白导致的线粒体膜的破坏或通透,从而导致细胞色素c(cytochrome c,Cyt-c)的释放和其他凋亡因子的表达。在细胞质中,Cyt-c与三磷酸腺苷形成一种称为凋亡酶激活因子的复合物,该复合物激活半胱氨酸天门冬氨酸特异的蛋白酶9(cysteinyl aspartate specific proteinase-9,Caspase-9)进而激活下游Caspase-3等相关靶点[10]。Bcl-2家族蛋白包括抗凋亡Bcl-2家族蛋白(Bcl-2、Bcl-xL和Survivin)和凋亡前Bcl-2家族蛋白[B淋巴细胞瘤-2基因相关启动子(Bcl-2 asociated death promoter,Bad)、Bcl相关X蛋白(Bcl-associated X protein,Bax)、BH3结构域凋亡诱导蛋白(BH3 interacting domain death agonist,Bid)和Bcl-2细胞死亡调节因子(Bcl-2 interacting mediator of cell death,Bim)],他们通过调节Cyt-c的释放来抑制或促进细胞凋亡[11-13]。Yang等[14]在研究雷公藤红素对人乳腺癌MCF-7细胞的作用机制时发现,雷公藤红素通过降低Bcl-2表达,增加Bax表达来诱导Cyt-c和凋亡诱导因子释放从而使得Caspase-7、8、9活化,诱导聚二磷酸腺苷核糖聚合酶(poly ADP-ribose polymerase,PARP)裂解以及Caspase-8介导的Bid裂解。雷公藤红素还可以通过抑制磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)途径诱导细胞凋亡[15]。当用雷公藤红素5 μmol/L和拉帕替尼5 μmol/L组合处理人乳腺癌MDA-MB-453细胞时,可以在体外生长抑制和凋亡方面显示出强大的协同作用,表明凋亡相关蛋白(Caspase-9、3)与生长途径相关蛋白[人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)、磷酸化HER2(p-HER2)、磷酸化Akt(p-Akt)和磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinases 1/2,p-ERK1/2)]的下调[15]。雷公藤红素处理后的细胞线粒体通透性发生改变,使得线粒体膜电位破坏[16]。另外有研究发现雷公藤红素可以通过抑制肽基脯氨酰顺/反异构酶(peptidyl-prolyl cis-trans isomerase NIMA-interacting 1,Pin1)表达,从而抑制Akt、信号转导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)、p38、c-Jun氨基端激酶(c-Junamino-terminal kinases,JNK)、p65和白细胞介素(interleukin,IL)-6表达[17]。Zhang等[18]研究表明雷公藤红素2、4 μmol/L处理2 d后,人卵巢癌OVCAR3细胞中miRNA-21的相对表达水平降低,miRNA-21表达的下调会导致细胞OVCAR3中PI3K/Akt-核转录因子(nuclear transcription factorκB,NF-κB)的表达水平降低,从而通过线粒体途径诱导细胞凋亡。
死亡受体介导的外源性信号通路是通过促凋亡配体与促凋亡受体结合导致死亡诱导信号复合体的形成[19],如自杀相关因子(factor associated suicide,Fas)、肿瘤坏死因子(tumor necrosis factor,TNF)-αR、DR3、DR4和DR5等死亡受体通过激活配体诱导细胞凋亡。雷公藤红素通过增加TNF受体(TNF receptor,TNFR)-1、TNFR-2、Fas、DCR2、DR5、RIP和TNFR相关死亡结构域蛋白的表达来诱导口腔癌SASV16细胞凋亡[20]。NF-κB途径是细胞因子刺激、细胞周期、凋亡和血管生成的关键调节因子[21]。Ni等[22]在使用雷公藤红素处理骨髓瘤细胞后,采用免疫印迹法对NF-κB信号通路进行了检测,NF-κB和IκB激酶α(IκB kinase α,IKKα)的表达降低,用免疫荧光法检测雷公藤红素处理后NF-κB p65亚基的核转位,结果表明雷公藤红素以时间相关的方式有效地阻止了p65亚基的核转位和NF-κB抑制蛋白α(inhibitor of NF-κBα,IκBα))裂解。此外,Mou等[23]发现雷公藤红素作用人肺癌A549细胞48 h后激活自杀相关因子配体与Fas结合,并通过激活Caspase-8触发外部途径细胞凋亡。雷公藤红素可以减弱豆蔻酰佛波醇乙酯、TNF-α对IL-6基因表达的激活作用,下调IKKα、p50和p65的表达,通过NFκB依赖途径下调IL-6基因表达,达到抑制前列腺癌细胞增殖的目的[24]。TNF相关凋亡诱导配体(TNF related apoptosis inducing ligand,TRAIL)是TNF超家族成员之一,其与DR4/DR5结合可诱导细胞凋亡。在研究雷公藤红素诱导骨肉瘤细胞凋亡的实验中,Li等[25]发现雷公藤红素可以上调外源性凋亡途径蛋白DR5的表达。
ERS是细胞的一种保护机制,但是当长时间过度应激或功能障碍时,可能会诱导凋亡。ERS通常伴随着能诱导ERS活性氧(reactive oxygen species,ROS)生成的增加,过多的ROS水平干扰氧化还原动态平衡从而诱导细胞凋亡[26-27]。同时,ERS也会导致线粒体功能障碍,增加线粒体ROS生成[28]。研究表明,雷公藤红素可以诱导JNK的激活进一步的诱导C/EBP同源蛋白(C/EBP homologous protein,CHOP),从而诱导DR5死亡受体的表达,最终引起细胞凋亡[29]。在用雷公藤红素1 μmol/L处理MCF-7细胞后,发现雷公藤红素可以通过ROS-蛋白激酶C-AMP活化蛋白激酶-p53蛋白-Polo激酶1通路诱导细胞凋亡[30]。同样,Chen等[27]发现雷公藤红素诱导ROS积聚激活JNK,进而启动线粒体介导的细胞凋亡。雷公藤红素通过ROS积聚诱导HSP90客户蛋白表达下调,并通过抑制线粒体呼吸链复合体I活性促进ROS积聚。雷公藤红素诱导产生的ROS可以激活多种信号通路,如包括p38、JNK和ERK1/2在内的丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)家族成员进而诱发细胞凋亡[31]。研究表明,雷公藤红素3 μmol/L处理人骨肉瘤HOS细胞24 h可诱导发生凋亡,该作用是通过上调ERS相关蛋白[兔抗人结合免疫球蛋白(binding immunoglobulin protein,BiP)、p-蛋白激酶样内质网激酶、肌醇依赖酶1α、钙联蛋白和蛋白质二硫键异构酶]、凋亡相关蛋白(CHOP、Caspase-12)和Caspase-3的表达等[32]。Yoon等[33]发现雷公藤红素通过诱导细胞凋亡来杀死乳腺和结肠癌细胞系,这种细胞死亡模式的特征是通过扩张内质网和线粒体而出现广泛的空泡化。雷公藤红素诱导活化转录因子4(activating transcription factor 4,ATF4)、CHOP、赖氨酸-天冬氨酸-谷氨酸-亮氨酸受体的积累,同时通过线粒体钙离子单向转运体介导的线粒体Ca2+摄取、三磷酸肌醇受体介导的内质网Ca2+释放诱导内质网应激。雷公藤红素通过诱导线粒体功能障碍从而增加ROS生成,破坏线粒体膜,促进Cyt-c的释放,进而激活Caspase-3和Bax的表达,诱导人肝癌HepG2细胞凋亡[34]。雷公藤红素诱导肿瘤细胞凋亡的作用机制见图1。
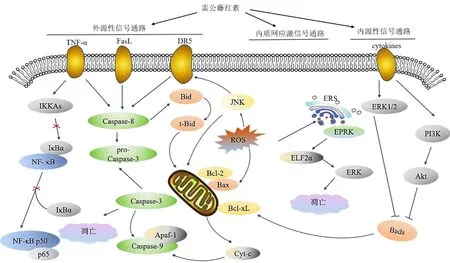
图1 雷公藤红素诱导肿瘤细胞凋亡的作用机制Fig.1 Mechanisms of celastrol inducing apoptosis in tumor cells
1.1.2 阻滞细胞周期 细胞周期的调控由细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(cyclindependent kinases,CDKs)、CDKs抑制剂三者共同协调完成[35]。研究表明,雷公藤红素通过下调miR-21的表达明显抑制细胞增殖,并抑制细胞增殖相关蛋白Cyclin D1和CDK6的表达,诱导G2/M细胞周期阻滞[36]。雷公藤红素上调G2/M期相关蛋白细胞周期检测点激酶2(checkpointkinase 2,Chk2)、磷酸化Chk2(phosphorylate Chk2,p-Chk2)、p-周期蛋白依赖性激酶 1(cyclin-dependent kinases 1,Cdc2)和p-Cdc25C的表达,下调Cdc25C的表达,增加Cyclin B1的表达。此外,雷公藤红素还增加了p21的蛋白质水平,阻断Cdk1/Cyclin B1的激活[31]。Li等[17]分别用雷公藤红素0.25、0.5、1 μmol/L处理人卵巢癌SKOV3细胞24 h,当雷公藤红素剂量为1 μmol/L时可以显著抑制Cyclin D1、CDK2、CDK4和Bcl-2的下调以及Caspase-3的增加,从而显著抑制G2/M期细胞的活力并诱导凋亡和细胞周期停滞。另一项研究表明雷公藤红素通过上调p-Chk2、Chk2、p-Cdc25C、p-Cdc2、p21和Cyclin B1的表达,并下调Cdc25C和Cdc2的表达,诱导G2/M期的细胞蓄积,并且G0/G1和S期相应减少[25]。Cyclin E是一种核蛋白,与CDK2缔合,并在G1期晚期形成活性复合物,引导其进入S期。在雷公藤红素处理的人骨髓瘤RPMI-8226细胞中发现通过下调Cyclin D1和Cyclin E水平,上调p21和p27水平诱导细胞凋亡[37]。雷公藤红素阻滞肿瘤细胞周期的作用机制见图2。
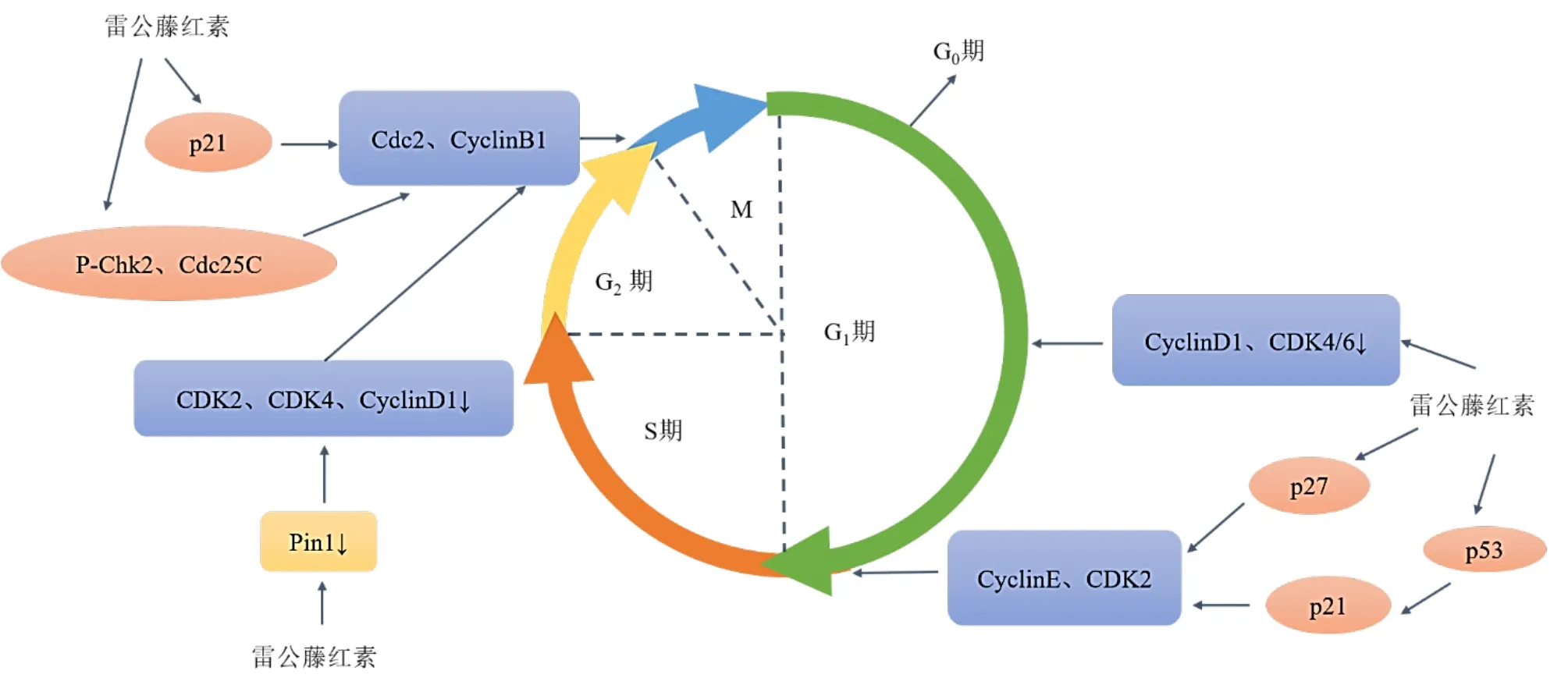
图2 雷公藤红素阻滞肿瘤细胞周期的作用机制Fig.2 Mechanism of celastrol blocking tumor cell cycle
1.2 抑制肿瘤细胞转移
癌症患者的死亡通常是由于肿瘤细胞转移造成的。细胞黏附是肿瘤细胞转移级联过程中的关键步骤,阻断这一步骤被认为是预防和治疗肿瘤转移的合理策略。实体瘤的生长和转移依赖于新形成的邻近血管的血液供应。因此,肿瘤血管成为潜在治疗干预的关键靶点[38]。据研究报道,雷公藤红素抑制β-1整合素介导的活性从而抑制人脐静脉内皮HUVECs细胞与纤连蛋白的黏附。Ke等[38]用1.0、2.0、4.0、8.0 μg/mL雷公藤红素作用于HUVECs细胞1 h,细胞黏附率分别降至87%、68%、52%、46%。此外,有研究发现,用雷公藤红素处理人肺癌95-D细胞和小鼠黑色素瘤B16F10细胞,可以明显抑制该细胞外基质黏附。这种抑制是通过增强β-1整合素配体亲和力以及降低黏着斑激酶磷酸化实现的[39]。研究发现脂多糖通过激活细胞表面受体toll样受体4(toll-like receptor 4,TLR4)促进血管生成,雷公藤红素可以下调脂多糖诱导的人多发性骨髓瘤Lp-1细胞上TLR4的表达[40]。雷公藤红素还可以抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)分泌以及Akt/一氧化氮合酶信号转导[41]。关于雷公藤红素抑制肿瘤细胞迁移的通路,有报道表明雷公藤红素诱导人前列腺癌PC-3细胞凋亡并抑制Akt/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/p70核糖体蛋白S6激酶(p70 ribosomal protein S6 kinase,p70S6K)通路。研究者用VEGF 50 ng/mL和雷公藤红素0、0.5、1、2、5 μmol/L共同处理PC-3细胞后,发现雷公藤红素以浓度相关地方式有效抑制VEGF触发的HUVECs细胞的mTOR信号级联反应,包括Akt、mTOR和S6K激酶的激活,提示雷公藤红素通过阻断mTOR信号通路抑制肿瘤血管生成[42]。基质金属蛋白酶(matrix metalloproteinases,MMPs)是癌症侵袭的重要组成部分,用雷公藤红素0、0.1、0.5、1 μmol/L处理HepG2细胞后,通过免疫印迹法检测到雷公藤红素以剂量相关地方式显著降低MMP-2和MMP-9蛋白水平,进一步的研究发现抑制miR-224的表达可以降低MMP-9的蛋白水平[43]。同样,Ma等[44]发现雷公藤红素通过抑制mTOR/p70S6K/真核生物翻译起始因子4E和ERK信号通路来抑制缺氧诱导的缺氧诱导因子1α的激活,从而抑制VEGF的表达。
1.3 诱导肿瘤细胞自噬
自噬是一个吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,从而实现细胞本身的代谢需要和某些细胞器的更新。p62在氧化应激反应途径中起着关键作用[45]。p62表达的增加也可能与ROS的产生有关。Liu等[31]发现雷公藤红素触发了自噬,并上调了程序性死亡受体-1和微管相关蛋白轻链3B(microtubule-associatedprotein light chain 3 B,LC3B)的表达以及p62的水平,通过激活ROS/JNK信号通路和抑制Akt/mTOR信号通路,同时触发胶质瘤细胞凋亡和自噬。同样,在HOS细胞和人骨肉瘤MG-63细胞中,Li等[25]发现雷公藤红素诱导的LC3B-II表达的增加。雷公藤红素1.2 μmol/L作用于人宫颈癌HeLa细胞12 h,可观察到LC3点的形成和聚集,提示雷公藤红素可诱导自噬小体的形成。雷公藤红素处理的HeLa细胞12 h内,上调自噬标志物LC-3I转化为LC-3Ⅱ和LC3来诱导肿瘤细胞系[46]。此外,Guo等[47]发现雷公藤红素下调雄激素受体及其靶标miR-17-92a,从而导致前列腺癌细胞自噬。
1.4 抑制炎症应激
炎症被认为是对病原体或受损细胞的生物反应。长时间的炎症应激会引起过敏症状和许多疾病的进展,包括肿瘤的生成。炎症的发生通常与NFκB调节的细胞因子有关,如TNF-α和IL-1β,然后抑制TNF-α诱导的抗凋亡(如Bcl-2、Bcl-xL和Survivin)、侵袭(如MMP-9)和血管生成相关蛋白的基因表达来发挥抗肿瘤作用。雷公藤红素已显示出对炎症介导的肿瘤细胞的保护作用。研究发现,雷公藤红素可以通过调节Notch信号通路抑制肿瘤增殖,诱导人白血病U937细胞凋亡[48]。在人脑星形胶质瘤细胞中,雷公藤红素下调黏附分子(如细胞间粘附分子-1/血管细胞粘附分子1)和趋化因子[如单核细胞趋化因子-1(monocyte chemotactic protein-1,CCL2)、CXC趋化因子8(C-X-C motif chemokine ligand 8,CXCL8)和CXCL10]的表达。研究者通过使用雷公藤红素处理人脑星形胶质瘤CRT-MG细胞发现雷公藤红素通过抑制JNKMAPK-STAT1/NF-κB信号调节促炎介质的表达[49]。同样,另一项研究发现,雷公藤红素通过NF-κB调节的趋化因子(CCL2、CXCL10、CXCL12、CCR2和CXCR4)基因抑制人类风湿关节炎成纤维样滑膜RA-FLSS细胞的增殖和侵袭[50]。
2 联合用药
2.1 抗肿瘤作用机制
雷公藤红素作为目前具有抗肿瘤前景的中药活性成分之一,雷公藤红素的临床应用受到了严重的肝、肾毒性以及免疫抑制限制。迄今为止,对于许多类型的肿瘤,联合治疗被认为是临床上优选的治疗过程。药物联合使用产生的协同作用可以提高单独用药治疗功效,从而减少每种药物的剂量,为患者带来更好的耐受性,减轻药物毒副作用。此外由于不同药物的不同作用机制,单一用药经常会使肿瘤细胞产生耐药性,联合疗法降低了耐药性的风险。因此,雷公藤红素联合用药为肿瘤治疗提供了新的机遇。具体联合作用机制主要包括抗肿瘤多药耐药性(multidrug resistance,MDR)、诱导肿瘤细胞凋亡、抑制肿瘤细胞转移、阻滞细胞周期、诱导肿瘤细胞自噬等。
2.1.1 协同增敏,逆转肿瘤MDR 肿瘤MDR是指肿瘤细胞对一种抗肿瘤药物产生抗药性的同时,对于结构和作用机制不同的多种化疗药物表现出的交叉抵抗现象,是肿瘤难治疗、易复发的主要原因之一。研究表明,雷公藤红素联合其他药物增敏是解决肿瘤MDR的一种可靠方法。Lu等[51]发现TNFα与醉茄素A 2.5 μmol/L或雷公藤红素0.5 μmol/L联合作用时,以剂量相关地方式激活Caspase-3、9,下调X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP),诱导人乳腺癌MDA-MB-231细胞凋亡。这种结合还导致蛋白酶体靶蛋白IκBα的积累,从而抑制NF-κB信号的激活,从而使MDA-MB-231细胞对醉茄素A和雷公藤红素增敏。有研究者探讨了雷公藤红素联合表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKIs)对T790M突变人肺癌H1975细胞生长的影响及可能的机制,结果发现联合用药抑制H1975细胞EGFR、STAT3、p-Akt和p-ERK的表达和磷酸化,提示通过抑制p-EGFR途径抑制H1975细胞的侵袭[52]。同时,体内实验也证明了雷公藤红素联合EGFR-TKIs对小鼠肿瘤生长具有更显著的抑制作用。Boridy等[53]通过雷公藤红素与替拉替尼联用,抑制了HSP90靶向蛋白毒性应激反应,可使人胶质母细胞瘤对雷公藤红素治疗增敏,增加多泛素化聚集体和p62积累,直接影响蛋白稳定,从而克服胶质母细胞瘤中的MDR。雷公藤红素除了与药物联用可以增加抗肿瘤效果以外,还可以通过增强肺癌细胞辐射敏感性来对抗肿瘤。Lee等[54]检测了雷公藤红素的放射增敏活性,结果表明EGFR、人表皮生长因子受体-2(human epidermal growth factor receptor 2,ErbB2)和Survivin水平降低,丝氨酸(serine,Ser)15和Ser20残基磷酸化同时抑制其蛋白酶体降解以及上调p53水平。
2.1.2 诱导肿瘤细胞凋亡 Yan等[15]对拉帕替尼5 μmol/L与雷公藤红素5 μmol/L联合诱导HER2/neu高表达的人乳腺癌MDAMB-453细胞凋亡进行研究,发现两药联合可以通过上调凋亡相关蛋白(Caspase-9、3),下调生长途径相关蛋白(HER2、p-HER2、p-Akt和p-ERK1/2)以及降低HER2膜蛋白表达来增强细胞的凋亡和生长抑制。Zhu等[55]发现Bcl-2抑制剂ABT-737 10 μmol/L与雷公藤红素1.25 μmol/L联合应用可协同抑制肝癌细胞增殖,诱导细胞凋亡。其作用的通路包括内质网应激介导的细胞凋亡和线粒体参与的内源性信号途径等。线粒体参与的内源性信号途径具体包括增强Caspase-3和PARP的裂解作用,诱导Bax积累,降低Bcl-2和Bcl-xL表达水平,同时上调Bim和重组p53,上调凋亡调节因子(recombinant p53 upregulated modulator of apoptosis,PUMA)的表达及Cyt-c的释放。内质网应激被激活,ATF4和CHOP蛋白的表达增强,eIF2α磷酸化的增加诱导了Noxa的激活。人类髓细胞白血病-1(myeloid leukemia cell-1,Mcl-1)作为一种重要的凋亡因子,由于其与ABT-737的亲和力较弱而不能使ABT-737发挥出较强的肿瘤杀伤活性。将ABT-737与雷公藤红素联用促进了Noxa与Mcl-1的相互作用,导致Mcl-1的表达减少从而增强了细胞凋亡。在研究人恶性脑胶质瘤U87-MG细胞的实验中发现,雷公藤红素联合TRAIL可以通过上调DR5表达并激活Caspase-8、Caspase-3和PARP诱导死亡受体途径的凋亡[56]。雷公藤红素联合顺铂也通过线粒体和内质网途径促进人骨肉瘤U-2OS细胞凋亡。研究发现其作用靶点包括上调Cyt-c、Caspase-3和C/EBP同源蛋白的表达,下调Bcl-2、PARP、葡萄糖(相对分子质量78 000)调节蛋白和Caspase-9的表达[57]。
2.1.3 抑制肿瘤细胞转移 Zhang等[58]发现雷公藤红素和索拉非尼联用可以抑制Akt途径和VEGF自分泌系统增强对HepG2细胞和小鼠肝癌Hepa1-6细胞的抗肿瘤活性。研究发现miR-33a-5p在肺腺癌组织中表达下调,提示miR-33a-5p可能是一种抑癌基因[59],且经雷公藤红素处理后,miR-33a-5p表达上调,其上调可以增强细胞对雷公藤红素的敏感性,发挥协同抗肿瘤作用。通过免疫印迹法显示其抗肿瘤作用的机制主要是由于雷公藤红素上调miR-33a-5p的表达,miR-33a-5p的高表达抑制mTOR及其下游效应(mTOR、p-p70S6K和p-4EBP1的表达下降)。此外,有研究发现雷公藤红素可与5-氟尿嘧啶、盐霉素、诱导型一氧化氮合成酶抑制剂1400W和LNIO联合应用增强抑制人结肠癌HT-29和HCT116细胞的增殖、迁移[60]。进一步研究表明雷公藤红素抑制大肠癌细胞的血管生成主要是通过抑制血管生成途径中的关键基因[胸腺嘧啶核苷酸磷酸化酶(thymidine phosphorylase,TYMP)、人血管内皮钙黏蛋白5(cadherin 5,CDH5)、血小板反应蛋白2(thrombospondin 2,THBS2)、瘦素(leptin,LEP)、MMP-9和TNF]和蛋白(IL-1β、MMP-9、血小板衍生生长因子、丝氨酸蛋白酶抑制剂E1和组织基质金属蛋白酶抑制剂-4)的表达。Shanmugam等[61]报道了通过雷公藤红素与硼替佐米联合使用可以抑制CXCR4和MMP-9的表达,降低血清IL-6和TNF-α水平来抑制多发性骨髓瘤MM细胞的侵袭和迁移,这可能成为治疗骨髓瘤和其他血液系统恶性肿瘤的有效途径。
2.1.4 阻滞细胞周期 Jiang等[62]将雷公藤甲素和雷公藤红素联用处理人肺癌H1299细胞和人非小细胞肺腺癌H157细胞后,用PI染色流式细胞仪检测细胞周期分布,发现雷公藤甲素和雷公藤红素联用可诱导2种肿瘤细胞的G2/M期积聚和G0/G1期减少。为进一步探讨雷公藤甲素和雷公藤红素阻滞细胞周期的分子机制,采用免疫印迹法检测了细胞周期相关蛋白的表达。结果表明,这种机制主要是通过显著上调G2/M期细胞周期调控蛋白CDK1、Cyclin B和p21蛋白水平以及降低CDK2/4/6、Cyclin D/E、膜母细胞瘤蛋白(retinoblastoma protein,pRb)、p27蛋白水平来实现的。同样,有研究者发现雷公藤红素1 μmol/L和柳氮磺胺吡啶600 μmol/L联用可以诱导人胶质瘤SNB-19细胞在G2/M期的进展明显受阻,受阻率达到46.6%[63]。
2.1.5 诱导肿瘤细胞自噬 细胞自噬同样是抑制肿瘤细胞增殖的重要方式,Duan等[64]用雷公藤红素联合鞣花酸处理人肺癌HOP62细胞和H1975细胞后,检测了绿色荧光蛋白(green fluorescent protein,GFP)标记的LC3阳性自噬小体的形成。实验发现与单独在细胞中使用鞣花酸25 μmol/L或雷公藤红素0.75 μmol/L进行处理相比,联合治疗可诱导细胞核和线粒体中的GFP-LC3点显著增加和LC3-II积累,下调p-Akt并抑制mTOR磷酸化和p70S6K的表达,此外还降低蛋白磷酸酶2A癌性抑制因子(cancerous inhibitor of protein phosphatase 2A,CIP2A)表达。靶向雄激素受体(androgen receptor,AR)轴是前列腺癌治疗的标准策略,miR-101是一种自噬的抑制剂,Guo等[65]发现AR通过反式激活miR-101来抑制自噬。因此miR-101模拟物与雷公藤红素联合应用治疗前列腺癌可能是一种有前途的治疗方法。
雷公藤红素联合应用抗肿瘤机制见表1。

表1 雷公藤红素联合应用抗肿瘤作用机制Table 1 Antitumor mechanism of celastrol in combination
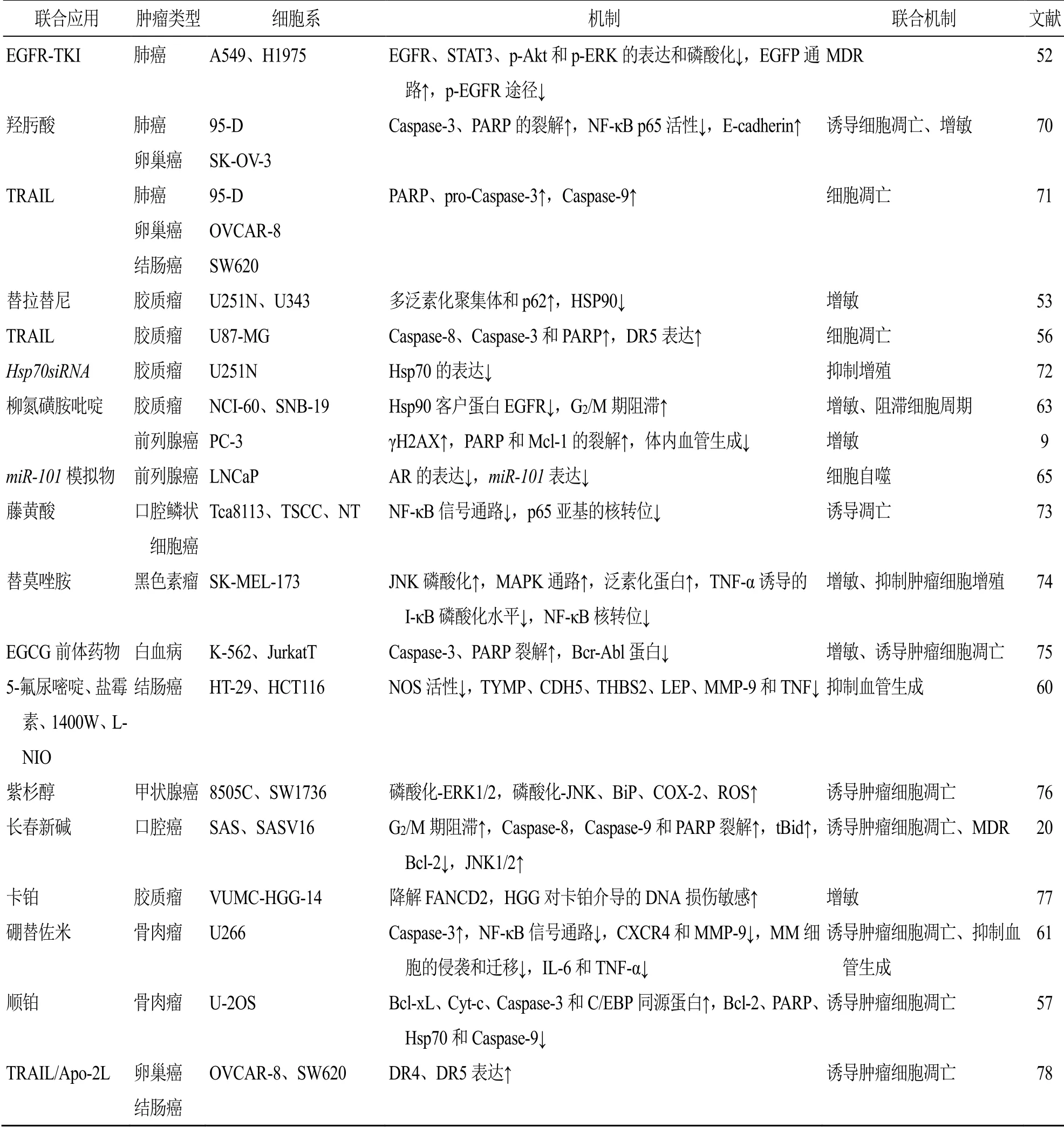
续表1
2.2 药物递送系统用于雷公藤红素的联合抗肿瘤
虽然雷公藤红素联合其他药物有着良好的抗肿瘤效果,但由于其各种物理化学和药动学限制,如低水溶性、低生物利用度和靶向性不足,限制了这些化合物在临床中的使用。纳米技术在药物传递领域的积极探索为联合用药抗肿瘤带来了新思路。纳米粒通过粒径控制、结构改造和表面修饰等途径,可具有较强的载药能力、体内长循环、肿瘤组织被动或主动靶向等特点[35]。鉴于纳米技术的优势,纳米载体与前景较好的中药相关单体活性化合物的结合,对于探索药物与细胞相互作用的相关机制,促进纳米载体在临床治疗中的潜在应用具有重要意义。
2.2.1 与化疗药物联合用于药物递送系统 有研究报道将雷公藤红素负载到介孔二氧化硅纳米颗粒中,将阿西替尼负载到聚乙二醇化脂质双层中,制备了负载阿西替尼/雷公藤红素的复合纳米颗粒,得到的纳米粒粒径约为120 nm,多分散指数狭窄(约0.07)。体外细胞毒性实验发现复合纳米颗粒能有效地抑制血管生成和线粒体功能,并能有效地内化小鼠鳞状细胞癌SCC-7细胞、人乳腺癌BT-474细胞和人神经母细胞瘤SH-SY5Y细胞。在异种肿瘤模型中,复合纳米颗粒组小鼠的抑瘤率明显高于其他组,抑瘤率达到64%[79]。Hu等[80]将疏水的雷公藤红素和亲水性的吲哚胺2,3-加双氧酶抑制剂1-甲基色氨酸同时负载到透明质酸包被的阳离子白蛋白纳米粒(hyaluronic acid coated cationic albumin nanoparticle,HNPs)中,所得纳米粒平均粒径约为300 nm,实现了层次化的纳米结构,并有效地将小分子药物输送到胰腺肿瘤部位。在透明质酸酶存在的情况下,HNPs的粒径减小,以促进深入肿瘤组织的渗透。在C57BL/6小鼠移植模型中的生物分布研究表明,HNPs增加了肿瘤的积聚,延长了HNPs的循环时间。与单独使用雷公藤红素相比,雷公藤红素联合1-甲基色氨酸通过改善肿瘤微环境的免疫抑制作用,增强了抑制肿瘤的效果。同时HNPs可减轻体内使用雷公藤红素的不良反应如心脏毒性,提高安全性。在促结缔组织增生性黑色素瘤中,肿瘤细胞和肿瘤相关成纤维细胞的纤维化以及肿瘤微环境的免疫抑制影响了抗肿瘤的疗效。为了解决这一难题,Liu等[81]开发了一种基于米托蒽醌和雷公藤红素靶向递送的创新化学免疫策略,研究发现当米托蒽醌和雷公藤红素以最佳比例(5∶1)有效地共传递到肿瘤部位时显著地触发了免疫原性肿瘤细胞凋亡并恢复了肿瘤抗原识别,从而激发了整体的抗肿瘤免疫,通过协同作用减少了药物用量和不良反应。纳米载体介导的化学免疫治疗成功地重塑了纤维化和免疫抑制的肿瘤微环境,阻止了肿瘤的发展,并进一步抑制了肿瘤向主要器官的转移。
2.2.2与中药活性成分联合用于药物递送系统 秦越等[82]采用经典的薄膜水合的方法制备了基于丹参酮IIA磺酸钠和小粒径的雷公藤红素微乳的多组分脂质体,该脂质体通过最初释放丹参酮IIA磺酸钠表现出协同的抗乳腺癌活性用于调节肿瘤微环境,随后释放雷公藤红素微乳以消灭肿瘤组织。体外研究表明,该脂质体可诱导MCF-7细胞大量凋亡,表明其对肿瘤细胞具有协同的细胞毒性作用。此外,与单独使用雷公藤红素相比,该脂质体的全身毒性较小。沈展等[83]采用“混匀-滴注”方法制备转铁蛋白修饰的β-榄香烯-雷公藤红素共传递微乳用于协同靶向抗结直肠癌。通过四甲基偶氮唑盐法得到β-榄香烯与雷公藤联合给药的最佳比例40∶1,对人结肠癌Lovo、HT-29细胞的半数抑制浓度半数抑制浓度(median inhibition concentration,IC50)分别为(11.7±0.6)、(27.4±1.2)μg/mL,联合指数(combination index,CI)分别为0.61、0.72。该微乳与Lovo细胞孵育4 h后的摄取量为7.2 μg/mg,是β-榄香烯+雷公藤红素给药组的3.3倍。该微乳能够引发59.2%的Lovo细胞凋亡,对荷Lovo大肠癌裸鼠的肿瘤生长有明显的抑制作用。相比单独使用雷公藤红素,该微乳给药组裸鼠的肿瘤组织HE染色切片出现大量的细胞坏死,Ki-67免疫组化切片显示肿瘤细胞增殖被明显抑制。另外有研究者构建了转铁蛋白和叶酸双重修饰的薏苡仁油-雷公藤红素微乳,平均粒径为(52.52±0.11)nm,多分散指数为0.124±0.019,Zeta电位为(-21.50±1.70)mV,且具有较好的体外稳定性。细胞实验表明,该微乳对MCF-7、A549细胞的IC50分别为0.77、0.85 μmol/L,游离雷公藤红素对MCF-7细胞的IC50值(1.52 μmol/L)高于各微乳组,提示微乳可能通过摄取增强来提高细胞毒性[84]。
2.2.3 与其他治疗方式联合用于药物递送系统 除了与常规的化疗药物和中药活性成分联合,雷公藤红素还可以联合靶向肿瘤微环境的载体实现靶向协同抗肿瘤。Tan等[85]将亲脂性阳离子(4-羧丁基)三苯基溴化膦与类糖脂结合物偶联,得到线粒体靶向结合物,再负载弱酸性药物雷公藤红素后,得到CTPP-线粒体靶向结合物/雷公藤红素胶束,对线粒体碱性pH值(8.0)有选择性的响应。受胶束疏水核心与雷公藤红素之间较弱的相互作用所控制,在pH值为8.0时,雷公藤红素具有较高的溶解性,该胶束对线粒体碱性pH有较强的选择性。但在pH值为7.4、5.0时,药物有缓慢的释放行为,减少药物在细胞质和溶酶体中的渗漏。体内实验中,以MCF-7裸鼠移植瘤为模型,该胶束的抑瘤率为80.17%,明显高于类糖脂结合物/雷公藤红素(58.35%)和雷公藤红素(54.89%)。光敏感型纳米材料目前研究热点之一,其中TiO2纳米纤维作为生物相容性最好的半导体纳米材料之一,可以作为一种良好的光敏剂材料,在药物载体和光动力疗法治疗疾病等领域显示出潜在的应用前景。研究者将TiO2纳米纤维引入雷公藤红素后对所制备的纳米进行表征,其表面呈针状,宽度约为80 nm,长度为200~5000 nm。当雷公藤红素和TiO2纳米纤维结合后,在紫外线照射下HepG2细胞的凋亡率增加到43.9%,与对照组比较有显著性差异。纳米纤维与雷公藤红素形成的纳米复合材料还可以增强雷公藤红素对HepG2细胞的细胞毒作用,降低药物消耗,从而降低相关药物的不良反应[86]。
3 结语
随着越来越多中药活性成分抗肿瘤研究的开展,中药在抗肿瘤方面的作用在国内外都得到了普遍认可。雷公藤红素作为一种目前研究比较深入且具备较好成药性的中药活性成分,具有广谱、多途径、多靶点等特点,可以有效地抑制恶性肿瘤细胞和异种移植物。然而目前其作用机制仍有一部分尚未得到充分论证,为了进一步提高其在未来临床实践中的潜力,对于其抗肿瘤机制和免疫学靶点的研究是必不可少的。虽然雷公藤红素具有良好的抗肿瘤作用,但还没有上市药品,主要是由于毒性较大,口服给药后会引起胃肠道不良反应,且易产生全身性的不良反应,并且有报道发现,雷公藤红素容易造成严重的器官毒性,如心脏、肝脏和神经系统毒性,其有效剂量和毒性剂量还有待进一步探究[87-89]。另外,雷公藤红素为难溶性物质,口服生物利用度较低,上述因素严重限制了该药物的临床应用。
肿瘤发病机制复杂,单一的药物治疗难以达到预期的效果且容易产生耐药性或严重的不良反应,使得抗肿瘤药物的疗效和长期使用相当有限。通过药物联合应用由于其作用机制不同,可以同时调节多种信号通路,从而起到协同增效的作用同时减少MDR现象和不良反应的发生。因此药物的联合治疗已经成为肿瘤治疗的一种有效途径,具有广阔的前景。但联合用药易受不同药物体内代谢特性的影响,致到达肿瘤部位的药量较少。纳米递药系统可同时转运2种或多种药物,增加药物溶解性,改善药物的药动学和药理特性,提高药物靶向性从而限制药物在肾脏、肝脏、脾脏和其他非靶向器官中的蓄积等特点。因此,采用雷公藤红素联合用药纳米递药系统为药物研发以及临床运用提供了新道路。
即便如此,纳米递药系统仍存在一些问题需要解决:(1)载药率过低。在制备纳米的时候注意材料的选择,如选择配体修饰及多孔结构的材料;此外制备工艺的考察筛选出最佳处方可以在一定程度上改善载药率过低的问题;(2)在安全性方面,使用获得上市许可的生物相容性较好的纳米材料构建纳米释药系统有望回避载体的安全性问题,寻找特异性更好的受体及相关配体也可以减少纳米载体在其他正常组织中的分布,从而减少毒性;(3)代谢不稳定。纳米在进入人体以后还容易与一些蛋白形成蛋白冠,使得纳米粒被网状内皮系统清除。多数纳米载体特异性释药性能差,药物被突然释放,导致局部浓度过高产生较大的毒性。因此,如何改良药物的缓控释放性能,避免频繁给药,维持合适的血药浓度,增加治疗的稳定性也是今后的研究方向。
利益冲突所有作者均声明不存在利益冲突