辣木叶提取物对便秘小鼠润肠通便的作用及机制研究
2021-07-21田梦媛王承潇崔秀明
党 玥 ,田梦媛 ,王承潇 ,曲 媛 ,崔秀明 *,杨 野 *
1.昆明理工大学生命科学与技术学院,云南 昆明 650500
2.云南省三七资源可持续利用重点实验室,云南 昆明 650500
便秘是由多种病因引起的常见病症,排便次数减少、排便时间延长是便秘的常见症型,是由胃肠功能紊乱导致的一种疾病[1]。长期便秘会造成肠道微生态失衡,还有可能诱发肠梗阻或肠道恶性肿瘤。此外,长期便秘还易引发神经衰弱、心脑血管等疾病。目前,促进胃肠运动的西药通常伴随着临床不良反应,长期使用润肠通便的中药可能出现药物依赖、损伤脾胃等症状。因此,寻找出一种不良反应小并能改善便秘症状的药物至关重要。
辣木Moringa oleiferaLam.为辣木科辣木属常绿或半落叶植物,最早记录于公元前印度医学写本《妙闻本集》和《遮罗迦本集》中[2]。在印度,辣木叶用途最为广泛,可以降低胆固醇、改善便秘、治疗糖尿病、抑制肿瘤细胞并诱导其凋亡;其根、花、茎、豆荚、籽也可以治疗溃疡、抗氧化、降血糖、抗菌、抑制肝损伤等[3]。在南亚、南非等国家,辣木全株可以治疗疟疾、头痛、糖尿病等疾病。我国于100多年前引种印度辣木,如今云南、广东、海南等地均有栽培。因辣木叶产量大,目前对辣木的研究多集中在叶上。研究表明,辣木叶水提物可以降血糖、提高抗氧化酶活性、降低脂质过氧化水平等[4];辣木叶甲醇提取物具有抗氧化、抗癌等作用[5];辣木叶乙醇提取物具有护肝、降血压、保护心脏等功效[6]。因辣木含有黄酮、生物碱、皂苷、多糖等多种成分[7],以辣木叶提取物作为考察对象更能反映出辣木在临床的应用效果。
本研究通过失水燥结法建立小鼠便秘模型,探讨辣木叶提取物对便秘小鼠的润肠通便作用及其作用机制,为辣木叶治疗便秘提供依据。
1 材料
1.1 动物
SPF级昆明种小鼠90只,雌雄各半,8周龄,体质量18~22 g,购自湖南斯莱克景达动物实验有限公司,动物许可证号SCXK(湘)2019-0004。动物于实验动物中心(恒温25 ℃,12 h光/暗周期)适应性饲养1周。动物实验经昆明理工大学动物伦理委员会批准,批准号PZWH(滇)K。
1.2 药材
辣木叶采自于云南省元谋县热作所,经昆明理工大学生命科学与技术学院崔秀明研究员鉴定为辣木M.oleiferaLam.的干燥叶。
1.3 药品与试剂
对照品紫云英苷(质量分数≥98%,批号AF20063001)、异槲皮苷(质量分数≥98%,批号AF9030801)购自成都埃法生物科技有限公司;酚酞片(批号180413,50 mg/片)购自山西亨瑞达制药有限公司;胃动素ELISA试剂盒(批号1903M09)、胃泌素ELISA试剂盒(批号1903M15)、内皮素ELISA试剂盒(批号1903M17)、一氧化氮ELISA试剂盒(批号1903M33)购自武汉酶免生物科技有限公司;胃动素抗体(批号GR42490-50)、内皮素抗体(批号GR3227037-1)、胃泌素抗体(批号GR475102-41)购自英国Abcam公司;内皮型一氧化氮合酶(endothelial nitrieoxide synthase,eNOS)抗体(批号HN0824)购自杭州华安生物技术有限公司;HRP标记的山羊抗兔抗体(批号GB0207)购自武汉赛维尔生物科技有限公司。
1.4 仪器
AX124ZH电子分析天平(奥豪斯仪器有限公司);酶标仪(德国BMG Labtech公司);LC-20A高效液相色谱仪(日本岛津公司);TDZ5-WS台式低速离心机(湖南湘仪实验仪器设备有限公司);Nikon DS-U3显微镜(日本尼康公司)。
2 方法
2.1 辣木叶提取物成分测定
2.1.1 色谱条件[8]YMC-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为0.05%磷酸水溶液(A)-乙腈(B),梯度洗脱:0~35 min,18% B;35~40 min,18%~45% B;40~50 min,45%~100% B;50~75 min,100%~18% B;体积流量为1.0 mL/min;进样量为10 μL;柱温为30 ℃;检测波长为360 nm。
2.1.2 对照品溶液的制备 称定异槲皮苷和紫云英苷对照品1.6 mg至量瓶中,以甲醇溶解并定容,配制成质量浓度为1.6 mg/mL的对照品溶液。
2.1.3 供试品溶液的制备
(1)辣木叶醇提物:取辣木叶10 g,加入300 mL 70%乙醇回流提取40 min,浓缩。用甲醇超声溶解并过微孔滤膜,取续滤液,即得辣木叶醇提物。
(2)辣木叶水提物:取辣木叶10 g,加入500 mL纯水,85~95 ℃反复浸提3次,合并滤液后浓缩。用甲醇超声溶解并过微孔滤膜,取续滤液,即得辣木叶水提物。
2.1.4 线性关系考察 对照品溶液用甲醇分别稀释成质量浓度分别为1.6、0.8、0.4、0.2、0.1 mg/mL的对照品储备液,进样检测,记录峰面积并绘制标准曲线:紫云英苷Y=3×107X-5×106(r2=0.999 5);异槲皮苷Y=3×107X-82 784(r2=0.999 9),表明线性关系良好。
2.1.5 方法学考察 取同一批次的辣木叶提取物供试品和对照品,进样检测,进行精密度、稳定性、重复性以及加样回收率试验。
(1)精密度试验:取对照品溶液,连续进样6次,以峰面积计算紫云英苷和异槲皮苷的RSD值分别为0.49%、0.87%,表明仪器精密度良好。
(2)稳定性试验:取对照品溶液分别于0、4、6、8、12、24、48 h进样,以峰面积计算紫云英苷和异槲皮苷的RSD值分别为0.89%、1.37%,表明对照品溶液在48 h内稳定。
(3)重复性试验:制备6份供试品溶液,以质量分数计算RSD值为1.07%、0.69%,表明此测定方法重现性良好。
(4)加样回收率试验:取6份已测定的供试品溶液,按药材中紫云英苷和异槲皮苷的120%的量加入对照品溶液,计算加样回收率分别为99.58%、98.98%,RSD值分别为0.48%、0.90%。
2.2 碳末混悬液的制备
在800 mL水中加入100 g阿拉伯树胶,煮沸,溶解后再加入50 g活性炭;煮沸3次,冷却后定容至1 L备用。
2.3 造模、分组与给药
根据参考文献报道[9]以及预实验探索,将小鼠随机分为对照组、模型组、酚酞(0.05 g/kg)组以及辣木叶醇提物低、中、高剂量(0.5、1.0、2.0 g/kg)组和辣木叶水提物低、中、高剂量(0.5、1.0、2.0 g/kg)组,每组10只。按照文献方法[10],第1~4天,对照组以常规饲料喂养,模型组和各给药组喂食大米并禁水建立便秘模型。第5~8天,各组以常规饲料喂养,各给药组ig相应药物(10 mL/kg),对照组和模型组ig等剂量的生理盐水,1次/d。
2.4 辣木叶提取物对便秘小鼠排便参数的影响
第8天,各组小鼠ig碳末混悬液(10 mL/kg)再ig相应药物,记录每只小鼠首粒黑便的时间、6 h内排便总数和黑便数,测定粪便含水率。
2.5 辣木叶提取物对便秘小鼠胃肠运动的影响
各组小鼠脱颈椎处死,取全胃组织,称定胃全质量、净质量;分离肠系膜,剪取肠管,测量小肠总长度和碳末推进长度[11],并计算胃排空率和小肠推进率。
胃排空率=1-(胃全质量-胃净质量)/0.6
小肠推进率=墨汁推进长度/小肠总长度
2.6 辣木叶提取物对便秘小鼠小肠组织病理变化的影响
各组小鼠取距离盲肠部位2 cm处的回肠1~2 cm,用固定液固定24 h以上,进行苏木素-伊红(HE)染色,于显微镜下观察并拍照。
2.7 辣木叶提取物对便秘小鼠血清中胃动素、内皮素、胃泌素和一氧化氮水平的影响
小鼠眼球取血1.5 mL,4 ℃、3500 r/min离心10 min,取上层血清,按照ELISA试剂盒测定血清中胃动素、内皮素、胃泌素和一氧化氮水平。
2.8 辣木叶提取物对便秘小鼠小肠组织胃动素、内皮素、胃泌素和eNOS表达的影响
取各组小鼠小肠组织石蜡切片,脱蜡至水,抗原修复,阻断内源性过氧化氢酶,血清封闭,加入胃动素、内皮素、胃泌素和eNOS抗体孵育,再加入HRP标记的山羊抗兔抗体,DAB显色,复染细胞核,脱水封片,于显微镜下观察并拍照。
2.9 统计分析
数据以±s表示,采用SPSS 19.0软件中单因素方差分析(ANOVA)进行处理。
3 结果
3.1 辣木叶提取物成分测定
辣木叶提取物的HPLC色谱见图1,因紫云英苷和异槲皮苷作为辣木叶中的黄酮类成分,含量高并易检测,因此以其作为检测指标。辣木叶醇提物中紫云英苷和异槲皮苷质量分数分别为0.361 3%、0.348 0%,辣木叶水提物中紫云英苷和异槲皮苷质量分数分别为0.284 6%、0.040 1%。
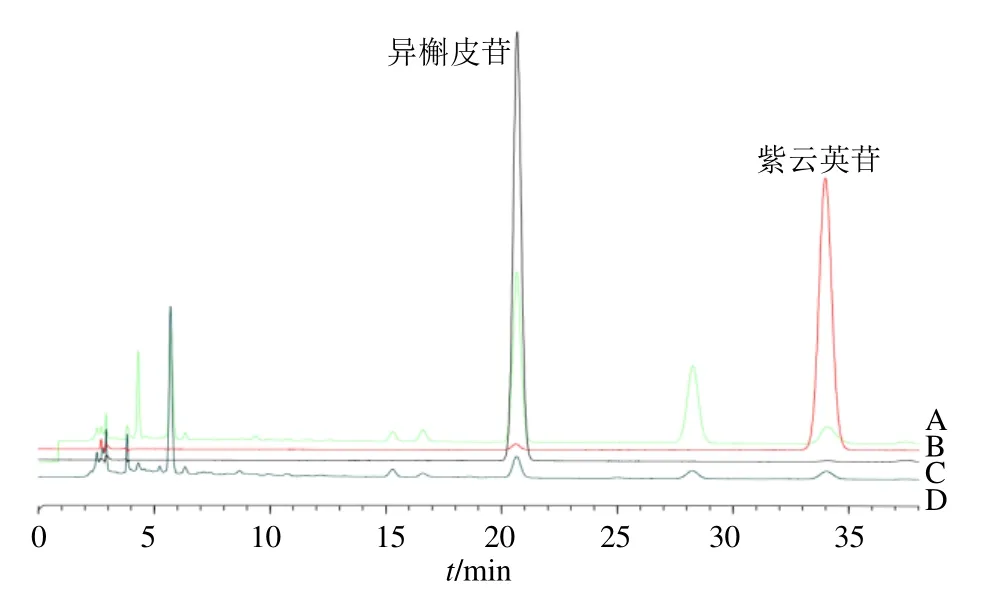
图1 辣木叶提取物的HPLC色谱图Fig.1 HPLC chromatograms of extract from Moringa oleifera leaves
3.2 辣木叶提取物对便秘小鼠排便参数的影响
如表1所示,与对照组比较,模型组小鼠体质量显著降低(P<0.01),小鼠活动次数减少、毛色暗淡,首粒黑便时间显著增加(P<0.01),6 h排便数与黑便数明显减少(P<0.01),粪便含水率显著降低(P<0.01),表明失水燥结模型制备成功。与模型组比较,各给药组小鼠首粒黑便时间显著降低(P<0.01),粪便含水率显著升高(P<0.05、0.01);辣木叶醇提物中、高剂量组及水提物高剂量组小鼠6 h排便数明显增加(P<0.05);辣木叶醇提物中、高剂量组及辣木叶水提物各剂量组小鼠黑便数明显增加(P<0.05、0.01)。
表1 辣木叶提取物对便秘小鼠排便参数的影响 (±s , n=10)Table 1 Effect of extract of M.oleifera leaves on defecation parameters of constipated mice (±s , n=10)
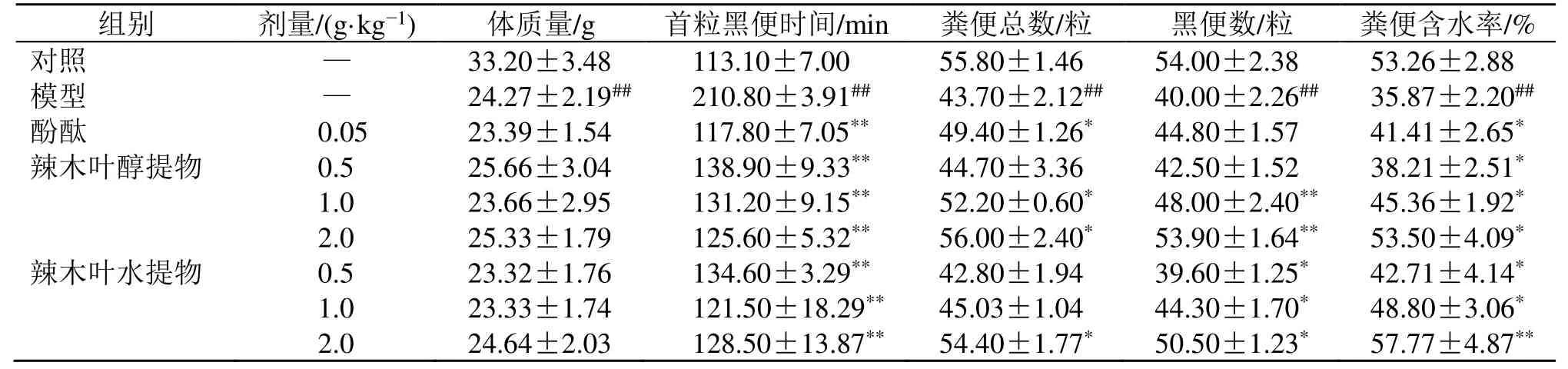
表1 辣木叶提取物对便秘小鼠排便参数的影响 (±s , n=10)Table 1 Effect of extract of M.oleifera leaves on defecation parameters of constipated mice (±s , n=10)
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01##P < 0.01 vs control group; *P < 0.05 **P < 0.01 vs model group
组别 剂量/(g·kg-1) 体质量/g 首粒黑便时间/min 粪便总数/粒 黑便数/粒 粪便含水率/%对照 — 33.20±3.48 113.10±7.00 55.80±1.46 54.00±2.38 53.26±2.88模型 — 24.27±2.19## 210.80±3.91## 43.70±2.12## 40.00±2.26## 35.87±2.20##酚酞 0.05 23.39±1.54 117.80±7.05** 49.40±1.26* 44.80±1.57 41.41±2.65*辣木叶醇提物 0.5 25.66±3.04 138.90±9.33** 44.70±3.36 42.50±1.52 38.21±2.51*1.0 23.66±2.95 131.20±9.15** 52.20±0.60* 48.00±2.40** 45.36±1.92*2.0 25.33±1.79 125.60±5.32** 56.00±2.40* 53.90±1.64** 53.50±4.09*辣木叶水提物 0.5 23.32±1.76 134.60±3.29** 42.80±1.94 39.60±1.25* 42.71±4.14*1.0 23.33±1.74 121.50±18.29** 45.03±1.04 44.30±1.70* 48.80±3.06*2.0 24.64±2.03 128.50±13.87**54.40±1.77* 50.50±1.23* 57.77±4.87**
3.3 辣木叶提取物对便秘小鼠胃肠运动的影响
如图2所示,与对照组比较,模型组小鼠胃排空率和碳末推进率显著降低(P<0.01);与模型组比较,各给药组小鼠胃排空率和碳末推进率均显著升高(P<0.05、0.01),表明辣木提取物可以加速便秘小鼠胃排空和肠道蠕动。
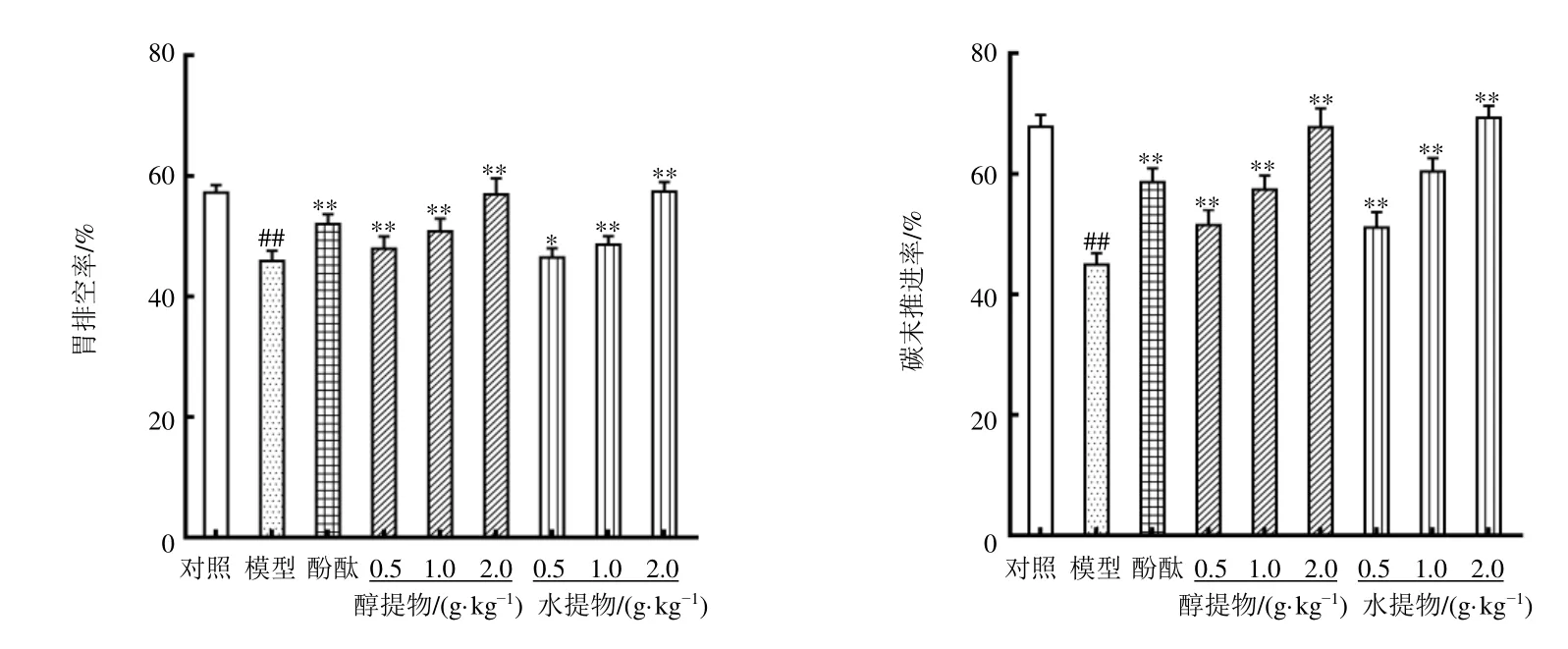
图2 辣木叶提取物对便秘小鼠胃肠运动的影响 (±s , n=10)Fig.2 Effect of extract of M.oleifera leaves on gastrointestinal motility of constipated mice (±s , n=10)
3.4 辣木叶提取物对便秘小鼠小肠组织病理变化的影响
如图3所示,对照组小鼠小肠绒毛密集且排列整齐,未发现病理变化;模型组小肠绒毛明显变短,断裂严重,柱状细胞严重受损,细胞核脱落,黏膜层、肌层存在病理变化;各给药组小鼠小肠绒毛断裂减少、柱状细胞受损减轻,表明辣木叶提取物能够修复便秘小鼠小肠损伤。
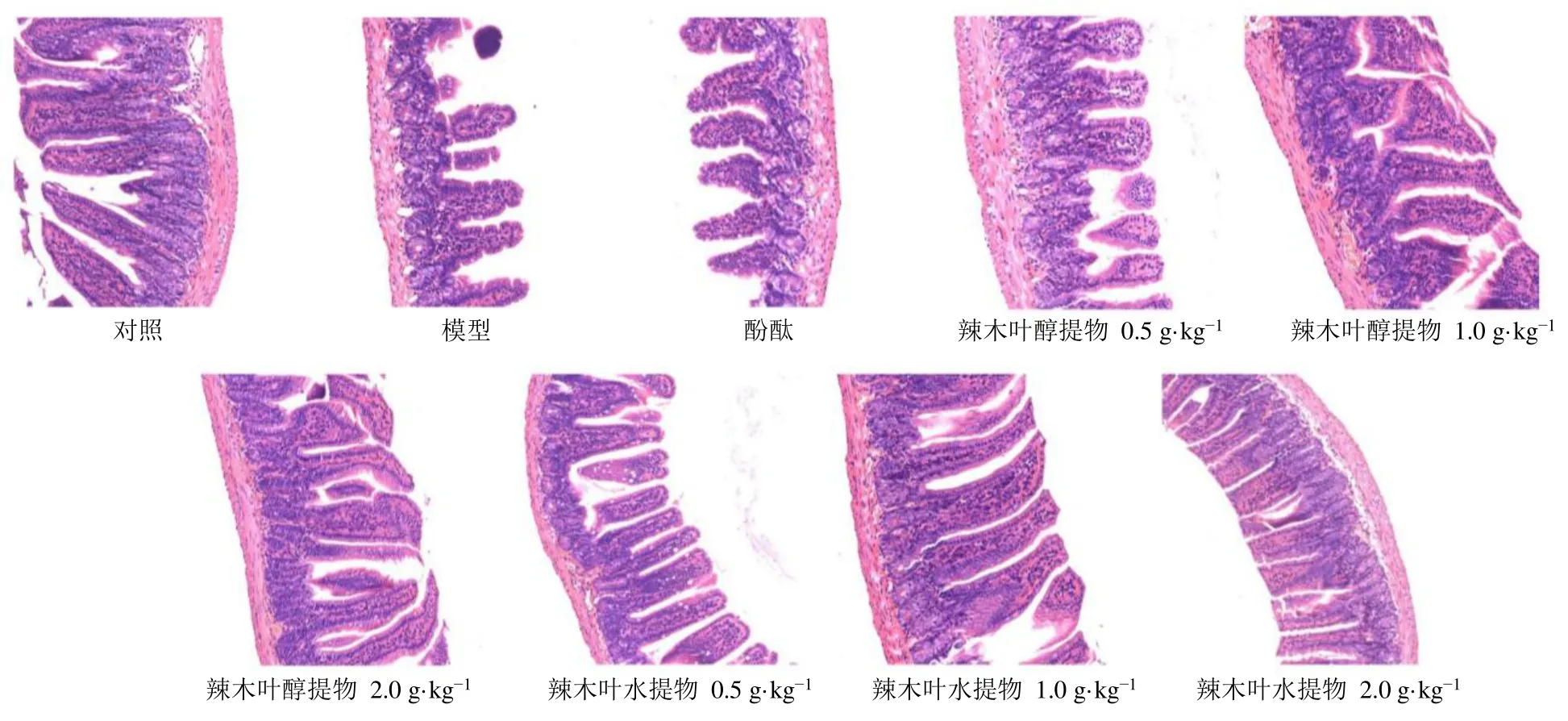
图3 辣木叶提取物对便秘小鼠小肠组织病理变化的影响 (HE, ×200)Fig.3 Effect of extract of M.oleifera leaves on pathological changes of small intestine of constipated mice (HE, × 200)
3.5 辣木叶提取物对便秘小鼠血清中胃动素、内皮素、胃泌素和一氧化氮水平的影响
如图4所示,与对照组比较,模型组小鼠血清中胃动素、内皮素和胃泌素水平显著降低(P<0.05、0.01),一氧化氮水平显著升高(P<0.01);与模型组比较,各给药组小鼠血清中胃动素、内皮素和胃泌素水平显著升高(P<0.05、0.01),辣木叶醇提物及水提物中、高剂量组一氧化氮水平显著降低(P<0.05、0.01),表明辣木叶提取物能够通过调节血清因子水平,从而缓解便秘。
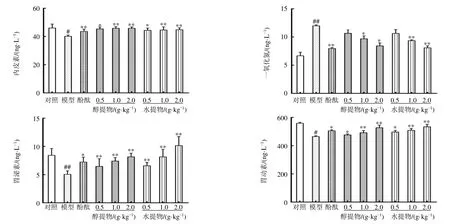
图4 辣木叶提取物对便秘小鼠血清中胃动素、内皮素、胃泌素和一氧化氮水平的影响 (±s , n=10)Fig.4 Effect of extract of M.oleifera leaves on levels of motilin, endothelin, gastrin and nitric oxide in serum of constipated mice (±s , n=10)
3.6 辣木叶提取物对便秘小鼠小肠组织胃动素、内皮素、胃泌素和eNOS表达的影响
如图5所示,胃动素、内皮素、胃泌素和eNOS在小鼠小肠黏膜胞质中表达,呈淡黄、黄色或棕黄色。与对照组相比,模型组小鼠小肠eNOS阳性表达增加,胃动素、内皮素、胃泌素阳性表达减少;与模型组相比,各给药组小肠eNOS阳性表达减少,胃动素、内皮素、胃泌素阳性表达增加。
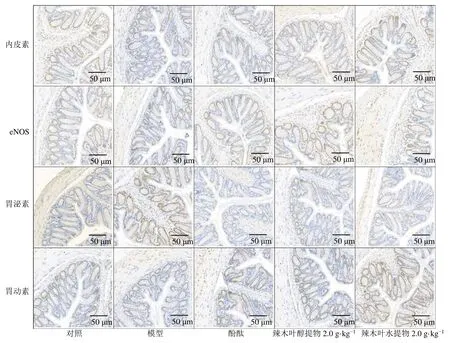
图5 辣木叶提取物对便秘小鼠小肠组织胃动素、内皮素、胃泌素和eNOS表达的影响 (×200)Fig.5 Effect of extract of M.oleifera leaves on expressions of motilin, endothelin, gastrin and eNOS in small intestine of constipated mice (× 200)
4 讨论
消化功能紊乱的症状之一是便秘,表现为胃肠运动和功能障碍。目前,促进胃肠运动的西药以西沙比利、莫沙必利和吗丁啉等为主,此类药物虽然见效快,但伴随着消化系统、神经系统等不良反应。中药中也有润肠通便的药材,如番泻叶、大黄、芒硝等能够直接刺激肠黏膜或提高肠内渗透压,使肠蠕动增加而产生泻下效应,但长期使用会出现药物依赖、结肠黑病变等不良反应[12]。辣木不仅具有降血糖、抗氧化、抑制肿瘤细胞并诱导其凋亡、调节胃肠运动等作用[2],还有富含蛋白质、维生素、矿物质等,于2012年被列为“新资源食品”[13]。
本研究结果显示,与对照组比较,模型组小鼠的首粒黑便时间明显延长,6 h内排便数量、胃排空率显著降低,表明便秘可致小鼠胃肠运动障碍。张维英等[14]用生白术的提取液和挥发油治疗便秘小鼠,发现给药后小鼠排便粒数增多,粪便水分明显增加,首次排黑便时间缩短,与本研究结果一致;表明辣木叶提取物能够改善小鼠排便状况,缓解便秘。小肠是消化和吸收营养物质的主要场所,与动物的健康生长密切相关。模型组小鼠小肠绒毛断裂,柱状细胞受损严重;辣木叶提取物高剂量组肠绒毛形态结构趋于完整,表明辣木叶提取物能够保护便秘对小鼠造成的肠道结构损伤,这可能由于辣木中的多酚、黄酮、皂苷等活性成分能够调控小肠生长因子,并修复便秘小鼠引起的小肠绒毛和结构的损伤,进一步提高小肠的吸收消化功能[15]。
胃肠道的运动和分泌主要受胃肠内分泌细胞分泌的激素和中枢肠神经系统释放的神经递质调节,并受相应受体兴奋和抑制平衡的调节[16]。其中胃泌素和胃动素刺激胃酸分泌,促进胃收缩并促进胃排空。本研究结果显示,与模型组比较,辣木叶醇提物和水提物高剂量组小鼠血清中胃泌素和胃动素水平显著升高,与文献报道一致[17]。一氧化氮是一种新型信号分子,能够通过抑制胃肠道兴奋性,减缓胃肠运动及胃排空,引发便秘;内皮素是调节心血管功能的重要因子,便秘还是多种心脑血管疾病的诱发因素,因此维持体内内皮素正常水平对于预防心脑血管疾病有重要作用[18]。右归丸能够降低便秘大鼠血清中一氧化氮、5-羟色胺水平,从而改善大鼠便秘症状[19]。本研究结果显示,辣木叶醇提取物和水提物高剂量组小鼠血清中内皮素水平显著升高,一氧化氮水平显著降低,与免疫组化结果趋势相同。表明辣木叶提取物对津亏燥结所致胃肠功能障碍小鼠具有调节作用,其作用机制可能为通过提高小鼠血清中内皮素水平从而维持心脑血管的正常功能,通过增加小鼠血清中胃泌素和胃动素水平、降低一氧化氮水平,从而改善胃肠吸收、运动功能,缓解便秘。
综上所述,辣木叶提取物能够加快小鼠胃肠运动,可能与修复便秘引起的肠道损伤、调节胃肠相关激素及相关蛋白的表达有关。
利益冲突所有作者均声明不存在利益冲突
