Plackett-Burman联用响应面法优化超声波-酸法提取狐臭柴果胶工艺
2021-07-21李扬杨宁线谢国芳王艳秋阳娇张明生
李扬,杨宁线,谢国芳,王艳秋,阳娇,张明生*
1(贵州大学 生命科学学院,贵州 贵阳,550025) 2(山地植物资源保护与种质创新教育部重点实验室,贵州 贵阳,550025)
果胶是植物初生细胞壁和中层细胞膜中的一类复合多糖,为复杂的天然高分子聚合物。果胶的相对分子质量为10 000~400 000其主要成分为由α-1,4-糖苷键链接的半乳糖醛酸与鼠李糖、半乳糖、阿拉伯糖等中性糖形成的聚合物。根据酯化程度的不同,果胶可分为高酯化度果胶(酯化度>50%)和低酯化度果胶(酯化度<50%)[1-2]。果胶具有凝胶、增稠和乳化等多种功能,是一种安全、实用的食品添加剂,可以从植物特定部位提取,如苹果皮、香蕉皮和葵花籽盘等[3-5]。然而,有关狐臭柴叶片果胶提取的研究还很有限。
狐臭柴(PremnapuberulaPamp)属马鞭草科豆腐柴属的落叶灌木,在我国主要分布于贵州、广东、广西、四川、重庆、云南等省区,生长于海拔500~1 200 m的常绿阔叶林下或路边灌木林中[6]。安全性评估表明,豆腐柴属植物的叶片既可用于功能食品开发又可作为提取果胶的材料,产品安全且具有较高营养,还能发挥保健作用[7]。本课题组前期工作中已建立狐臭柴种苗繁育技术[8]和种植示范基地,其果胶的开发利用是后续的重点工作。
目前,植物中果胶的提取方法有酸提醇沉法、草酸铵法、酶法、碱法、离子交换法、微波法、超声波法等[9-12]。酸提醇沉法较为常规,在果胶工业生产中应用较多[13]。本研究采用了超声波辅助与酸提醇沉结合的方法提取狐臭柴叶片果胶,利用超声波的空化效应促使植物组织破壁、内含物充分溶出,之后通过低成本酸液提取果胶。本研究采用超声波辅助法,在单因素试验基础上,运用Plackett-Burman试验结合Box-Behnken响应面法优化提取条件以提高果胶得率,并对果胶的分子结构和理化性质进行分析,建立果胶高效提取优化工艺,以期为狐臭柴果胶产业化开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
实验材料:狐臭柴(P.puberulaPamp)野生资源来自贵州省务川仡佬族苗族自治县,经贵州大学熊源新教授鉴定,已在贵州大学实验基地人工种植多年,狐臭柴叶片集中在8月份采摘。
柠檬酸,天津市永大化学试剂有限公司;D-(+)-半乳糖醛酸、D-葡萄糖、L-鼠李糖、D-半乳糖、D-阿拉伯糖、D-葡萄糖醛酸、D-甘露糖、D-木糖、L-岩藻糖,上海源叶生物科技有限公司;盐酸羟胺、肌醇、酚酞、柑橘皮果胶,生工生物工程(上海)股份有限公司;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),东京化成工业株式会社;以上均为分析级。食品级果胶,河南万邦实业有限公司。
1.2 仪器与设备
L18-Y68型破壁机,山东九阳股份有限公司;H4-20KR冷冻离心机,湖南可成仪器设备有限公司;101-3A型电热鼓风干燥箱,天津市泰斯特仪器有限公司;超声波细胞破碎仪,南京舜玛仪器设备有限公司;Agilent 1260 Infinity 高效液相色谱仪、7890A-5975C气质联用仪,美国安捷伦科技有限公司;Nicolet iS50傅里叶变换红外光谱仪,美国赛默飞世尔科技公司;TAXT plus质构仪,英国Stable Micro System公司;SepectraMax 190型微孔板检测系统,美国美谷分子仪器有限公司。
1.3 实验方法
1.3.1 叶片果胶提取工艺及果胶得率计算
取-80 ℃冰箱保存的冻叶于料理机加入酸提液打成匀浆,在设计的酸液pH、液料比、超声时间、超声功率、提取温度和提取时间的条件下,用柠檬酸溶液提取5 g样品,先使用超声波细胞破碎仪处理样品,再放入水浴锅中隔水浸提,提取完成后6 000 r/min离心10 min,取上清液。加入1.2倍体积无水乙醇密封静置6 h,用100目过滤网过滤,沉淀物再加20 mL 体积分数为95%乙醇进行脱色处理,搅拌均匀,密封静置1 h后用100目过滤网过滤,取沉淀物于40 ℃鼓风干燥后磨粉,所得干燥品为果胶干粉,果胶提取率按公式(1)计算:

(1)
式中:m,果胶干燥品质量,g;m0,叶片质量,g。
1.3.2 叶片果胶单因素试验设计
设定酸液pH 2.00、液料比12∶1、超声时间15 min、超声功率500 W、提取温度80℃、提取时间90 min,固定此水平值,分别考查酸液pH(1.5、1.75、2.00、2.25、2.50)、液料比(8∶1、10∶1、12∶1、14∶1、16∶1)、超声时间(5、10、15、20、25 min)、超声功率(300、400、500、600、700 W)、提取温度(70、75、80、85、90 ℃)、提取时间(30、60、90、120、150 min)对果胶得率的影响。
1.3.3 叶片果胶提取Plackett-Burman试验设计
根据前期单因素预试验结果,对酸液pH、液料比、超声时间、超声功率、提取温度和提取时间共6个因素进行考查,每个因素选取高低2个水平,另设3个虚拟列,设计N=12的Plackett-Burman试验(表1)。

表1 果胶提取Plackett-Burman试验设计因素及水平
1.3.4 叶片果胶提取Box-Behnken响应面试验设计
在1.3.3试验基础上,以pH、液料比、超声功率和提取时间为自变量,通过Box-Behnken设计4因素3水平的响应面试验(表2),以果胶提取率为响应值,考查各因素对于响应值的影响程度,以得出最佳工艺条件。
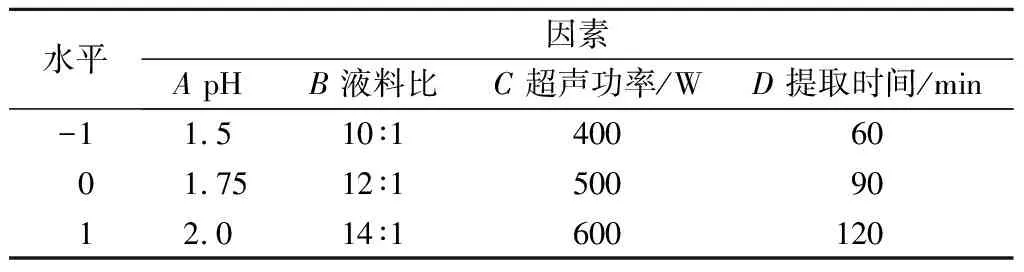
表2 果胶提取Box-Behnken响应面试验设计因素与水平
1.3.5 叶片果胶半乳糖醛酸含量和酯化度测定
果胶的半乳糖醛酸采用咔唑-硫酸法[14]测定;果胶的酯化度采用滴定法[15]测定。
1.3.6 叶片果胶分子质量与单糖组成测定
果胶分子质量测定方法:采用高效凝胶渗透色谱法测定果胶样品的分子质量分布,色谱检测条件:RI示差折光检测器;PL aquagel-OH MIXED 8 μm色谱柱;流动相:0.1 mol/L NaNO3溶液;流速1 mL/min;柱温30 ℃。称取果胶样品2 mg,溶于1 mL去离子水中,经0.45 μm水相微孔滤膜过滤后吸取100 μL样品溶液依照色谱条件进样。
果胶酸水解物和衍生物的制备方法参考晋睿冲[16]的方法,使用面积归一法[17]计算果胶中的单糖比例。
色谱条件:DB-5石英毛细管柱(30 m×0.25 mm,0.25 μm);升温程序:柱初始温度140 ℃。以4 ℃/min升到240 ℃,进样口温度250 ℃,载气流速1 mL/min,分流比为50∶1。质谱条件:离子源温度230 ℃,电离方式为EI,电子能量70 eV,扫描质量范围29~450 amu。
1.3.7 叶片果胶紫外及红外光谱分析
紫外光谱分析:配制质量分数0.25%的果胶溶液,取适量溶液于石英比色皿中,使用紫外分光光度计进行扫描,扫描波长为200~400 nm,扫描频率为2 nm/s。
红外光谱分析:将果胶粉末样品直接放在ATR晶体上,压力塔加压测试。用傅里叶红外光谱仪进行扫描,波谱的分辨率为4 cm-1,扫描100次,波谱的扫描范围为4 000~500 cm-1。
1.3.8 叶片果胶凝胶质构测定
果胶的凝胶制备方法:分别取狐臭柴叶片、柑橘标准品果胶和食品级果胶样品0.3 g到50 mL烧杯,加21 g蔗糖一起溶于去离子水,调整最后体积为30 mL。使用2 mol/L的柠檬酸调节pH至4.8,90 ℃隔水加热30 min,溶液在室温静置24 h至形成凝胶。
果胶的凝胶质构测定参考MARIY等[18]的方法。凝胶的质构测定条件:压缩测试使用柱形探头,采用TPA模式(下压5 mm,触发力2 g,测前速度、测试速度和测后速度均为0.5 mm/s),获得硬度、弹性、黏性、咀嚼性、恢复力等指标。
1.3.9 叶片果胶抗氧化性测定
参考赵磊等[19]的方法,采用体外抗氧化DPPH法测定果胶和维生素C的抗氧化活性,结果用EC50表示,即DPPH自由基清除率达到50%所需要的样品浓度。
1.3.10 数据处理
使用Design-Expert 10软件分析测试结果,以优化每个因素的最佳条件,并根据预测结果进行验证实验。实验数据采用Excel 2016和Origin 2018进行分析处理。
2 结果与分析
2.1 不同因素对叶片果胶提取率的影响
单因素试验表明,果胶提取率随pH增大先升高后降低,在pH为1.75时果胶提取率达到最大值(图1-a),这可能是由于酸性环境加大了果胶在提取液中的溶解性,但酸度过高会降解果胶分子从而使提取率降低;果胶提取率随液料比的增加先升高后降低,但减幅平缓(图1-b),这是因为液料比太小时,溶液密度大,提取液与叶片不能充分反应,在液料比为12∶1时果胶提取率达到最大值;提取率随超声时间的延长而先升高后降低,变化较为平缓,在超声时间为10 min时果胶提取率达到最大值(图1-c),这可能是由于超声时间过长,破坏了果胶的大分子结构,使提取液中的果胶不能完全在乙醇溶液中析出;提取率随超声功率的增大而先升高后降低,变化较为平缓,在超声功率为400 W时果胶提取率达到最大值(图1-d),这可能是由于随着超声波的功率加大,空化作用增强,使叶片细胞内容物更加充分析出,但超声波功率过大,过强的破碎效应使提取液中杂质增多,果胶中的半乳糖醛酸含量降低,故提取率降低;提取温度在70~85 ℃范围内,果胶提取率随温度升高而升高,这与分子热运动加剧和柠檬酸的解离程度增强有关,提取温度85 ℃时,果胶提取率达到最大(图1-e),当提取温度>85 ℃时,提取率下降,这可能是因为温度提升破坏了果胶结构,致使果胶降解所致;提取率随提取时间的延长而先升高后降低,最优的提取时间是90 min(图1-f)。

a-pH;b-液料比;c-超声时间;d-超声功率;e-提取温度;f-提取时间
2.2 影响叶片果胶提取率的关键因素
在单因素试验的基础上,通过Plackett-Burman试验和方差分析(表3、表4),从pH、液料比、超声时间、超声功率、提取温度和提取时间6个因素中筛选获得影响果胶提取率的关键因素。

表3 Plackett-Burman试验设计及果胶提取率
利用Design-Expert 10软件对表3数据进行处理,模型F值为56.36,模型极显著(P<0.01),表明该模型具有重要意义,R2=0.915 9,说明91.59%的试验数据可用该模型解释。提取率影响因素依次为X1>X6>X4>X2>X5>X3,其中X1、X6对提取率影响极显著(P<0.01),X4对提取率影响显著(P<0.05),X2对提取率的影响接近显著水平(表4)。因此,选取pH、反应时间、超声功率与液料比4个因素进行Box-Behnken试验。

表4 果胶提取Plackett-Burman试验方差分析
2.3 叶片果胶提取的最优条件
2.3.1 Box-Behnken试验优化果胶提取工艺


表5 Box-Behnken试验设计及果胶提取率响应值
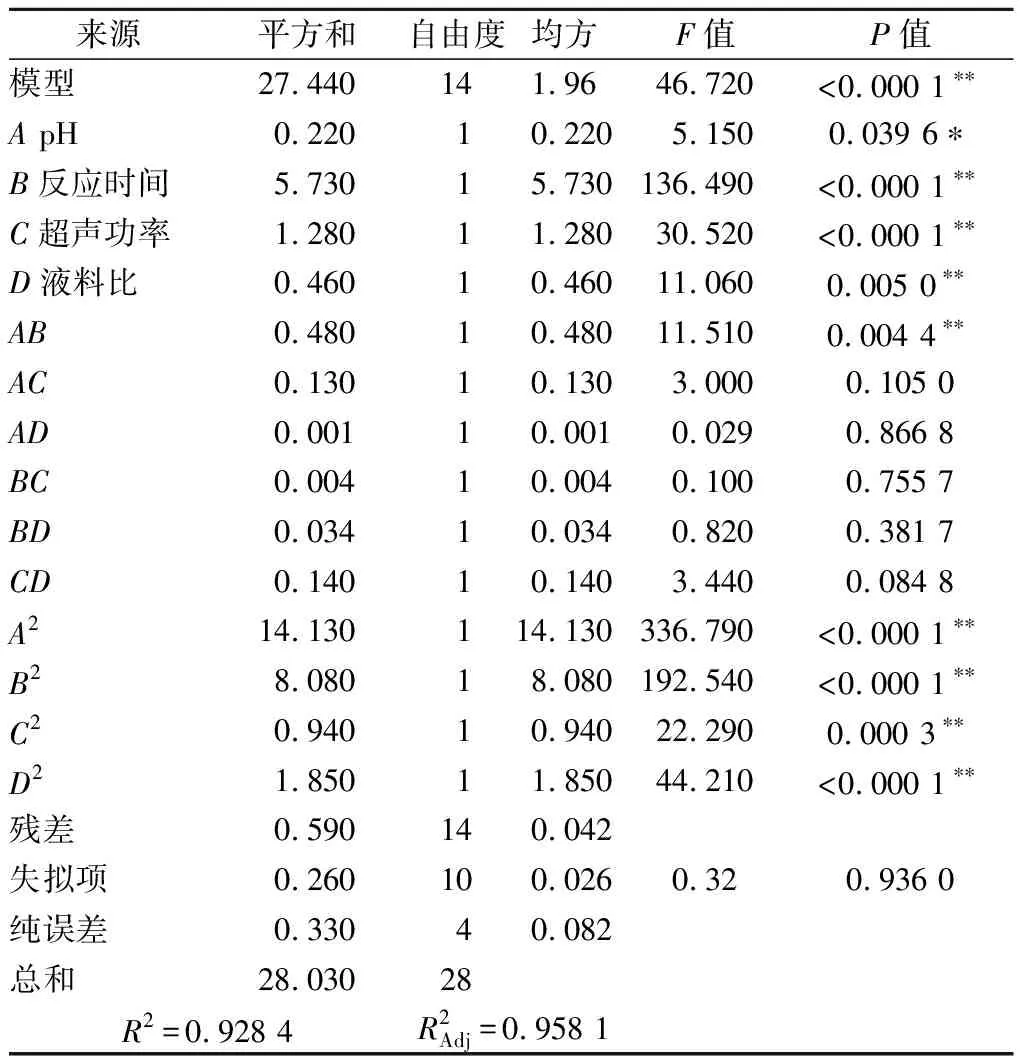
表6 果胶提取Box-Behnken试验方差分析
2.3.2 各因素交互作用对果胶得率影响的响应面分析
采用Design-Expert 10软件对试验结果进行响应面图绘制,通过响应面图可直观地分析各因素及因素相互之间的交互作用对响应值的影响。各因素之间响应面3D图和等高线图能直观反映出其相互作用的强弱,响应面曲面坡度越陡峭,等高线图越偏椭圆形,因素之间交互作用越存在显著性差异,反之则表示两因素的交互作用无显著性差异。
图2显示了pH、反应时间、超声功率和液料比中任意2个变量取0水平时其余2个变量对果胶得率的影响。3D响应面图均成抛物状,曲面有最高点,容易出现最大值。由图2可知,AB的响应面曲线最陡,且等高线密集,因此AB的交互作用对狐臭柴果胶得率的影响最为显著;依次类推,其次是CD与AC响应曲面,CD与AC的交互作用对狐臭柴果胶得率也有一定的影响;BD、BC和AD的响应曲面较为平缓,等高线疏松,BD、BC和AD的交互作用对狐臭柴果胶得率的影响较小。交互作用对果胶得率的影响大小顺序为:AB>CD>AC>BD>BC>AD。
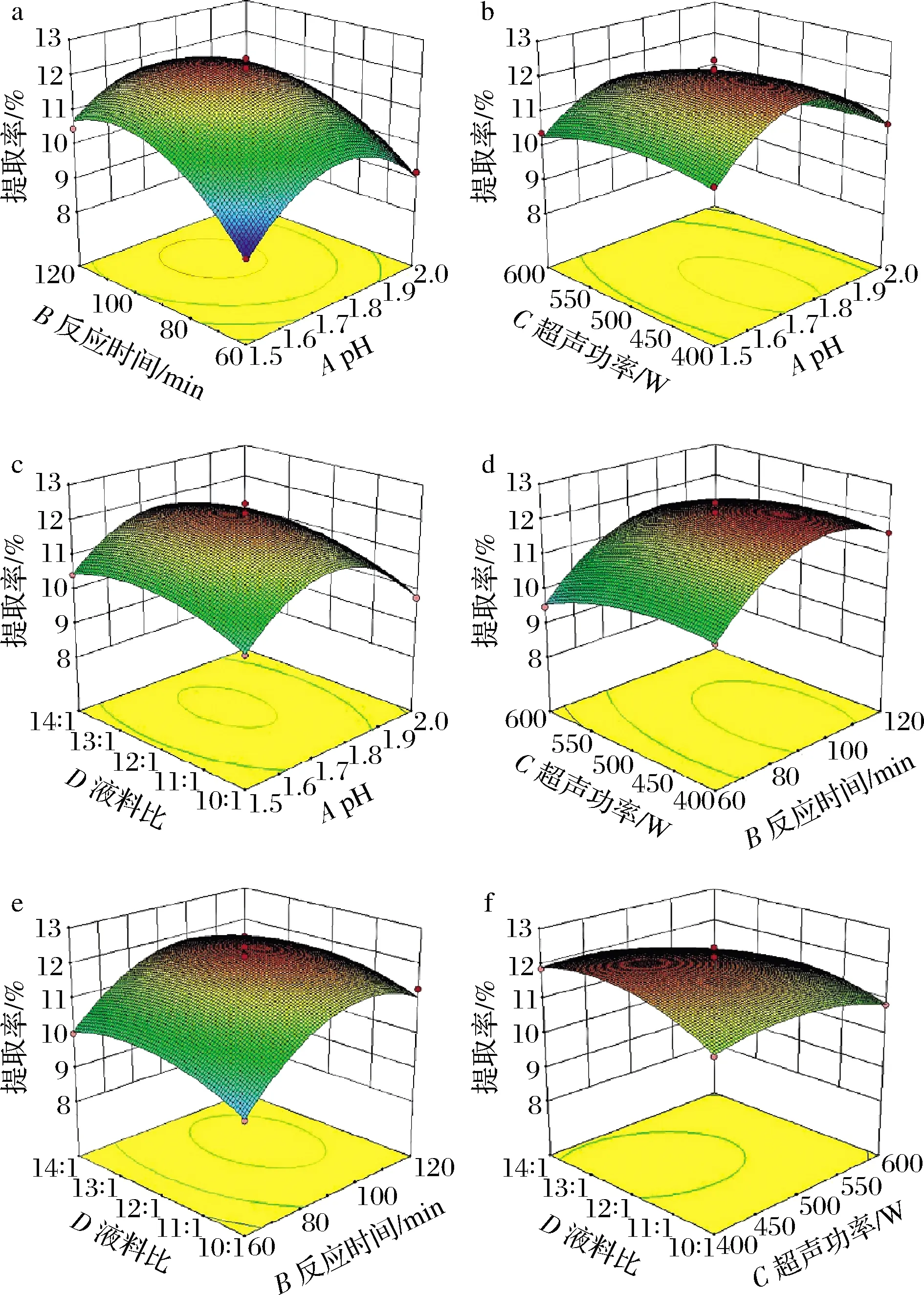
a-pH与反应时间;b-pH与超声功率;c-pH与液料比;d-反应时间与超声功率;e-反应时间与液料比;f-超声功率与液料比
2.3.3 最佳条件的预测及验证实验
通过回归模型的预测得到超声波辅助-酸法提取果胶的最佳工艺为:pH 1.90、反应时间95.87 min、超声功率436.92 W、液料比12.54∶1。此时果胶的理论得率最大为11.71%。由于实验的客观条件和便于操作性,把最优条件修正为:pH 1.9、反应时间95.0 min、超声功率450.0 W、液料比12.5∶1。在此条件下进行3次平行实验进行验证,狐臭柴果胶平均得率为(11.53±0.16)%,与理论预测值(11.71%)误差值仅为1.54%,证实了该模型的有效性。
2.4 叶片果胶纯度与酯化度判断
果胶的主要组成成分为半乳糖醛酸,所以半乳糖醛酸含量可以反映果胶的纯度,经测定,狐臭柴叶片果胶的半乳糖醛酸含量为(70.64±0.06)%,符合GB 25533—2010《食品添加剂果胶》[20]要求(半乳糖醛酸含量>65%)。酯化度为(77.77±0.21)%,为高酯果胶(酯化度>50%)。
2.5 叶片果胶分子质量大小、单糖组成与结构域分析
超声波-酸法提取的叶片果胶的重均分子质量(Mw)为87.90 kDa,数均分子质量(Mn)为56.06 kDa,分子质量分布(Mw/Mn)为1.57。此方法所提取果胶分子质量偏小但分布较为均一,可能是由于在超声波作用下分子片段被随机打断,导致分子质量减小。
从单糖混合标准衍生物以及果胶中性单糖衍生物的选择离子总离子流图(图3)可以看出,各类型果胶中中性单糖衍生物整体均能达到基线分离,且峰型尖锐对称,满足定性定量。

a-9种单糖混标;b-果胶水解物
果胶主要包括4个结构域:同聚半乳糖醛酸(homopolygalacturonic acid,HG),鼠李糖半乳糖醛酸聚糖I型(rhamnose galacturonosan type I,RG-I)、鼠李糖半乳糖醛酸聚糖Ⅱ型(rhamnose galacturonosan type Ⅱ,RG-II)和木糖半乳糖醛酸聚糖(xylose galacturonic glycan,XG)[21]。HG是果胶的主要结构,由线性半乳糖醛酸链组成,也称为果胶主链[22];RG-I与RG-II称为果胶侧链[23]。果胶的单糖组成对其性质和生物活性具有重要影响,侧链的存在往往限制了链间的相互作用,进而影响凝胶形成过程中链间的结合[24-25]。
通过分析果胶的离子流图,狐臭柴果胶中含有鼠李糖、阿拉伯糖、半乳糖、甘露糖、木糖、葡萄糖和果糖,各单糖的摩尔百分含量分别为:12.08%、15.99%、14.82%、12.93%、6.28%、31.29%、6.29%。由单糖组分可以得出,狐臭柴果胶中含有HG、RG-I和RG-II这3种结构,可能还有XG结构。本研究中,超声波辅助酸提法提取的果胶鼠李糖含量较低,可以反映出RG-I与RG-II两种侧链含量较低,这可能是狐臭柴果胶凝胶性能较好的重要原因。
2.6 叶片果胶光谱特征
2.6.1 叶片与标品果胶紫外特征比较
紫外光谱可以快速准确地测定果胶特征,狐臭柴果胶与柑橘标品果胶曲线趋势相似,但狐臭柴果胶在260和280 nm周围有吸收峰,说明狐臭柴粗品果胶中可能含有少量核酸和蛋白质(图4-a)。
2.6.2 叶片果胶官能团分析
红外光谱可以检测化合物官能团组成,可以准确判断化合物的分类。狐臭柴果胶的红外光谱图通过与化学专业数据库中果胶红外光谱图的特征峰比对发现[26],其谱峰位置、谱峰透过率、半峰宽和峰差相似,由此可以认为红外光谱图符合常规果胶光谱特征(图4-b)。

a-紫外光谱图;b-红外光谱图
在4 000~1 330 cm-1特征频率区:3 285 cm-1周围呈现下降的糖类O—H强烈伸缩振动曲线,在O—H伸缩振动频率区会出现多个吸收峰,这些吸收峰往往重叠在一起,形成宽的吸收带;在2 929 cm-1处表现出糖类C—H中等强度的伸缩振动;在1 486~1 318 cm-1出现了几个吸收峰,表现出糖类C—H的变角振动,CH3和CH2变角振动频率位于高频一侧,CH变角振动频率位于低频一侧。在1 330~400 cm-1的指纹区:1 179~1 009 cm-1之间的谱带表现出糖类C—OH和C—O—C的吸收峰,但因为这2个基团在同一区间,所以无法进行明确的归属;1 009~842 cm-1之间出现了几个吸收峰表现出糖类C—O—C的对称伸缩振动。这些吸收峰均属多糖化合物所特有的特征性吸收峰[27],可以判定所提取的为果胶。
2.7 叶片与其他果胶质构比较
狐臭柴鲜叶果胶与食品级果胶、柑橘果胶标准品和狐臭柴干叶果胶的凝胶质构比较发现,狐臭柴果胶所制凝胶的硬度、黏性与咀嚼性高于同样条件下其他几种果胶所制凝胶,有非常好的凝胶、增稠作用,狐臭柴果胶的恢复力低于其他果胶,弹性大小相似(表7)。

表7 果胶的凝胶质构
2.8 叶片果胶与维生素C抗氧化活性能力比较
DPPH是一种比较稳定的自由基,在波长517 nm处有特征吸收峰,常用于评价抗氧化成分的自由基清除能力。DPPH自由基清除剂能提供氢并形成稳定的非自由基分子[28]。研究表明,果胶等多糖类物质具有自由基清除能力,可能是因为其属于氢供体物质,与自由基反应可以生成更稳定的产物并终止自由基链反应[29]。体外抗氧化DPPH法测定果胶和维生素C的抗氧化活性结果表明,狐臭柴中提取的果胶有一定的DPPH自由基清除能力,果胶的线性方程为y=0.001 3x+0.149 9(R2=0.992 2),代入方程得出果胶的EC50值为(269.31±0.26)μg/mL;维生素C的线性方程为y=0.00 19x+0.201 7(R2=0.998 5),代入方程得出维生素C的EC50值为(157±0.14)μg/mL。EC50值越低,该物质清除自由基的能力越强,狐臭柴果胶的EC50是维生素C的两倍左右,具有计量依赖的关系[30]。苹果、柑橘果胶同样具有抗氧化能力[31-32],但经过比较发现,狐臭柴果胶抗氧化能力强于这2种果胶。
3 结论
目前对狐臭柴果胶提取的相关研究非常少,只有本实验室前期对狐臭柴干叶和鲜叶酸提法的工艺进行研究,但没有对狐臭柴果胶的分子结构与理化性质等做评价[33-34]。在本研究中,狐臭柴叶片未经脱水干燥,直接进行果胶提取,所得果胶不仅凝胶、增稠功能强于干叶提取果胶,而且工艺上省去了鲜叶烘干为干叶再磨粉的步骤,操作工艺简化、果胶品质提升,为狐臭柴的资源利用提供了新途径。
在本试验中,首先采用单因素试验,分析考查不同因素对果胶提取率的影响,确定合适的条件范围,再利用Plackett-Burman试验设计结合Box-Behnken响应面法对提取工艺进行优化。结果表明,关键因素为pH、液料比、超声功率、反应时间,利用Design-Expert软件对试验结果进行分析,得出最佳工艺条件:pH 1.90、反应时间95.87 min、超声功率436.92 W、液料比12.54∶1,此时果胶的理论得率最大为11.71%。基于实验的客观条件和便于操作性,把最优条件修正为:pH 1.9、反应时间95.0 min、超声功率450.0 W、液料比12.5∶1,此时果胶提取率11.53%。狐臭柴果胶是一种较为均一的低分子质量果胶,通过对单糖成分分析,狐臭柴果胶中单糖的摩尔百分含量为:12.08%鼠李糖、15.99%阿拉伯糖、14.82%半乳糖、12.93%甘露糖、6.28%木糖、31.29%葡萄糖、6.29%果糖,狐臭柴果胶侧链含量低,凝胶性较好。通过紫外与红外光谱分析,狐臭柴果胶符合果胶特征,可以推断出所测样品为纯度比较高的果胶粗产品。测定提取的果胶的理化性质:半乳糖醛酸含量为70.64%,符合其含量≥65%的要求;酯化度为77.77%,为高酯果胶;凝胶质构结果表明,狐臭柴果胶有很好的凝胶、增稠功能;狐臭柴果胶DPPH清除率EC50为(269.31±0.26)μg/mL,有良好的抗氧化活性。果胶作为胶凝剂、增稠剂和稳定剂,广泛应用于食品医药中[35]。狐臭柴果胶相对食品果胶其胶凝、增稠作用更加优越,非常适合工业开发利用,具有作为功能成分在食品和医药领域进一步发展的潜力。
