湿热处理和混菌发酵对白芸豆面包淀粉消化率的影响
2021-07-21程新黄璟JACOBOjobiOmedi张宾乐郑建仙黄卫宁高铁成李宁FILIPArnaut
程新,黄璟,JACOB Ojobi Omedi,张宾乐,郑建仙,黄卫宁*,高铁成,李宁,FILIP Arnaut
1(食品科学与技术国家重点实验室(江南大学),江苏 无锡,214122) 2(华南理工大学 轻工与食品学院,广东 广州,510641) 3(广州焙乐道食品有限公司,广东 广州,511400)4(焙乐道食品集团,比利时 布鲁塞尔,1201)
白芸豆(PhaseolusvulgarisL.)因其抗性淀粉含量高,血糖指数(glycemic index,GI)低等特点而受到关注。研究者们致力于通过限制淀粉消化率来降低某些食物的GI值。研究表明,湿热处理能显著提高白芸豆抗性淀粉(resistant starch,RS)含量,降低淀粉消化率[1]。LAPPI等[2]发现在酸面团发酵的低pH环境下,淀粉消化率显著降低。
湿热处理(heat moisture treatment,HMT)是一种物理改性技术,包括三个主要条件:1)较低的水分条件(低于35%);2)较高的温度条件(超过90 ℃);3)一定的处理时间(15 min~16 h)[3]。湿热处理可以促进分子间的定向重排,有利于提高RS含量,限制α-淀粉酶对淀粉的可及性,增强淀粉的抗消化特性[4]。现代酸面团发酵技术在降低淀粉消化率方面具有明显优势,乳酸菌和酵母菌混菌发酵是酸面团发酵的一种新形式,邹奇波等[7]研究发现,食窦魏斯氏菌和马克斯克鲁维酵母混菌发酵可改善全麦面包品质。但植物乳杆菌/戊糖片球菌和马克斯克鲁维酵母混菌发酵在白芸豆面包体系中的应用尚未见报道,且湿热处理与混菌发酵的联合效应值得探究。
本研究采用课题组分离自酒曲的植物乳杆菌L1(LactobacillusplantarumLPL-1)/戊糖片球菌J28(PediococcuspentosaceusKID7)和马克斯克鲁维酵母(Kluyveromycesmarxianus,ATCC36534)为研究对象,通过对比湿热处理和混菌发酵的区别,研究两者单独/组合作用对酸面团发酵过程中理化特性及微观结构的影响,评估不同处理对白芸豆酸面团面包淀粉消化率及GI值的影响,以期为工业化开发天然、营养的豆类面包提供理论支持。
1 材料与方法
1.1 材料与试剂
白芸豆粉,陕西斯诺特生物技术有限公司;黄油,中粮东海粮油工业(张家港)有限公司;高筋粉,河北参花面粉有限公司;植物乳杆菌L1(LactobacillusplantarumLPL-1)、戊糖片球菌J28(PediococcuspentosaceusKID7),分离自酒曲;马克斯克鲁维酵母(Kluyveromycesmarxianus)ATCC36534,上海一研生物科技有限公司;α-淀粉酶、淀粉葡萄糖苷酶、胃蛋白酶、GOPOD试剂盒、乳酸标品、乙酸标品,上海甄准生物科技有限公司;MRS肉汤培养基、YPD肉汤培养基,杭州百思生物技术有限公司;异硫氰酸荧光素(FITC)、罗丹明 B,阿拉丁试剂有限公司。
1.2 仪器与设备
超净台(SW-CJ-2F 型),苏州安泰空气技术有限公司;冷冻离心机(1850R 型),湖南湘仪实验室仪器开发有限公司;恒温恒湿培养箱(SPX-150C 型),上海逊博士业有限公司医疗设备厂;全温振荡培养箱(HZL-F160 型),太仓市强乐实验设备有限公司;高效液相色谱仪(2515 型),美国Waters 公司;pH计(FE-20 型),梅特勒-托利多国际贸易(上海)有限公司;紫外分光光度计(TU-1810 型),北京普析通用仪器有限责任公司;激光共聚焦显微镜(LSM710 型),德国蔡司公司。
1.3 实验方法
1.3.1 白芸豆粉的湿热处理
准确称取100 g白芸豆粉(SY),调至30%水分含量,混合均匀后装入容器,密封后置于室温下平衡24 h。待平衡结束,移入120 ℃烘箱中加热2 h,再移入40 ℃烘箱中干燥12 h,最后碾磨过筛(100目),制得湿热处理后的熟白芸豆粉(HY),并密封于4 ℃保存[3]。
1.3.2 白芸豆混菌发酵酸面团的制备
将植物乳杆菌L1和戊糖片球菌J28分别接至MRS液体培养基,活化2代后,分别与马克斯克鲁维酵母KM按培养基体积比为1∶1进行离心(6 000 r/min,5 min),离心后与白芸豆粉混合均匀(酸面团初始接种量达到107CFU/g,DY 250),制成4种酸面团:植物乳杆菌L1与马克斯克鲁维酵母KM混菌发酵生白芸豆酸面团(SY-LK)、戊糖片球菌J28混菌发酵生白芸豆酸面团(SY-JK)及湿热-混菌发酵熟白芸豆酸面团(HY-LK,HY-JK),置于30 ℃培养箱中培养24 h。
1.3.3 酸面团发酵过程中pH及有机酸测定
参照杨文丹等[8]方法测定白芸豆酸面团发酵前后的pH。
根据王益姝等[9]方法利用HPLC测定有机酸。每个样品重复3次,并根据乳酸和乙酸含量计算发酵熵(FQ):发酵熵=乳酸含量/乙酸含量。
1.3.4 酸面团发酵过程中游离总酚含量变化
采用马子琳等[10]的方法提取酸面团发酵过程的游离总酚。再用福林酚法[11],测定游离总酚含量。
1.3.5 白芸豆酸面团面包面团微观结构变化
激光共聚焦显微镜参考庄靓等[12]的方法,对不含酵母的面包面团(制作配方见表1)微观结构进行观察。首先,将样品用刀片切成5 mm×5 mm×5 mm小块,并用包埋剂包埋,立即放-80 ℃冰箱中冷冻1 h。用冷冻切片机将样品切成20 μm薄片,然后用罗丹明 B(1.3×10-5g/mL)和FITC(3.5×10-4g/mL)的混合染料对切片进行染色1 min,去离子水冲洗后盖上盖玻片,置于激光共聚焦显微镜下观察,放大倍数200×。
1.3.6 白芸豆酸面团面包的制作
普通小麦面包(记作XMB)、对照生芸豆面包(记作SYB)、湿热处理白芸豆面包(记作HYB)、植物乳杆菌L1、戊糖片球菌J28分别与马克斯克鲁维酵母KM混菌发酵生白芸豆酸面团面包(记作SY-LKB,SY-JKB)和湿热-混菌发酵白芸豆酸面团面包(记作HY-LKB,HY-JKB)的制作配方见表1,制作工艺参考邹奇波等[7]方法。

表1 不同类型面包的配方
1.3.7 白芸豆酸面团面包对α-淀粉酶的抑制作用测定
参考吴小霞[13]对α-淀粉酶抑制能力的测定方法,并做修改。将40 mL可溶性淀粉溶液置于37 ℃水浴锅中预热5 min,再加入1 g不同处理的白芸豆酸面团面包和2 mL(500 U/mL)α-淀粉酶溶液,振荡水浴反应30 min后取消化液4 mL,沸水浴10 min。灭酶结束后,离心取上清液,用DNS法测定还原糖含量。同时将2 mL α-淀粉酶溶液和40 mL可溶性淀粉溶液作为阳性对照,1 g白芸豆酸面团面包和40 mL可溶性淀粉溶液作为阴性对照。不同酸面团面包对α-淀粉酶的抑制能力按公式(1)计算:
(1)
式中:m,阳性对照组还原糖质量,mg;m1,样品组还原糖质量,mg;m2,阴性对照组还原糖质量,mg。
1.3.8 白芸豆酸面团面包淀粉体外消化率测定
采用CHINEDUM等[14]的方法测定白芸豆面包总淀粉(total starch,TS)含量及淀粉体外消化率,并做适当修改。面包冻干样品经过胃蛋白酶、α-淀粉酶以及淀粉葡萄糖苷酶处理后,离心收集上清液,最后使用GOPOD试剂盒测定,得到消化至20 min(G20)和120 min(G120)的葡萄糖含量及游离葡萄糖含量(free glucose,FG)。快速消化淀粉(rapidly digestible starch,RDS)、缓慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)的计算公式(2)、(3)、(4)如下:
(2)
(3)
(4)
淀粉体外消化率TS以不同时间(0、30、60、90、120和180 min)淀粉水解率表示。不同时间淀粉水解率按公式(5)计算:

(5)
1.3.9 白芸豆酸面团面包的血糖指数(GI)
利用 GONI 等[15]建立的非线性模型计算酸面团面包淀粉体外消化动力学。方程如公式(6)所示:
C=C∞(1-e-kt)
(6)
式中:C为时间t(min)淀粉水解百分率,C∞为淀粉水解180 min 后平衡百分率,k是动力学常数。根据淀粉体外消化获得的数据,估算不同组别的参数C∞和k。
淀粉水解指数(Hydrolysis Index,HI),血糖反应的预测指标,其计算方法是将实验组的水解曲线下面积(AUC)除以小麦面包的AUC,血糖指数(GI)参照 FERRER 等如公式(7)所示[16]:
GI=0.862×HI+8.198
(7)
1.4 数据分析
采用Excel、SPSS、Origin 8.5来进行数据分析、绘图,数据、图表中均采用字母上标来表示显著性分析结果,字母不同表示具有显著性差异(P<0.05)。
2 结果与分析
2.1 白芸豆酸面团发酵过程中的酸化特性
混菌发酵后SY-LK、SY-JK组pH值分别下降到4.22、4.35,HY-LK、HY-JK组pH值略高,分别为4.56、4.68。表明无论豆粉是否经过处理,相比于JK混菌发酵,LK混菌发酵具有更强的酸化作用。这与菌株的发酵类型有关,植物乳杆菌L1为兼性异型发酵乳杆菌,而戊糖片球菌J28为同型发酵。MICHAEL 等[17]发现植物乳杆菌发酵面包组酸度评分显著高于其余发酵类型乳酸菌。
混菌发酵后SY-LK组乳酸含量最高,为14.03 mg/g酸面团,这与pH测定结果一致。SY-LK组中低pH环境激活更多内源性酶,还可能由于马克斯克鲁维酵母代谢产生的氨基酸等营养物质促进植物乳杆菌L1生长,产生更多乳酸[18]。在淀粉糊化过程中乳酸可以促进淀粉和蛋白相互作用,降低淀粉消化率[19]。湿热处理后,乳酸没有显著性变化,但乙酸含量显著增加。原因在于湿热处理后,最终发酵pH接近马克斯克鲁维酵母生长的适宜pH值,酵母代谢增强,产生更多乙酸,而乙酸可以延长胃排空速度,降低淀粉消化率[20]。

表2 白芸豆酸面团发酵前后的pH及有机酸
2.2 湿热处理和混菌发酵对总酚含量的影响
4种白芸豆酸面团总酚含量的排序为:发酵(SY-LK>SY-JK)>湿热-发酵(HY-LK>HY-JK)>湿热处理(图1)。经过HMT后总酚含量降低约20%,是因为在HMT过程中芳香族环结构发生分解,导致酚类物质发生降解[21]。混菌发酵后总酚含量增加约1.61~1.97倍,其中HY-LK组增幅最高,达到21.94 mg/g。酸化可以提高β-葡萄糖苷酶活性,而β-葡萄糖苷酶可以水解酚类化合物,甚至酚类与纤维或有机酸之间的糖苷键,有助于将多酚从束缚型或结合型的共轭酚类中释放出来,有效改善总酚的提取[22]。本研究中SY-LK酸面团组总酚含量最高,为23.57 mg/g。同时酵母菌代谢消耗氧气,降低氧化酶氧化酚类物质的能力[23],所以混菌发酵后总酚含量提高。而湿热-混菌发酵的总酚含量居中,可能是两者作用相互抵消的结果,且发酵作用大于湿热作用。

图1 湿热处理和混菌发酵对白芸豆酸面团总酚含量的影响
2.3 湿热处理和混菌发酵对面包面团微观结构的影响
由于白芸豆粉的加入稀释了面筋蛋白,限制了面筋网络的形成,所以对照组中面筋网络结构稀疏,出现明显断裂,许多淀粉颗粒暴露甚至溶出(图2-a)。经过HMT或混菌发酵作用后,面包面团的面筋网络结构更加紧密连续,暴露或溶出的淀粉颗粒较少(图2-b、c和e)。原因在于HMT使芸豆蛋白发生变性,所以蛋白对小麦面筋的稀释作用减弱,面筋网络结构破坏变小。此外,淀粉外部的压力和加热会导致相对松散的颗粒变成致密的颗粒,这些致密淀粉颗粒不易溶出,降低了α-淀粉酶与底物之间的可及性[4],进而降低淀粉消化率。而混菌发酵产生的大量乳酸可以通过在面筋和淀粉之间产生相互作用来降低淀粉消化速率[19]。相比于两者单独作用,共同作用后观察到更加稠密的面筋网络,黄色区域明显变多,且几乎没有淀粉颗粒溶出(图2-d、f),表明两者联合效应使得蛋白和淀粉结合更紧密,增强了对α-淀粉酶的抗性。
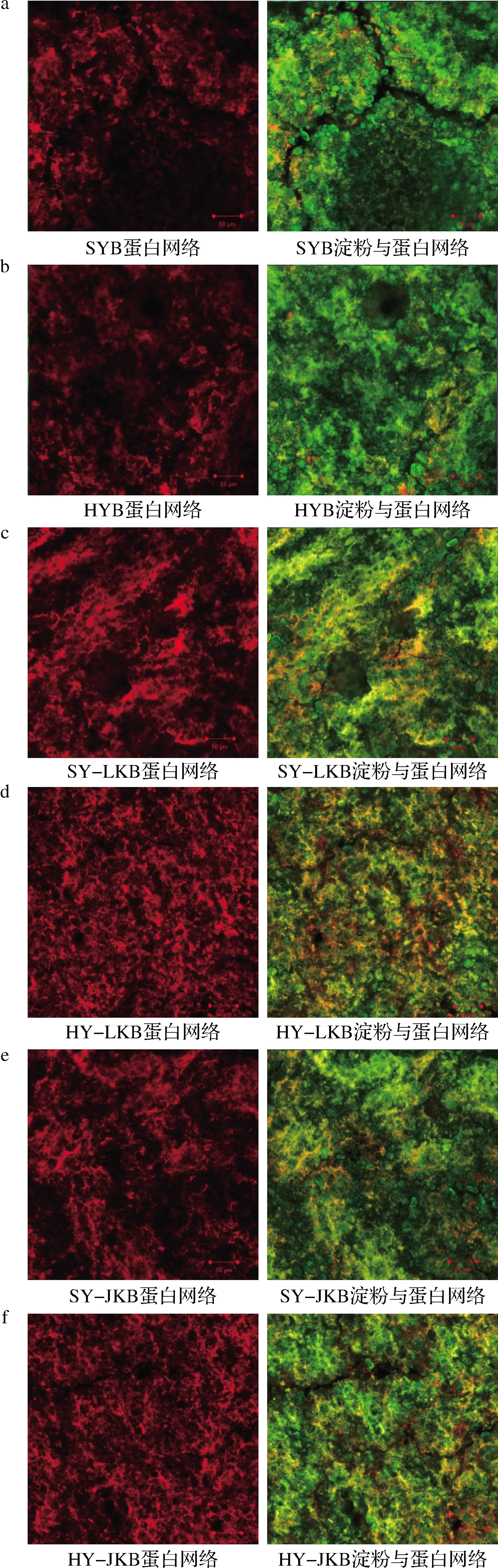
a-SYB 蛋白网络和SYB 淀粉与蛋白网络;b-HYB 蛋白网络和HYB 淀粉与蛋白网络;c-SY-LKB 蛋白网络和SY-LKB 淀粉与蛋白网络;d-HY-LKB 蛋白网络和HY-LKB 淀粉与蛋白网络;e-SY-JKB 蛋白网络和SY-JKB 淀粉与蛋白网络;f-HY-JKB 蛋白网络和HY-JKB 淀粉与蛋白网络
2.4 α-淀粉酶酶活的抑制作用
α-淀粉酶是淀粉消化吸收过程中重要的水解酶,抑制其活性可以减缓淀粉水解,降低餐后血糖水平[24]。如图3所示,HMT和混菌发酵单独或组合作用产生的还原糖含量均显著低于对照组,说明两者作用都能抑制α-淀粉酶活性,通过公式计算其对α-淀粉酶的抑制能力。结果表明两者对α-淀粉酶的抑制能力无显著差异,但组合作用时抑制能力显著大于单独作用,其中湿热-混菌发酵HY-LKB组抑制率最高,为64.11%。这一结果表明HMT和混菌发酵作用可能是通过对α-淀粉酶的抑制作用来降低面包的淀粉消化率和GI值。
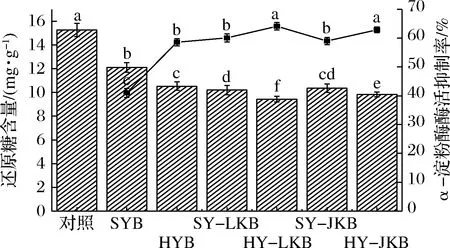
图3 湿热处理和混菌发酵对α-淀粉酶的抑制作用
2.5 白芸豆酸面团面包淀粉体外消化率
RS在小肠中不能被消化,对α-淀粉酶具有抗性,从而影响餐后血糖峰值和整体血糖反应[25]。SYB组RS含量为16.51%,经过湿热处理后的HYB组RS含量达到19.54%;混菌发酵后SY-LKB组RS含量高达21.55%;湿热-发酵组合作用的HY-LKB组RS含量最高,为23.40%。结果表明,湿热处理或混菌发酵都能显著提高RS含量,且两者组合作用更佳。可能是因为2种作用都能改变白芸豆淀粉结构,湿热处理的高温使大量支链淀粉分子链断裂,形成短直链淀粉,这部分淀粉与原豆粉中直链淀粉在降温过程中通过氢键连接形成RS[6]。混菌发酵代谢产生的乳酸可影响淀粉结晶区的比列,同样导致大分子支链淀粉的断裂和脱支,直链淀粉含量升高,进一步形成RS[1]。
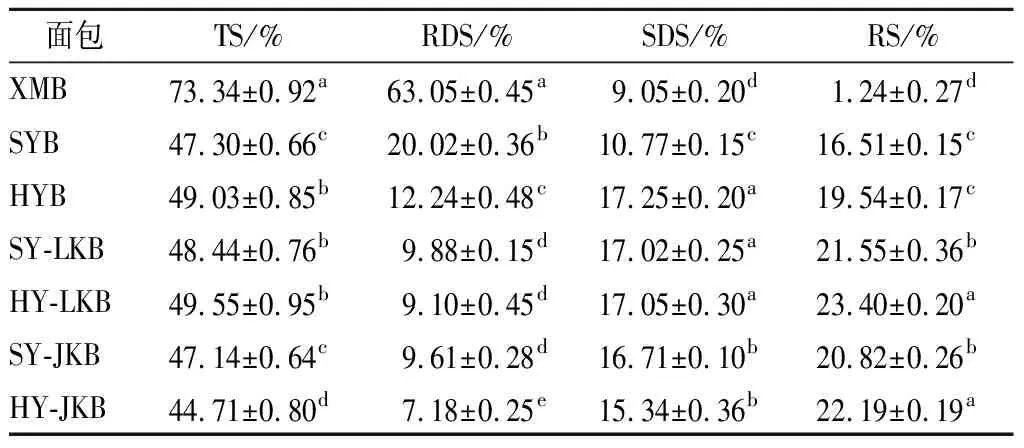
表3 白芸豆面包中RDS、SDS和RS
由图4曲线发现第1部分从0到60 min,消化速率快速增加,第2部分从60到180 min,缓慢达到最大平稳水平。结果表明,白芸豆面包淀粉体外消化率显著低于小麦面包,HMT和混菌发酵在不同程度上都会降低淀粉消化率,其中混菌发酵的2组SY-LKB、SY-JKB低于HYB组。表明相比于湿热处理,混菌发酵更有利于降低淀粉消化率。而湿热-混菌发酵组合作用优于两者单独作用,所以HY-LKB组的淀粉消化率最低,HY-JKB组次之,这与湿热-混菌发酵酸面团中高含量的总酚及RS有关。

图4 湿热处理和混菌发酵对白芸豆面包淀粉体外消化率的影响
2.6 湿热处理和混菌发酵对血糖指数(GI)的影响
由表4可知,相比于生芸豆面包组,HMT和混菌发酵单独作用组HI值降低了22%~28%,与RS、α-淀粉酶抑制率测定结果相一致,RS对α-淀粉酶具有一定的抗性[3]。
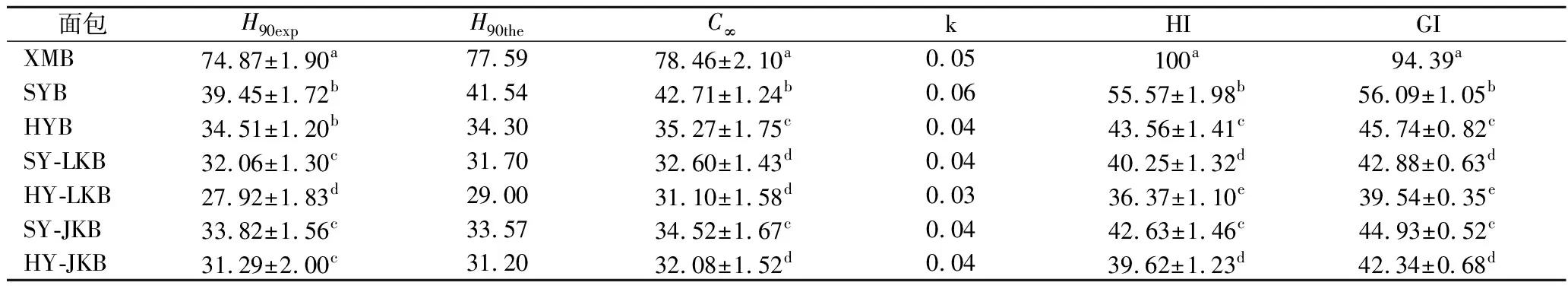
表4 白芸豆面包水解90 min的水解率(H90),180 min平衡浓度(C∞),动力学参数(k),水解指数(HI)以及血糖指数(GI)
且两者组合作用后HI值进一步降低,由HI计算得到的GI值有同样的结果。此外,SY-LKB组HI和GI值显著低于SY-JKB,这与LK组酸化作用强于JK组结果相符。乳酸是淀粉糊化过程中降低淀粉生物利用度的先决条件,在焙烤过程中乳酸促进了淀粉和面筋相互作用,增强了α-淀粉酶的抗消化性,有利于降低淀粉消化率[19]。HY-LKB与HY-JKB组RS含量相似,但HI,GI值表现出显著差异,这与HY-LKB组中更高含量的乳酸和酚类物质有关。酚类物质是α-淀粉酶的温和抑制剂,可与α-淀粉酶分子上的亲核基团共价结合形成醌或内酯[22],抗酶性增强,从而降低淀粉消化率和GI值。不同处理后的白芸豆面包GI值范围为39.54~45.74,显著低于生芸豆面包。
3 结论
研究表明,湿热-混菌发酵组合作用可以抑制α-淀粉酶,显著降低白芸豆面包淀粉消化率和GI值,且优于两者单独作用。HMT改变了白芸豆淀粉链结构,显著提高RS含量。混菌发酵产生乳酸的同时,不仅抵消了HMT对酚类物质的破坏,还提高了RS含量,湿热-混菌发酵HY-LKB组RS含量最高(23.40%)。微观结构表明:HMT和混菌发酵都强化了面包面团的面筋网络结构,同时HMT减少了淀粉颗粒的溶出,且两者组合作用时面团中淀粉和蛋白结合最紧密。乳酸、总酚和RS含量的增加都有利于抑制α-淀粉酶活性,进一步降低面包的淀粉消化率和GI值。所以本研究中HY-LKB组α-淀粉酶酶活抑制率最高,为64.11%,而HI和GI值最低,分别为36.37%,39.54。但由于未采用体内消化法测定白芸豆面包淀粉消化率,测定的体外淀粉消化率只能作为参考数据,后续需要进一步深入探究。
