益生菌粉中活菌稳定性及其耐受模拟胃肠液的研究
2021-07-21张林奇王晓蕊史畅彭禹熙杜丽平
张林奇,王晓蕊,史畅,彭禹熙,杜丽平
(天津科技大学 生物工程学院,工业微生物教育部重点实验室,天津市工业微生物重点实验室,天津,300457)
益生菌(probiotics)是指能定植于人体肠道的活性微生物,当其达到一定数量时有益于宿主健康[1]。同时,益生菌具有改善肠道菌群结构、增强免疫系统、降低胆固醇和血压、降低氧化应激和餐后血糖等多种功效[2-3]。市场上存在许多种类的益生菌产品,其中益生菌粉(固体饮料类)是其主要产品形式之一[4],这些产品中所含微生物数量和种类都不同。蒋卉[5]认为进入肠道的益生活菌数达到1×107~1×1010CFU/g(mL)可确保益生菌对原有肠道微生态系统产生影响,《益生菌类保健食品申报与评定(征求意见稿)》及GB 7101—2015《食品安全标准 饮料》规定标识活菌型的产品乳酸菌数应≥1×106CFU/mL(g)。CURTO等[6]以水和牛奶作为食品载体,评估了3种商业乳杆菌不同生长期在模拟胃肠道中的存活率,结果表明,乳杆菌在稳定期存活率较高。常柳依等[7]通过采用海洋寡糖、藻酸盐-山羊奶-菊粉基质对双歧杆菌进行包裹,提高益生菌在模拟胃肠道环境下的存活率。RODRIGUES等[8]比较了乳制品和膳食补充剂中嗜酸乳杆菌和双歧杆菌在模拟胃肠消化过程中的影响,乳制品基质比膳食补充剂更能有效地维持益生菌的生存能力。BORICHA等[9]对不同来源的益生菌菌株进行益生特性评估,筛选出在模拟胃肠道条件下具有抵抗力或生存能力的菌株。MICHELUTTI等[10]建立了利用流式细胞技术(flow cytometry,FCM)对食品补充剂中的益生菌分析方法。而GB 4789.35—2016《食品安全国家标准 食品微生物检验 乳酸菌检验》规定采用平板计数法来分析食品中益生菌的存活状况。
目前,食品或药物的体外模拟消化在国内外的应用已经相当普遍[11-13],但关于益生菌粉中益生菌的菌体活性及其在胃肠消化液中的耐受能力的研究相对较少。本研究以6个不同品牌的益生菌粉产品为研究对象,并比较了6个产品在模拟胃肠道中的耐受性,旨在了解当前益生菌产品的品质水平,为益生菌产品品质分析提供参考,并为进一步制定相关标准提供依据。
1 材料与方法
1.1 材料与试剂
实验材料为6个不同品牌的益生菌粉,所有产品均于网上购买,具体信息见表1。
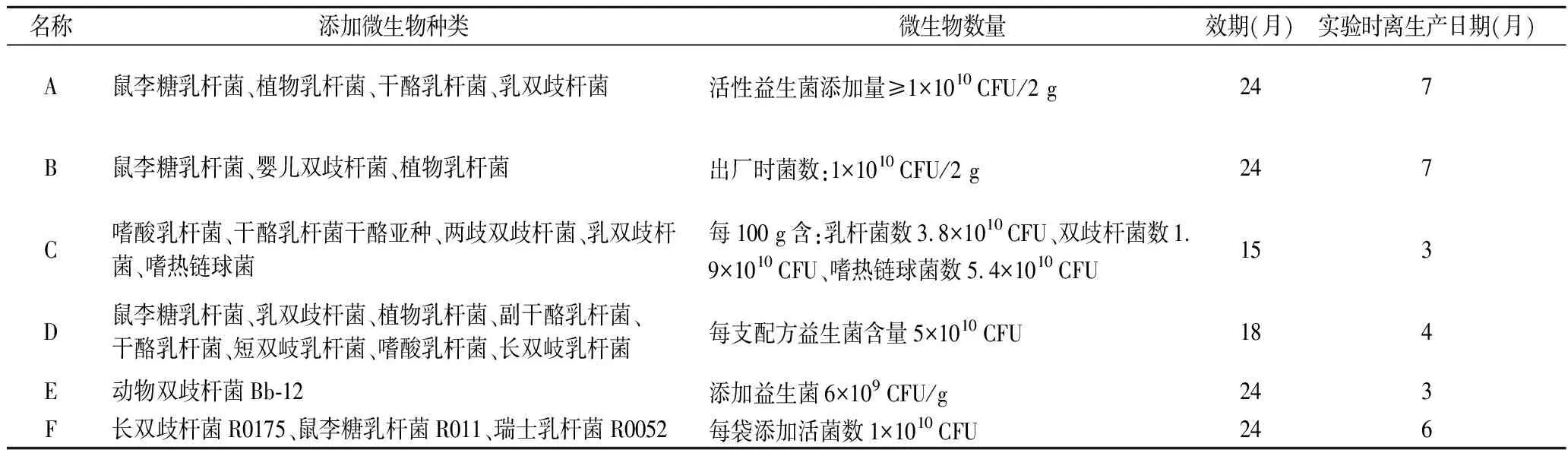
表1 产品信息
胃蛋白酶、胰蛋白酶、猪胆盐,上海源叶生物科技有限公司;MRS琼脂培养基、MC培养基,北京路桥技术有限责任公司;2.5 L圆底立式厌氧培养袋、2.5 L厌氧产气包,青岛海博生物技术有限公司;Funga-LightTMYeast CFDA,AM/Propidium Iodide Vitality Kit,美国赛默飞世尔科技有限公司。
1.2 仪器与设备
FA2004电子天平,上海精密科学仪器有限公司;LDZM型立式压力蒸汽灭菌器,上海申安医疗器械厂;恒温培养振荡器,上海智城分析仪器制造有限公司;pHS-3C精密pH计,梅特勒-托利多仪器有限公司;ZHJH-C1115B型超净工作台、2XJD-A1270型电热恒温培养箱,郑州南北仪器设备有限公司;BD Accuri C6 流式细胞仪,美国BD公司。
1.3 实验方法
1.3.1 活菌计数
活菌计数依据 GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》中乳杆菌和嗜热链球菌计数方法,略作修改。称取待检样1.0 g,置于装有9.0 mL无菌生理盐水的试管内,充分振摇,然后做10倍系列稀释,选取2~3个适宜稀释梯度,吸取100 μL于无菌平板内,每个稀释度做3个平皿,将冷却至48 ℃的MRS培养基或MC培养基倾注入平皿约15 mL,转动平皿使混合均匀。待平板凝固后,倒置于厌氧袋内,(36±1)℃厌氧培养(72±2)h后,进行第1次活菌计数实验。之后将产品放置于20 ℃的温度下进行储藏实验,3个月后取样进行第2次活菌计数实验。
1.3.2 FCM分析
利用多功能细胞仪通过FCM测定产品中微生物的代谢活性[14]。称取待检样0.5 g,于无菌磷酸盐缓冲盐水(PBS,pH 7.4)中稀释1 000倍,将微生物密度调节至107CFU/mL左右,6 000 r/min条件下离心2 min,去除上清液,用PBS缓冲液将微生物洗涤2次,10 000 r/min条件下离心1 min,取沉淀于200 μL结合缓冲液中,加入5 μL 5-羧基荧光素二乙酸酯(5-carboxyfluorescein diacetate,CFDA)和5 μL的碘化丙啶(propidium iodide,PI)染料,混匀,避光室温反应15 min,再加入结合缓冲液500 μL。未染色的产品为阴性对照,每个产品分别进行CFDA与PI单染做单阳性对照,流式细胞仪上样进行分析[8]。检测器波长为530 nm,收集羧基荧光素的绿色荧光(FL1通道),波长为670 nm收集碘化丙啶的红色荧光(FL3通道)。通过FlowJo V10软件分析细胞数据。
1.3.3 体外模拟消化
1.3.3.1 消化液的配制
体外模拟胃液:将0.1 mol/L磷酸钾缓冲液的pH值分别调为0.9、1.5、2.5、3.5、4.5,灭菌后再加入胃蛋白酶(10 g/L),混合使其充分溶解,得到模拟胃液。使用前进行37 ℃预热。
体外模拟肠液:将磷酸钾缓冲液pH调至6.8后灭菌,加入胰蛋白酶(10 g/L),猪胆盐(3 g/L),混合使其充分溶解,得到模拟肠液。使用前进行37 ℃预热。
1.3.3.2 模拟胃消化
分别称取1.0 g产品至20.0 mL模拟胃液中,37 ℃、90 r/min厌氧条件下模拟胃消化过程,于0、0.5、1.0、2.0、3.0 h时取样,采用平板计数法测定活菌数,并计算存活率[17],如公式(1)所示:

(1)
式中:Ni,消化ih后的活菌数;N0,初始活菌数。
1.3.3.3 模拟肠消化
分别称取1.0 g产品至80.0 mL模拟肠液中,37 ℃、120 r/min厌氧条件下模拟肠消化过程,于0、1、2、3 h时取样,进行活菌平板计数,并按公式(1)计算存活率。
1.3.3.4 模拟胃肠消化
分别称取1.0 g产品于20.0 mL模拟胃液(pH 3.5)中,放入37 ℃ 90 r/min水浴锅振荡消化2 h,然后加入80.0 mL模拟肠液,在37 ℃ 120 r/min水浴锅中继续振荡消化2 h,在厌氧条件下模拟胃肠消化过程。采用平板计数法测定活菌数,同时做平行实验,并按公式(1)计算存活率。
1.4 数据分析
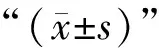
2 结果与分析
2.1 活菌数变化
如表2所示,不同益生菌粉的活菌数差异较大,产品E的活菌数最多,为10.19 lg CFU/g,而产品A、B的活菌数相对较低,仅有6.91、6.47 lg CFU/g。所有产品含活菌数都达到1×106CFU/g以上,均可达到国标要求的活菌数量,但与标识数存在差异。产品C、E活菌数量均高于标识活菌数,产品F、D活菌数略低于标识活菌数。然而,产品A、B实际活菌数却远低于标识中活菌数且与标识活菌数相差3个数量级,这可能与益生菌粉储藏过程活菌数变化有关[18]。存放3个月后发现产品F下降明显,其他产品中活菌数无明显变化,较好地维持着产品的稳定性。
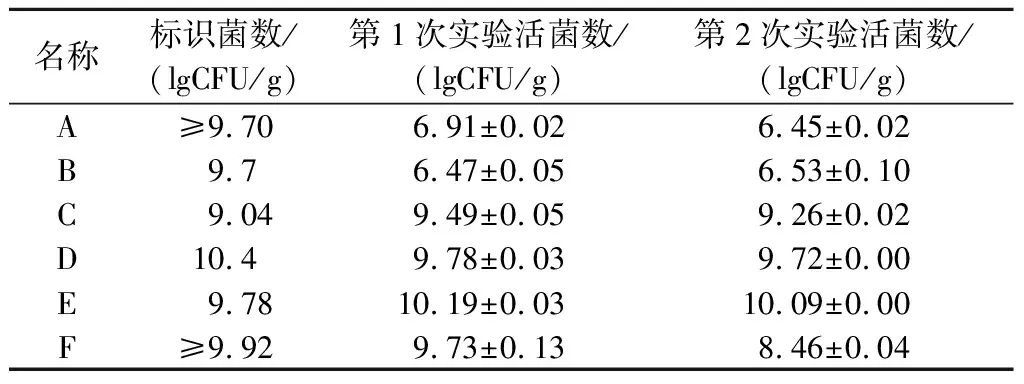
表2 产品中的活菌数
2.2 FCM分析
MICHELUTTI等[10]认为只有微生物活细胞种群才能在平板上增殖和产生菌落,受损伤的菌体可能仍具有某些代谢活性,但可能不再可培养。故采用CFDA/PI双标记结合FCM进一步证实了产品中微生物的存活情况,不同益生菌粉的FCM分析结果如图1所示。

图1 流式细胞分析图
正常活菌、早期受损菌体、晚期受损菌体和坏死菌体分别分布在流式细胞分析图的Q4、Q3、Q2、Q1[19],6个产品均存在不同程度的衰亡。如图2所示,各产品活菌比例有明显的差异,活菌比例由高到低:E>C>D>F>B>A。产品B、C中的损伤细胞较多,虽然在平板计数中产品A、B的活菌数均较低,但由FCM分析结果可以看出A产品死亡菌体数较多,B产品中损伤细胞较多。
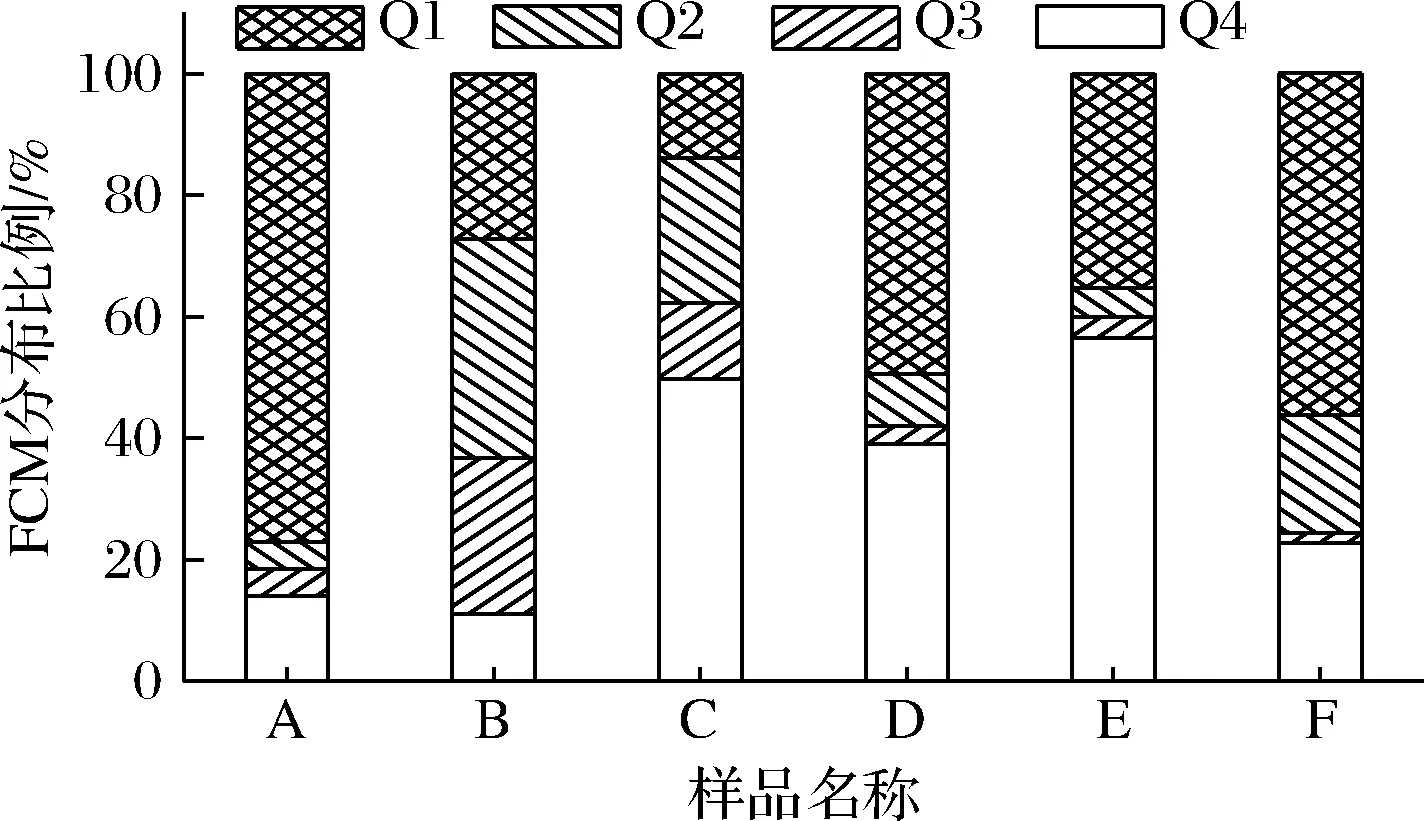
图2 产品中益生菌细胞的存活状况
WILKINSON等[20]报道,采用平板计数与FCM计数对细胞数在104~107CFU/g的益生菌进行比较,发现两者具有较高的相关性。流式细胞技术在微生物生物活性分析方面具有操作方便,适合大量样品的筛选,在基础研究方面具有较大的优势,平板计数操作简单和经济实惠,更有利于工业化生产需求。
2.3 模拟消化环境中的耐受性
2.3.1 益生菌对模拟胃液的耐受性
益生菌在消化道中定植,首先要耐受胃液中的低pH环境,还需经受胃液中的胃蛋白酶等的考验。人体胃液pH值会随饮食波动,胃液空腹或食用酸性食品时pH值可达1.5,饭后pH值为3.0左右,食用碱性食物pH值可达5.0,同时食物过胃的时间一般为1~2 h[21]。由图3可知,6个产品在pH为4.5、3.5、2.5的模拟胃液中菌体存活较为稳定,产品A、B、C、D、E、F产品活菌数分别为6.10~6.47、5.87~6.02、7.85~9.00、9.57~10.69、9.60~10.01、8.31~9.41 lg CFU/g。
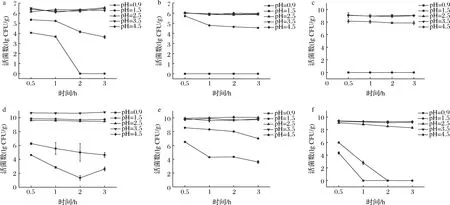
图3 产品中益生菌对模拟胃液的耐受性
6个产品对pH为1.5模拟胃液环境的耐受能力较差,产品C不耐受此条件,产品F活菌数大幅度下降,2 h后无活菌存在。产品A、B、D、E随着消化时间的延长活菌数逐渐降低,3 h后活菌数分别降至4.55、3.64、4.64、7.01 lg CFU/g。在pH为0.9的模拟胃液中活菌数明显减少,3 h后产品A、B、C、F无活菌存在。产品E的活菌数保留最多,0.5 h后活菌数为6.51 lg CFU/g,消化3 h后活菌数仍有3.60 lg CFU/g,益生菌对胃液的耐受性差异较大。
6种产品在不同pH的胃液中消化2 h后的存活率如图4所示。模拟胃液pH为4.5时产品存活率在89.98%~99.03%,pH 3.5时为91.08%~108.83%,pH 2.5时为82.80%~99.15%,所有产品的存活率均高于80%,均保持在较高水平。pH为3.5时产品D中的益生菌能够良好存活甚至缓慢生长,可能由某些菌的耐酸能力、益生元的添加以及菌株之间的协同效应等原因造成的[22]。pH为1.5时产品E存活率最高,为78.72%,而产品C、F存活率均为0%。在消化过程中大部分微生物的存活率会有所降低,这是建议持续食用益生菌来促进健康的原因之一[23]。
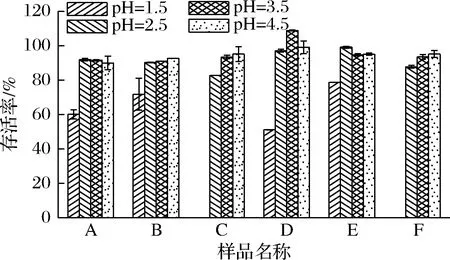
图4 益生菌在不同pH模拟胃液中消化2 h后的存活率
2.3.2 益生菌对模拟肠液的耐受性
益生菌到达肠道后能否生存,很大程度上取决于其对胆盐及胰蛋白酶等的耐受能力[24]。由表3可知,不同品牌产品在模拟肠液中消化1 h后,益生菌存活率均显著下降(P<0.05)。消化2 h后6个产品的存活率无显著性差异,这可能是产品中的益生元在消化过程中对益生菌具有保护作用,提高了其稳定性[25]。消化3 h后,产品A、D、E对模拟肠液表现出良好的耐受能力,存活率分别为95.41%、97.42%和91.72%。产品F存活率最低,为53.18%,说明F不能很好的抵抗肠道内的高胆盐渗透压作用。
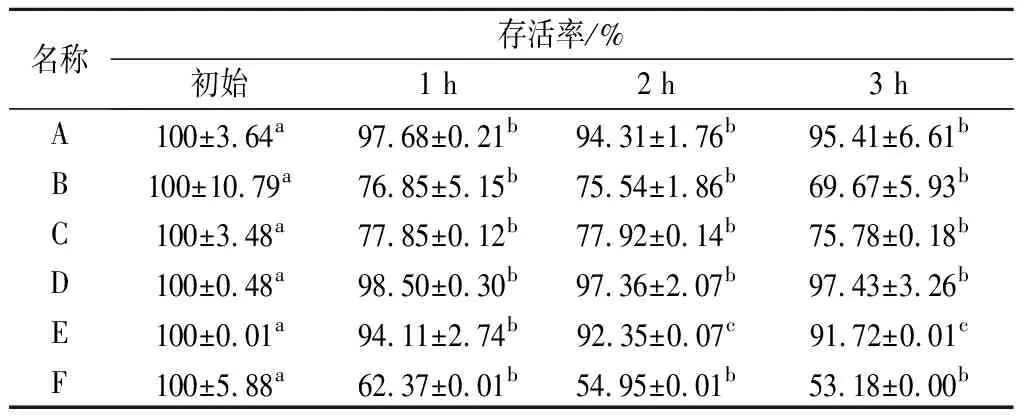
表3 产品中益生菌对模拟肠液的耐受性
2.3.3 益生菌对模拟胃肠液的耐受性
6个产品经过模拟胃肠道的存活情况如图5所示。产品D存活率最高,达到98.39%,具有最佳的适应性;产品E次之,为94.82%;产品F最低,为60.93%。在酸性胃液和肠道高胆盐渗透压作用下,产品F中的活菌数显著下降,从109CFU/g下降至105CFU/g,不能够很好地抵抗消化道环境来实现肠道定殖,这会影响其发挥益生作用。产品B、C在模拟肠液中消化2 h后的存活率分别为75.54%和77.92%,通过模拟胃肠液后的存活率分别为89.60%和91.59%,通过条件更为苛刻的模拟胃肠液,两者的存活率不降反增,说明益生菌在受到胃肠液的损伤后,在一定时间内仍能恢复其活性[26]。

图5 产品中益生菌对模拟胃肠液的耐受性
3 结论
本研究对6个不同益生菌粉样品中的活菌进行分析并对其在胃肠道的耐受性进行综合评价。6个产品中的活菌数量都达到国标要求,但与标识数存在差异。6个产品中的益生菌在pH值为4.5、3.5、2.5的模拟胃液环境中耐受能力较好,在pH<1.5的模拟胃液中,存活率明显降低。模拟肠消化道体系明显抑制了微生物细胞的活性,益生菌的活性表现差异较大,产品A、D、E经过肠液消化后存活率高。但有一些微生物细胞在肠道中能够适应并恢复其活性。不同品牌益生菌粉产品在消化过程中的耐受力不同,经过模拟胃肠液消化后,产品D存活率最高,达到98.39%,具有最佳的适应性;产品F的存活率最低,为60.93%。在实际情况下,人体消化系统更加复杂,益生菌活菌进入肠道面对的挑战更高,提高益生菌在消化过程中的耐受力是益生菌粉开发的技术需求。对不同益生菌粉品质特性进行分析,可对市场上产品质量进行了解,对为进一步制定相关标准提供依据。
