南极夏季宇航员海浮游动物群落结构及其与环境因子的关系*
2021-07-21牟文秀徐志强李超伦
牟文秀 杨 光 郝 锵 徐志强 李超伦, 4
南极夏季宇航员海浮游动物群落结构及其与环境因子的关系*
牟文秀1, 2, 3杨 光1, 2, 4郝 锵5徐志强1李超伦1, 2, 3, 4①
(1. 中国科学院海洋研究所 青岛 266071; 2. 青岛海洋科学与技术试点国家实验室 青岛 266237; 3. 中国科学院大学 北京 100049; 4. 中国科学院海洋大科学研究中心 青岛 266071; 5. 自然资源部第二海洋研究所 杭州 310012)
基于中国第36次南极科学考察期间(2019年12月至2020年1月)于南极宇航员海使用北太平洋网(0.5 m2, 330 μm)采集的浮游动物样品, 对浮游动物的丰度、群落结构、优势种种群结构及其与环境因子之间的关系进行了研究。结果表明: 2019/2020年南极夏季宇航员海浮游动物总丰度在8.93—102.00 ind./m3之间, 最高丰度记录在宇航员海中部靠北区域, 浮游动物主要由桡足类、磷虾、毛颚类、浮游被囊类等类群组成。调查海域桡足类丰度对浮游动物总丰度的贡献可达90%以上, 其中、大中型桡足类,,和分布广泛, 而小型桡足类、、、等在丰度上占比较高。通过聚类分析可将宇航员海浮游动物在区域上划分为5个群落, 普里兹湾涡流、威德尔涡流、南极绕极流南界等物理海洋学过程是宇航员海浮游动物群落分布模式的主要控制因素。另外, 生物环境匹配(Bio-env)分析显示, 饵料(叶绿素)也对该海区浮游动物的种群和群落结构具有重要影响。
群落结构; 浮游动物; 宇航员海; 南大洋
浮游动物作为食物网中连接初级生产者和高级消费者的中间环节(Mayzaud, 2014), 在南大洋生态系统的物质循环和能量流动过程中起到承上启下的作用(Schmidt, 2016), 并且通过摄食、排粪、被动沉降等过程调节颗粒有机碳从表层向深海输送(Steinberg, 2017)。浮游动物的空间分布受环境条件以及洋流等因素的影响, 也被认为是全球变化的生物指示器(Beaugrand, 2002; Estrada, 2012)。因此, 研究南大洋浮游动物的分布、群落结构与环境因子的关系及其时空尺度的变化可以更好地探知极地海洋生态系统结构及其对全球变化的响应与反馈(Constable, 2014; Pinkerton, 2020)。
气候变化背景下的南大洋环境自从20世纪60年代以来发生了显著变化: 西风逐渐增强且其影响区域极向扩张、南大洋环状模正位相年份增加、冰架崩塌甚至消失、底层水及表层水淡化、部分海域酸化(Rintoul, 2018)。这些环境变化已经对南大洋生态系统产生了深远影响(Constable, 2014), 南大洋西南极半岛周边海域自20世纪中期以来温度升高、海冰减少(Saba, 2014), 浮游植物群落发生重组, 大粒级的硅藻逐渐被小粒级的隐藻所替代(Montes-Hugo, 2009)。海冰的减少、浮游植物粒级的变化、南大洋环状模正相位年份的增加等导致浮游动物优势类群由磷虾和桡足类向纽鳃樽等浮游被囊动物转变(Atkinson, 2004), 而南极磷虾分布区域向高纬度收缩(Atkinson, 2019)。受此影响, 高营养级捕食者如企鹅、海豹、鲸鱼的聚居地和觅食区域也发生了变化(Henley, 2019)。这一系列的变化预示着整个西南极海域生态系统结构和功能发生了显著的变化(Constable, 2014)。
南大洋环境的变化趋势在不同的扇区之间存在很大的区域性差异(Constable, 2014; Convey, 2019)。温度升高、海冰减少等现象主要发生在西南极半岛海域, 南大洋其他扇区如东南极海域海冰变化相对稳定, 罗斯海扇区在1979年以来甚至呈现了温度降低和海冰增多的趋势(Lenaerts, 2017)。尽管人们从20世纪初期的时代就开始进行浮游动物的采样和研究, 但这些工作主要集中在南大洋的大西洋扇区、印度洋普里兹湾海区及太平洋的罗斯海海区(Atkinson, 2012; Moriarty, 2013)。南大洋宇航员海(Cosmonaut Sea)位于东南极恩德比地(Enderby Land)的西部, 介于30°—60°E之间(Hunt, 2007)。目前, 宇航员海海域的各方面研究均相对较少, 我们对其浮游动物的认识主要来自20世纪80年代末期前苏联针对大型浮游动物的系列航次和2006年夏季澳大利亚的“BROKE-West”航次(Hunt, 2007; Swadling, 2010)。Hunt等(2007)发现宇航员海大型浮游动物群落年际变化受到环南极流和近岸流等环流的影响, Swadling等(2010)用网目更精细的RMT1网(315 μm)对桡足类等中小型浮游动物信息进行了补充, 并发现叶绿素浓度、海冰消退时间等大尺度海洋过程决定了宇航员海浮游动物群落的分布模式。
在2019年12月至2020年1月中国第36次南极考察期间, 我们使用北太平洋网于宇航员海进行了海洋上层(0—200 m)浮游动物样品的采集, 基于样品鉴定数据和环境因子资料, 对宇航员海浮游动物的群落结构及其与环境因子的关系进行了分析。本研究的目的在于: (1) 描述该海域浮游动物种类组成、分布、丰度、群落结构; (2) 分析环境因子对浮游动物群落及分布的影响; 本文对数据稀少的宇航员海进行浮游动物数据的补充, 为今后该海域生态系统研究工作的开展提供基础数据。
1 材料与方法
1.1 现场取样
在中国第36次南极科学考察期间(CHINARE), 于2019年12月6日至2020年1月6日在宇航员海56个站位(图1)利用北太平洋网(0.5 m2, 330 μm)对浮游动物进行200 m至表层的拖网。拖网结束后将样品立即置于5%的中性福尔马林溶液中保存。

图1 宇航员海采样站位图
1.2 样品和数据分析
实验室内对浮游动物样品进行鉴定并计数, 其中, 大型浮游动物进行全样计数, 其余个体根据样品量进行1/2至1/8分样后在解剖镜下计数。四种桡足类优势种、和按照成体、幼体期CⅠ—CⅢ、CⅣ—CⅤ进行计数, 对两种磷虾和则按照CⅠ—CⅢ、FⅠ—FⅢ和FⅣ—FⅥ进行计数(Yang, 2011)。每个样品至少保证300—500个个体被计数, 每个站位浮游动物各物种的丰度由物种总个数除以拖网时过滤水的体积得到, 单位为ind./m3。
将通过鉴定计数得到的所有浮游动物数据整合后对浮游动物群落进行划分。丰度数据经平方根转化后基于Bray-Curtis相似性指数和组平均的方法进行q-型聚类(Field, 1982)。多维多度分析(NMDS)对聚类分析进行重复(Hunt, 2007)。聚类得到的浮游动物群组通过相似百分度(SIMPER)来确定对群落的划分起关键作用的物种。
指示种分析(Ind Val)用于确定各站位分组之间的指示物种(Dufrêne, 1997)。
指示种()计算公式如下:
=A×B×100, (1)


Bio-env分析用来解释环境因子(表层温度、盐度、叶绿素、0—200 m水柱平均温度、盐度、叶绿素、无冰天数)与浮游动物群落划分的关系。无冰天数是指某站位离海冰浓度低于15%的天数, 海冰浓度数据由美国国家冰雪数据中心(National Snow & Ice Data Center, NSIDC)网站获得。相关系数用p表示, 其数值介于0—1之间,p越接近1表示生物数据与环境因子的相关性越大,p=0则表示生物数据与环境因子无相关性。
温度和盐度数据由Seabird 911型CTD现场测定。叶绿素浓度测定水样采集自0、25、50、150和200 m, 取500 mL水样用GF/F玻璃纤维滤膜过滤, 经90%丙酮溶液萃取12—24 h后用Turner 荧光计测定。
多元统计分析主要使用Primer软件完成。
2 结果
2.1 环境因子
调查期间, 大部分站位海冰均已消退, 少数靠近大陆边缘的站位仍有较多浮冰。在整个采样区域, 0—200 m水体平均温度范围为-1.76—0.64 °C, 东北和西南区域水温较高, 而西北和东南区域水温较低(图2); 0—200 m水体平均盐度范围为34.11—34.46, 中部区域盐度最高(图2); 此外, 0—200 m水体平均叶绿素浓度范围为0.02—1.00 mg/m3, 叶绿素浓度最大值出现在调查区域的西北部C4-03站位。

图2 0—200 m水柱平均温度和盐度
2.2 浮游动物群落
浮游动物总丰度在8.93—102 ind./m3之间, C6-01站位丰度最高, C3-03站位最低(图3)。浮游动物群落主要由桡足类组成, 其丰度占总丰度的90%以上。聚类分析结果显示在相似度为71.3%和62.7%时浮游动物可分为5个群落(图4)。
群落1主要位于采样区域的东南部, 0—200 m水体平均温度最低, 为-1.24 °C, 盐度处于平均水平为34.32, 0—200 m水体平均叶绿素浓度为0.30 mg/m3(图4c, 表1)。群落1浮游动物平均丰度相对较低, 为(27.09低, 为平为南) ind./m3, 其指示种为、、sp.和spp. (表2)群落2主要位于采样区域离大陆较远的北部, 0—200 m水体平均温度相对较高, 为0.11 °C, 盐度平均水平为34.29, 平均叶绿素浓度最高, 为0.36 mg/m3(图4c, 表1)。群落2浮游动物平均丰度最高, 为(80.23均丰度最高, ) ind./m3, 其指示种为、、、、、、、、、和(表2)。

图3 2019/2020年夏季和2006年夏季宇航员海浮游动物的总丰度及空间分布(改自Swadling et al, 2010)
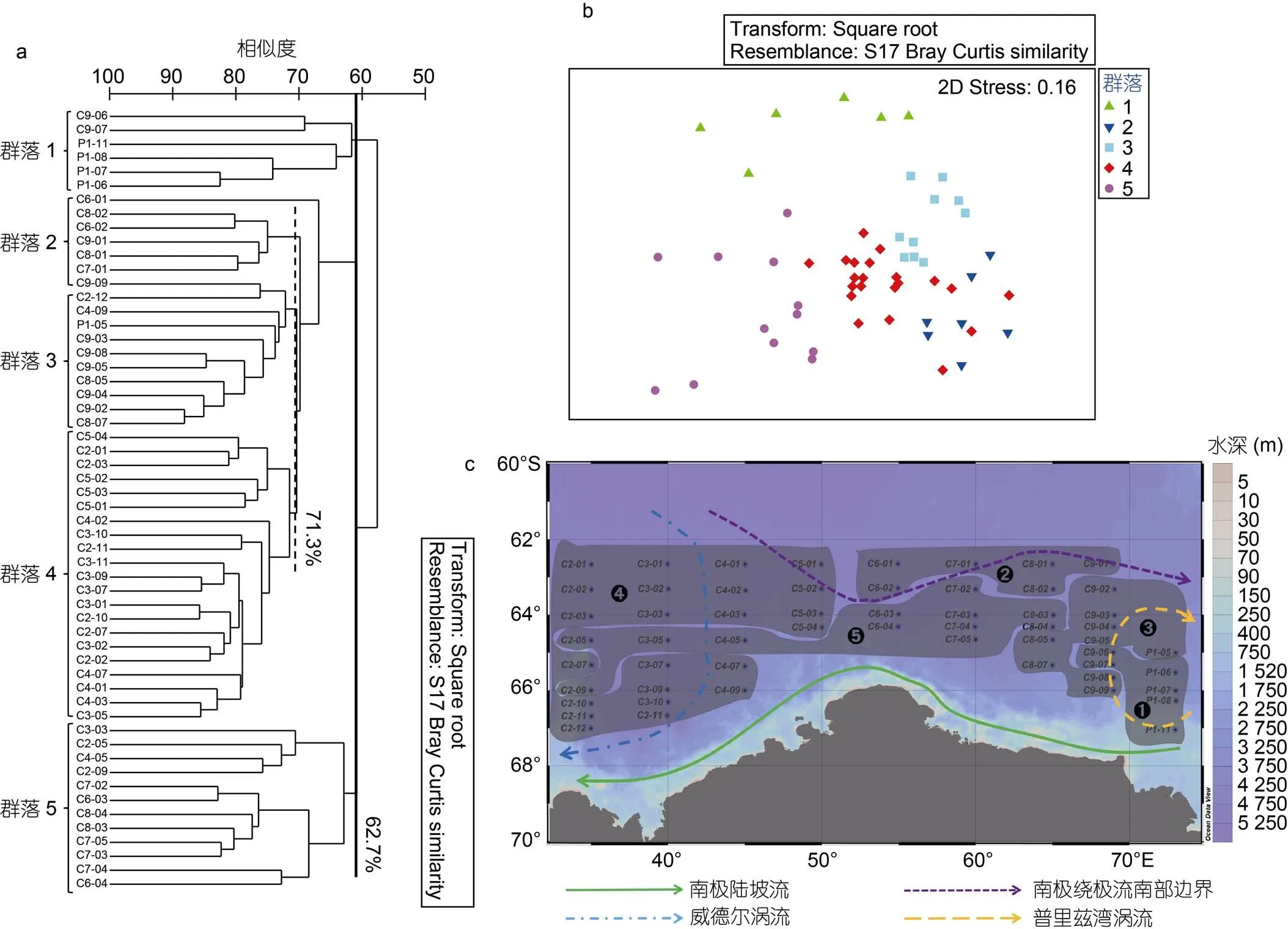
图4 基于浮游动物丰度数据的聚类分析(a)、多维多度分析(b)及地图中浮游动物群落分组展示(c)
注: 环流大致位置参照Orsi等(1995)及Williams等(2010)
表1 群落1—5所处区域的环境特征及浮游动物平均丰度(平均值及范围)

Tab.1 Environmental variables and average abundance of zooplankton (the mean and range) in communities 1—5
表2 SIMPER分析显示对各群落划分累积贡献超过90%的物种组成及丰度
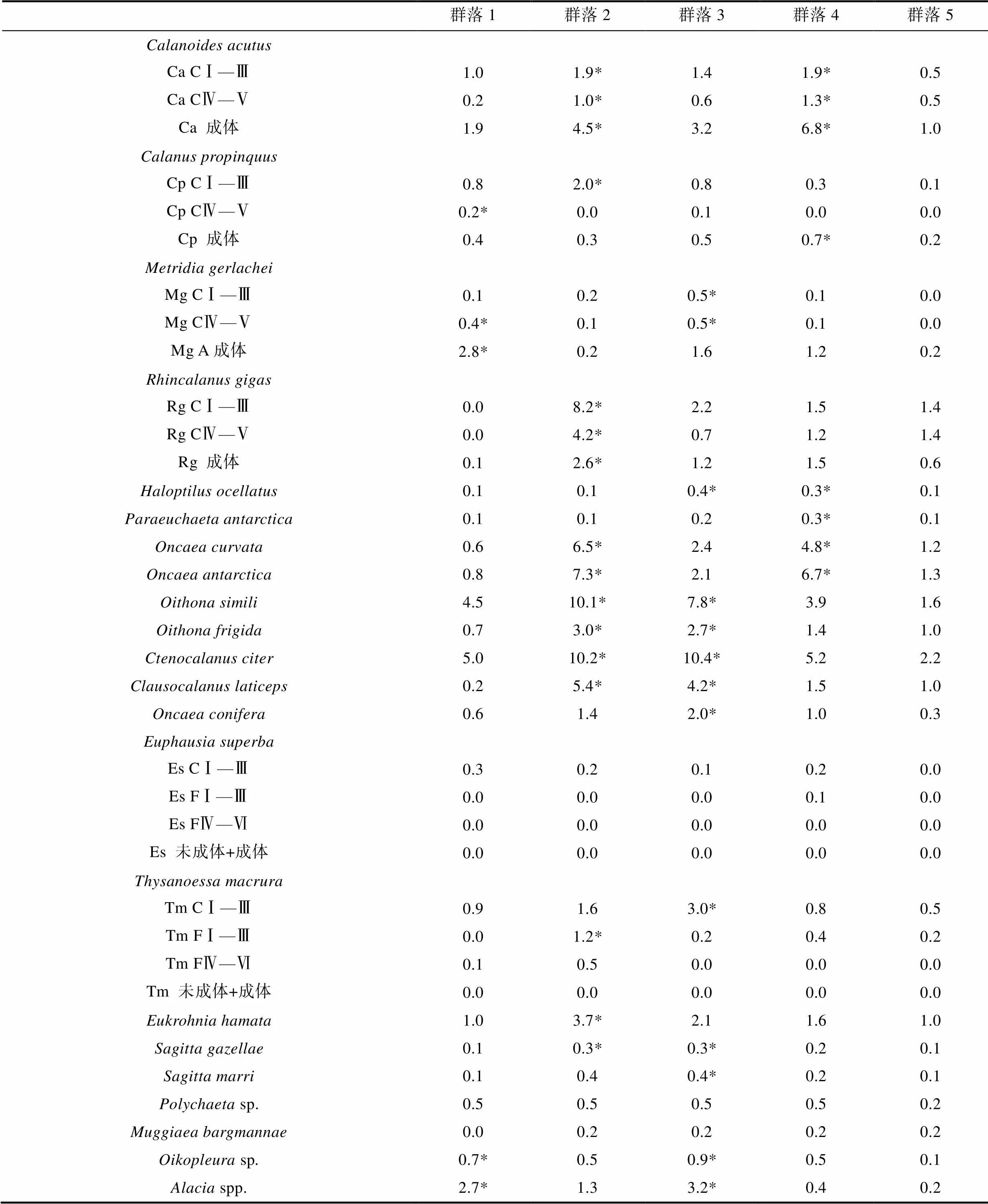
Tab.2 Average abundances (ind./m3) of zooplankton species that contributed >90% to the similarity within each group based on SIMPER analysis
注: *表示该物种为此群落的指示种; 桡足类CⅠ—Ⅲ表示桡足类的桡足幼体阶段; 磷虾CⅠ—Ⅲ表示磷虾原蚤状幼体阶段, FⅠ—Ⅵ表示磷虾蚤状幼体阶段
群落3主要位于采样区域东北部, 0—200 m水体平均温度和盐度均相对较低, 分别为-0.66 °C和34.28, 平均叶绿素浓度相对略低, 为0.27 mg/m3(图4c, 表1)。群落3浮游动物平均丰度相对较高, 为(56.36±10.37)ind./m3, 其指示种为、、、、、、、、、sp.和spp. (表2)。群落4主要位于采样区域的西部, 0—200 m水体平均温度和盐度分别为-0.30 °C和34.29, 平均叶绿素浓度相对较低, 为0.24 mg/m3(图4c, 表1)。群落4浮游动物平均丰度为(47.26±19.43) ind./m3, 其指示种为、、和(表2)。群落5主要位于采样区域的中部, 0—200 m水体平均温度和盐度均最高, 分别为0.30 °C和34.33, 而平均叶绿素浓度最低, 为0.23 mg/m3(图4c, 表1)。群落5浮游动物平均丰度最低, 为(17.20±5.45) ind./m3。群落5中浮游动物各物种丰度均相对较低, 这也是该群落无指示种的原因(表2)。群落5存在两个亚组(图4b, 4c), 其中5b主要包括站位C2-5、C2-9、C3-3和C4-5 (图4c), 两个亚组在物种组成和丰度上无明显差异, 因此本文只对群落5作为整体进行了物种组成和丰度展示(表2)。
2.3 桡足类优势物种的种群结构
、、和在南大洋不同扇区广泛分布, 也在本次所有调查站位中均被发现。平均丰度最高(图5), 为(6.32±5.95)ind./m3, 从种群结构来看, 在各群组成体阶段均占有较高的比例, 幼体期CI—CIII、CⅣ—CⅤ次之(图6);平均丰度最低, 为(1.14±1.47) ind./m3, 从种群结构来看, 在各群组幼体期CI—CIII占有较高的比例, 成体、幼体期CⅣ—CⅤ次之;平均丰度较低, 为(1.48±1.73) ind./m3, 从种群结构来看, 在各群组成体阶段均占有较高比例, 幼体期CI—CIII、CⅣ—CⅤ次之;平均丰度较高, 为(4.90±5.15) ind./m3, 从种群结构来看, 在各群组幼体期CI—CIII占有较高的比例, 幼体期CⅣ—CⅤ、成体次之。
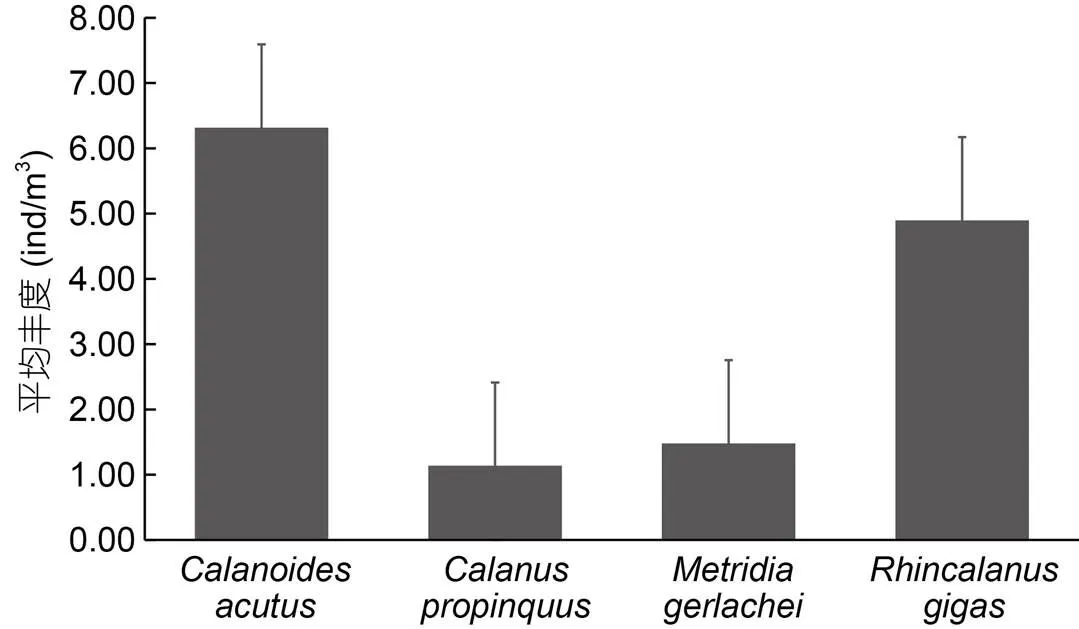
图5 Calanoides acutus, Metridia gerlachei, Calanus propinquus和Rhincalanus gigas平均丰度(误差棒为标准差)
2.4 环境因子对群落结构的影响
生物数据与环境数据的Bio-Env分析显示, 温度是对群落聚类结果起关键作用的单因子(p= 0.330, 表3)。表层温度、0—200 m水体平均盐度及0—200 m水体平均叶绿素浓度三个环境因子的组合与生物数据的相关性最优(p= 0.375, 表3), 较好解释了群落划分的合理性。无冰天数并没有对浮游动物的群落划分起到主要解释作用(表3)。
3 讨论
3.1 宇航员海浮游动物组成及群落结构
本研究使用的网具(北太平洋网, 网口面积0.5 m2, 网目330 μm)与2006年夏季澳大利亚“BROKE-West”航次调查使用的网具(RMT1网, 网口面积1 m2, 网目315 μm)具有相近的网目, 因此数据具有较好的可比性来研究宇航员海10余年前后夏季浮游动物群落的组成和结构差异。由于本次采样位点未涉及冰间湖等近岸区域, 因此以往南大洋印度洋扇区经常报道的以晶磷虾为指示种、高丰度的近岸群落在本研究中未出现(Hunt, 2007; Yang, 2011)。与以往南大洋不同海域浮游动物群落研究(Hosie, 1994; Hunt, 2007; Pakhomov, 2020)相似的是, 群落划分很大程度上归因于浮游动物优势物种丰度尤其是桡足类丰度的差异而不是浮游动物物种组成的变化(表2)。对本研究各群落划分累积起到90%以上的优势物种/类群一共23种(表2), 均为南大洋较为常见且广泛分布的物种(Atkinson, 2012; Pakhomov, 2020)。本研究浮游动物群落总平均丰度与2006年夏季澳大利亚“BROKE-West”航次记录在一个量级上(图3), 但数值略高于其研究结果[本研究: 44.41 ind./m3对比Swadling 等(2010): 23.16 ind./m3], 这种差异可能更大程度上源于南大洋“季节性”的差异而非“年际间”的差异。本次采样集中在海冰消退初期的夏季初期(12月), 而“BROKE-West”航次集中在海冰消退中后期的1—2月(Swadling, 2010)。由于南大洋海冰等环境因子强烈的季节性差异及上行效应在食物网中的主导地位(Atkinson, 2014), 浮游动物群落的年内差异(季节差异)通常高于年际间的差异(Pinkerton, 2020)。在物种组成上, 本研究与“BROKE-West”航次有很大的相似性: 桡足类通常较占优势, 其丰度对该海域浮游动物总丰度的贡献可达90%以上(表2, Swadling, 2010)。尽管我们采样网具的网目(330 μm)对、、、等小型桡足类存在显著的低估(Makabe, 2012), 它们在两个航次均呈现极高的丰度(表2)。随着近些年南大洋采样网具的精细化, 小型桡足类在初级生产的摄食控制、颗粒有机碳向深水的传输等生态系统过程中的贡献越来越受到人们的关注(Calbet, 2008; Steinberg, 2017)。

图6 Calanoides acutus, Metridia gerlachei, Calanus propinquus和Rhincalanus gigas各发育期占比
表3 Bio-env分析结果

Tab.3 Results of Bio-Env analysis
、、和四种优势大中型桡足类是南大洋浮游动物生物量的主要贡献类群, 在某些海域其产量甚至远高于南极磷虾(Conover, 1991; Voronina, 1998; Pakhomov, 2020)。它们存在不同程度的昼夜垂直移动和季节性垂直迁移(Atkinson, 1992)。储存脂质是高纬度地区桡足类的典型特征, 大多数物种在夏季富含浮游植物的表层水体摄食后进入深水区进行越冬(Atkinson, 1998), 其中冬季滞育物种的脂质含量相对最高(Donnelly, 1994; Hagen, 1996)。这种由桡足类季节性垂直移动主导的碳向深海传输的脂质泵过程首次在北大西洋提出(Jónasdóttir, 2015), 并在近些年的生物地球化学循环过程研究中广泛体现(Boyd, 2019)。在本研究中, 0—200 m水体中四种优势桡足类早期幼体CI—CIII数量较多(图6), 说明它们正处于夏季浮游植物暴发后的种群补充期。种群呈现最高的早期幼体比例(图6), 与以往研究认为生活史过程中具有延长的发育期的观点相一致(Schnack-Schiel,1994)。
本次研究我们在宇航员海主要采集到两种磷虾: 南极磷虾和长臂樱磷虾(表2)。与“BROKE-West”航次结果相似的是, 长臂樱磷虾在宇航员海具有更高的丰度(Swadling, 2010)。需要指出的是由于成体磷虾较强的游泳能力, 我们的调查网具与Swadling等(2010)的调查网具均不能有效地对其进行获取。南极磷虾在位于大洋区的群落2、4相对较高的丰度(表2)验证了Atkinson等(2008)提出的南大洋印度-太平洋扇区南极磷虾主要分布在陆架坡折附近大洋区的观点。近期基于单季节环南极调查航次和KRILLBASE数据库(1926—2016年)的研究结果显示随着南大洋大西洋扇区磷虾生境的破坏, 其他扇区成为磷虾生境的避难所(Yang, 2021)。宇航员海将来是否可以成为南极磷虾新的生物量热点区还需要今后持续的调查和采样。
3.2 环境因子对浮游动物群落的影响
水团、锋面、温度、饵料供应是南大洋浮游动物群落及生态系统结构的主要影响因子(Nicol, 2000; Chapman, 2020)。本研究中5组群落的划分与水团有很好的吻合(图4)。基于2006年澳大利亚“BROKE-West”航次(Meijers, 2010)及本航次的温盐数据, 群落1和群落3靠近顺时针循环的普里兹湾涡流(Prydz Bay Gyre); 群落2靠近南极绕极流并且在南极绕极流南部边界以南, 位于更深、更温暖的水域; 群落4主要受到顺时针循环进入宇航员海并随南极陆坡流(Antarctic Slope Current)返回的威德尔涡流(Weddell Gyre)的影响; 群落5主要位于采样区域的中部, 该群落0—200 m水体温盐均最高, 可能是受到威德尔环流和南极绕极流南部边界的影响。Hunt等(2007)对该海域大型浮游动物群落年际变化的研究也显示此区域浮游动物群落与环南极流、近岸流等水团分布有显著的关系。位于顺时针循环普里兹湾涡流内的群落1具有最高的南极磷虾丰度(表2), Kawaguchi等(2010)认为此涡流体系存在独立的、自我维持的磷虾种群。
海冰是极地海域重要的环境因子之一, 南大洋海冰的变化通过饵料供应引起的食物网生态学效应受到人们的广泛关注(Atkinson, 2004, 2019; Constable, 2014)。Swadling等(2010)发现海冰消退的天数很好地解释了宇航员浮游动物群落的划分。但本文研究结果显示海冰相关的参数(无冰天数等)在Bio-Env分析结果中没有得以体现, 我们分析浮游动物群落结构主要受到环流、锋面等相对大尺度的物理海洋学过程控制。另外海冰消退通过对饵料供应的效应影响浮游动物的种群补充需要一定的时间积累(Yang, 2011), 本航次调查期间大部分站位均处于海冰消退初期, 而BROKE-WEST航次相比此航次滞后一个月, 且绝大部分站位均处于海冰消退后期(Swadling, 2010), 海冰消退通过对饵料供应的上行效应已经对浮游动物产生了重要影响。这也是海冰(无冰天数)在本研究和以往研究(Swadling, 2010)在对浮游动物群落划分解释上存在差异的原因之一。尽管海冰对浮游动物影响的信号在本研究中没有被捕捉到, 饵料仍然对夏季初期宇航员海浮游动物的种群补充有一定的解释: 浮游动物平均丰度最高的群落2区域具有最高的叶绿素浓度(表1, 2), 同时桡足类在叶绿素浓度相对较高的群落1、2、3所在区域呈现相对更“年轻”的种群结构(图6)。此外Bio-env分析结果也表明温度、盐度与叶绿素三者的结合更好地解释了浮游动物群落的划分(表3)。这些都潜在地说明除了环流等大尺度的物理学过程, 饵料供应也对宇航员海域浮游动物群落结构产生了重要的影响。
4 结语
本研究显示宇航员海域夏季浮游动物群落主要由桡足类、磷虾、毛颚类、浮游被囊类等类群组成, 其中桡足类丰度对浮游动物总丰度的贡献可达90%以上。普里兹湾涡流、威德尔涡流、南极绕极流南界等物理海洋学过程是宇航员海浮游动物群落分布模式的主要控制因素, 另外, 饵料(叶绿素)也对该海区浮游动物的种群和群落结构具有重要影响。
本研究是继10余年前2006年夏季“BROKE-West”航次以来全球唯一的一次对宇航员海较为系统的调查, 我们对此海域浮游动物群落划分及其与环境影响因子的关系进行了探讨。研究结果对数据相对匮乏的宇航员海进行了数据补充, 为该海域今后进行连续观测的站位设计提供了基础参考, 同时为南大洋变化的大背景下更好地监测中上层浮游生态系统的长期变化及其对气候环境变化的响应奠定基础。
致谢 感谢中国第36次南极科学考察雪龙2号船全体船员对现场样品采集工作的帮助。
Atkinson A, 1998. Life cycle strategies of epipelagic copepods in the Southern Ocean. Journal of Marine Systems, 15(1—4): 289—311
Atkinson A, Hill S L, Barange M, 2014. Sardine cycles, krill declines, and locust plagues: revisiting wasp-waist food webs. Trends in Ecology & Evolution, 29(6): 309—316
Atkinson A, Hill S L, Pakhomov E A, 2019. Krill () distribution contracts southward during rapid regional warming. Nature Climate Change, 9(2): 142—147
Atkinson A, Siegel V, Pakhomov E, 2004. Long-term decline in krill stock and increase in salps within the Southern Ocean. Nature, 432(7013): 100—103
Atkinson A, Siegel V, Pakhomov E A, 2008. Oceanic circumpolar habitats of Antarctic krill. Marine Ecology Progress, 362(1): 1—23
Atkinson A, Ward P, Hunt B P V, 2012. An overview of Southern Ocean zooplankton data: Abundance, biomass, feeding and functional relationships. CCAMLR Science, 19: 171—218
Atkinson A, Ward P, Williams R, 1992. Diel vertical migration and feeding of copepods at an oceanic site near South Georgia. Marine Biology, 113(4): 583—593
Beaugrand G, Reid P C, Ibañez F, 2002. Reorganization of North Atlantic marine copepod biodiversity and climate. Science, 296(5573): 1692—1694
Boyd P W, Claustre H, Levy M, 2019. Multi-faceted particle pumps drive carbon sequestration in the ocean. Nature, 568(7752): 327—335
Calbet A, 2008. The trophic roles of microzooplankton in marine systems. ICES Journal of Marine Science, 65(3): 325—331
Chapman C C, Lea M A, Meyer A, 2020. Defining Southern Ocean fronts and their influence on biological and physical processes in a changing climate. Nature Climate Change, 10(3): 209—219
Conover R J, Huntley M, 1991. Copepods in ice-covered seas—Distribution, adaptations to seasonally limited food, metabolism, growth patterns and life cycle strategies in polar seas. Journal of Marine Systems, 2(1/2): 1—41
Constable A J, Melbourne-Thomas J, Corney S P, 2014. Climate change and Southern Ocean ecosystems I: how changes in physical habitats directly affect marine biota. Global Change Biology, 20(10): 3004—3025
Convey P, Peck L S, 2019. Antarctic environmental change and biological responses. Science Advances, 5(11): eaaz0888
Donnelly J, Torres J J, Hopkins T L, 1994. Chemical composition of antarctic zooplankton during austral fall and winter. Polar Biology, 14(3): 171—183
Dufrêne M, Legendre P, 1997. Species assemblages and indicator species: The need for a flexible asymmetrical approach. Ecological Monographs, 67(3): 345—366
Estrada R, Harvey M, Gosselin M, 2012. Late-summer zooplankton community structure, abundance, and distribution in the Hudson Bay system (Canada) and their relationships with environmental conditions, 2003-2006. Progress in Oceanography, 101(1): 121—145
Field J G, Clarke K R, Warwick R M, 1982. A Practical Strategy for Analysing Multispecies Distribution Patterns. Marine Ecology Progress Series, 8: 37—52
Hagen W, Schnack-Schiel S B, 1996. Seasonal lipid dynamics in dominant Antarctic copepods: Energy for overwintering or reproduction?. Deep Sea Research Part I Oceanographic Research Papers, 43(2): 139—158
Henley S F, Schofield O M, Hendry K R, 2019. Variability and change in the west Antarctic Peninsula marine system: Research priorities and opportunities. Progress in Oceanography, 173: 208—237
Hosie G W, Cochran T G, 1994. Mesoscale distribution patterns of macrozooplankton communities in Prydz Bay, Antarctica - January to February 1991. Marine Ecology Progress Series, 106: 21—39
Hunt B P V, Pakhomov E A, Trotsenko B G, 2007. The macrozooplankton of the Cosmonaut Sea, east Antarctica (30°E–60°E), 1987—1990. Deep Sea Research Part I: Oceanographic Research Papers, 54(7): 1042—1069
Jónasdóttir S H, Visser A W, Richardson K, 2015. Seasonal copepod lipid pump promotes carbon sequestration in the deep North Atlantic. Proceedings of the National Academy of Sciences of the United States of America, 112(39): 12122—12126
Kawaguchi S, Nicol S, Virtue P, 2010. Krill demography and large-scale distribution in the Western Indian Ocean sector of the Southern Ocean (CCAMLR Division 58.4.2) in Austral summer of 2006. Deep Sea Research Part II: Topical Studies in Oceanography, 57(9/10): 934—947
Lenaerts J T M, Lhermitte S, Drews R, 2017. Meltwater produced by wind–albedo interaction stored in an East Antarctic ice shelf. Nature Climate Change, 7(1): 58—62
Makabe R, Tanimura A, Fukuchi M, 2014. Comparison of mesh size effects on mesozooplankton collection efficiency in the Southern Ocean.Journal of Plankton Research, 34( 5) : 432—436
Mayzaud P, Pakhomov E A, 2014. The role of zooplankton communities in carbon recycling in the ocean: the case of the Southern Ocean. Journal of Plankton Research, 36(6): 1543—1556
Meijers A J S, Klocker A, Bindoff N L, 2010. The circulation and water masses of the Antarctic shelf and continental slope between 30 and 80°E. Deep Sea Research Part II: Topical Studies in Oceanography, 57(9/10): 723—737
Montes-Hugo M, Doney S C, Ducklow H W, 2009. Recent changes in phytoplankton communities associated with rapid regional climate change along the western Antarctic Peninsula. Science, 323(5920): 1470—1473
Moriarty R, O'Brien T D, 2013. Distribution of mesozooplankton biomass in the global ocean. Earth System Science Data, 5(1): 45—55
Nicol S, Pauly T, Bindoff N L, 2000. Ocean circulation off East Antarctica affects ecosystem structure and sea-ice extent. Nature, 406(6795): 504—507
Orsi A H, Whitworth III T, Nowlin Jr W D, 1995. On the meridional extent and fronts of the Antarctic Circumpolar Current. Deep Sea Research Part I: Oceanographic Research Papers, 42(5): 641—673
Pakhomov E A, Pshenichnov L K, Krotet A, 2020. Zooplankton distribution and community structure in the Pacific and Atlantic sectors of the Southern Ocean during austral summer 2017—18: a pilot study conducted from Ukrainian long-liners. Journal of Marine Science and Engineering, 7(8): 488
Pinkerton M H, Décima M, Kitchener J A, 2020. Zooplankton in the Southern Ocean from the continuous plankton recorder: Distributions and long-term change. Deep Sea Research Part I: Oceanographic Research Papers, 162: 103303
Rintoul S R, Chown S L, Deconto R M, 2018. Choosing the future of Antarctica. Nature, 558(7709): 233—241
Saba G K, Fraser W R, Saba V S, 2014. Winter and spring controls on the summer food web of the coastal West Antarctic Peninsula. Nature Communications, 5(1): 4318
Schmidt K, Schlosser C, Atkinson A, 2016. Zooplankton gut passage mobilizes lithogenic iron for ocean productivity. Current Biology, 26(19): 2667—2673
Schnack-Schiel S B, Hagen W, 1994. Life cycle strategies and seasonal variations in distribution and population structure of four dominant calanoid copepod species in the eastern Weddell Sea, Antarctica. Journal of Plankton Research, 16(11): 1543—1566
Steinberg D K, Landry M R, 2017. Zooplankton and the ocean carbon cycle. Annual Review of Marine Science, (1): 413—444
Swadling K M, Kawaguchi S, Hosie G W, 2010. Antarctic mesozooplankton community structure during BROKE-West (30°E–80°E), January–February 2006. Deep Sea Research Part II: Topical Studies in Oceanography, 57(9/10): 887—904
Voronina N M, 1998. Comparative abundance and distribution of major filter-feeders in the Antarctic pelagic zone. Journal of Marine Systems, 17(1/4): 375—390
Williams G D, Nicol S, Aoki S, 2010. Surface oceanography of BROKE-West, along the Antarctic margin of the south-west Indian Ocean (30–80°E). Deep Sea Research Part II: Topical Studies in Oceanography, 57(9/10): 738—757
Yang G, Atkinson A, Hill L S, 2021. Changing circumpolar distributions and isoscapes of Antarctic krill: Indo-Pacific habitat refuges counter long-term degradation of the Atlantic sector. Limnology and Oceanography, 66(1): 272—287
Yang G, Li C L, Sun S, 2011. Inter-annual variation in summer zooplankton community structure in Prydz Bay, Antarctica, from 1999 to 2006. Polar Biology, 34(6): 921—932
THE ZOOPLANKTON COMMUNITY IN COSMONAUT SEA: COMMUNITY STRUCTURE AND ENVIRONMENTAL FACTORS
MOU Wen-Xiu1, 2, 3, YANG Guang1, 2, 4, HAO Qiang5, XU Zhi-Qiang1, LI Chao-Lun1, 2, 3, 4
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4. Center for Ocean Mega Science, Chinese Academy of Sciences, Qingdao 266071, China; 5.Second Institute of Oceanography, Ministry of Natural Resources, Hangzhou 310012, China)
Based on samples collected using a Norpac net (0.5 m2, 330 μm) in the Cosmonaut Sea, Antarctic during the 36th Chinese National Antarctic Research Expedition (December 2019 to January 2020), the zooplankton community structure, abundance, population structure of dominant species and their relationship with environmental factors were studied. Our results show that total abundance of zooplankton in Cosmonaut Sea in the summer of 2019/2020 varied from 8.93 to 102.00 ind./m3. Zooplankton was mainly composed of copepods, krill, chaetognaths, and tunicates. Zooplankton abundance in each station was dominated by copepods (>90%). The large-sized copepods, such as,,and, were more widely distributed in the survey area, while small-sized ones, such as,,, andwere more abundant. Five groups of zooplankton community could be recognized based on cluster analysis and they were closely linked to local physical oceanographic processes (the Prydz Bay Gyre, Weddell Gyre, and the Southern boundary of the Antarctic Circumpolar Current). Food availability (chlorophyll) also had an important impact on the population structure and community structure of zooplankton.
community structure; zooplankton; Cosmonaut Sea; Southern Ocean
Q958.8
10.11693/hyhz20210200043
* 国家自然科学基金项目, 41876217号; 自然资源部南大洋专项, IRASCC2020-2022-No. 01-02-02B, 02-04-02。牟文秀, 硕士研究生, E-mail: 17863804640@163.com
李超伦, 博士生导师, 教授, E-mail: lcl@qdio.ac.cn
2021-02-08,
2021-03-17
