文冠果活性炭水凝胶的制备及其吸附性能研究
2021-07-20郝一男王喜明王晶文
郝一男,王喜明,王晶文
(1.内蒙古农业大学 材料科学与艺术设计学院,内蒙古 呼和浩特 010018;2.内蒙古沙生灌木资源纤维化和能源化开发利用重点实验室,内蒙古 呼和浩特 010018)
染料在很多行业中都有着广泛的应用,比如造纸业、纺织业、食品业等[1]。这些行业排放的染料废水对生态环境已经构成了严重的威胁[2-4]。活性炭(AC)作为一种常用的多孔吸附材料,具有很高的比表面积和良好的吸附性能,是目前处理废水的常用吸附剂[5]。活性炭的孔径越细越小,吸附效果就越强[6],但是回收起来比较困难。而水凝胶是一种能够吸收大量水分或者在溶剂中吸收一定量的溶剂溶胀但不会溶解的三维网络状高分子,近些年来被广泛的应用于环境治理[7-9]。水凝胶本身具有的三维网络结构决定了其在吸附等方面的应用范围广。本文以文冠果活性炭水凝胶作为吸附剂吸附亚甲基蓝,以期为水凝胶固定活性炭高效吸附材料的开发提供理论依据。
1 实验部分
1.1 材料与仪器
文冠果活性炭,自制;丙烯酸、丙烯酰胺、氢氧化钠、过硫酸铵、N,N-亚甲基双丙烯酰胺均为分析纯。
SHA-C水浴恒温振荡器;CP224C电子天平;STARTER310pH值测定仪;H2050R离心机;DZF-6210真空干燥箱; SHB-IIIA循环水式多用真空泵;Tensor27傅里叶变换红外光谱仪;BEL-mini II型物理吸附仪;769YP-15A粉末压片机;TU-1950双光束紫外可见分光光度计。
1.2 实验方法
1.2.1 文冠果活性炭水凝胶的制备 在烧瓶中依次加入一定量的丙烯酰胺(AM)、丙烯酸(AA)以及氢氧化钠,在一定量的蒸馏水中溶解,然后依次加入交联剂N,N-亚甲基双丙烯酰胺和提前制备好的文冠果活性炭,然后在室温下磁力搅拌30 min,再加入过硫酸铵后密封,然后在50 ℃的恒温水浴锅中反应10 h。将得到的产物成品用蒸馏水浸泡,清洗,过滤,这个过程重复4次,然后放在真空干燥箱中恒温干燥,最后筛选备用。
1.2.2 绘制MB溶液标线 配制5组不同浓度的MB溶液(浓度为2,4,6,8,10 mg/L),用双光束紫外可见分光光度计测其吸光值,设置波长为662 nm,然后制得MB浓度和吸光度的标准曲线,结果见图1。

图1 亚甲基蓝的标准曲线Fig.1 Standard curve of methylene blue
1.2.3 吸附实验 用50 mL的容量瓶量取40 mL已知浓度的MB溶液,然后称量0.05 g的XSBACH加入溶液中,水浴恒温振荡器中振荡,振速调为120 r/min。 然后在单一变量的条件下吸附,这单一变量的条件是:时间(分别为60,90,120,150,180 min), 初始浓度(分别是300,400,500,600,700 mg/L),然后加入适量浓度的NaOH溶液或者HCl溶液来改变MB溶液的pH值(分别是3,5,7,9,11)以及温度(分别为20,30,40,50,60 ℃)。吸附平衡后用离心机进行离心,然后用移液管移取适量的上清液放到锥形瓶中,用双光束紫外可见分光光度计测量吸附达到平衡后MB溶液的浓度,按照公式(1)计算出吸附量。
Qe=V(C0-Ce)/m
(1)
式中Qe——吸附量,mg/g;
C0——吸附前MB初始浓度,mol/L;
Ce——吸附平衡后MB浓度,mol/L;
V——MB溶液的体积,mL;
m——XSBACH的质量,g。
2 结果与讨论
2.1 红外光谱分析
利用FTIR对XSBACH和XSBAC的化学官能团进行表征,结果见图2。

图2 XSBACH和XSBAC的红外光谱图Fig.2 FTIR patterns of XSBACH and XSBAC
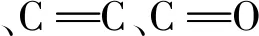
2.2 比表面积分析
利用比表面积分析仪对XSBACH的比表面积和孔径结构进行分析,XSBACH的N2吸附曲线属于第Ⅰ类吸附曲线。由图3可知,XSBACH的中孔较为发达,0~10 nm内孔容积达到最大值,而XSBACH孔容积数值最大,当超过中孔范围后孔容积趋向于0。由图4可知,XSBACH的吸附曲线在相对压力低于0.1时,N2的吸附量上升比较明显,这是由于XSBACH含有较多的孔隙,主要为微孔吸附和快速填充。当相对压力高于0.1时,N2的吸附量上升幅度缓慢,这是由于XSBACH含有较多的中孔并发生了毛细凝聚,吸附量增大。当相对压力高于0.8时,N2的吸附量急剧上升,这是发生了大孔填充。XSBAC在相对压力0.1~0.8之间,吸附量的曲线趋向于平缓,相对压力到达0.8以后,才缓慢上升,没有XSBACH上升的明显。由BET方程可得,XSBAC的比表面积为1 263.5 m2/g,而XSBACH的比表面积为1 435.9 m2/g, XSBACH的比表面积比XSBAC大,因此,XSBACH的吸附效果优于XSBAC。

图3 XSBACH和XSBAC的孔径分布Fig.3 Pore size distribution of XSBACH and XSBAC
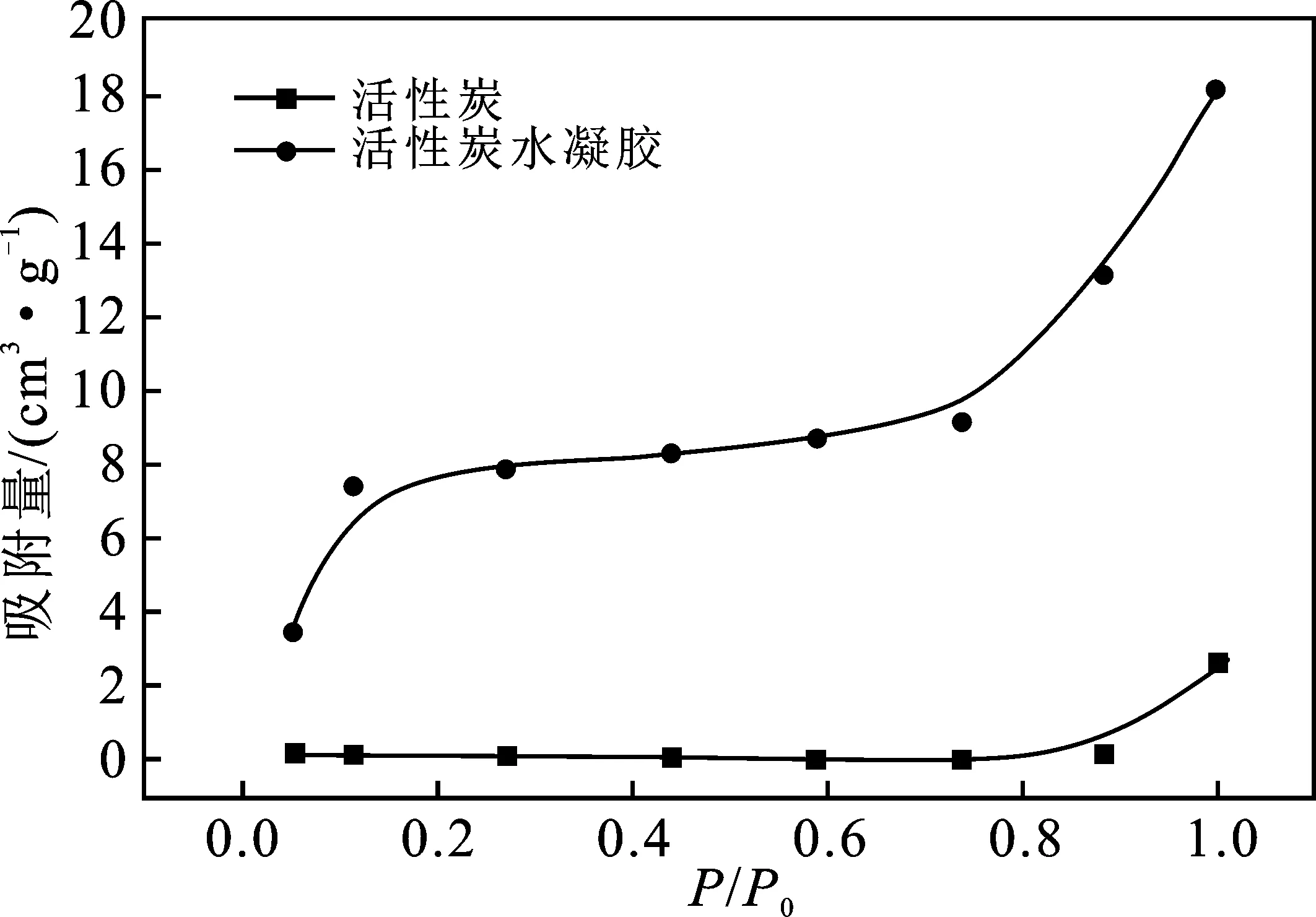
图4 XSBACH和XSBAC的N2吸附曲线Fig.4 Nitrogen adsorption isotherms of XSBACH and XSBAC
2.3 XSBACH吸附MB的研究
2.3.1 MB溶液浓度对吸附性能的影响 吸附时间为120 min,吸附温度为30 ℃,XSBACH的投加量为0.05 g时,MB溶液的初始浓度对XSBACH吸附量的影响见图5。
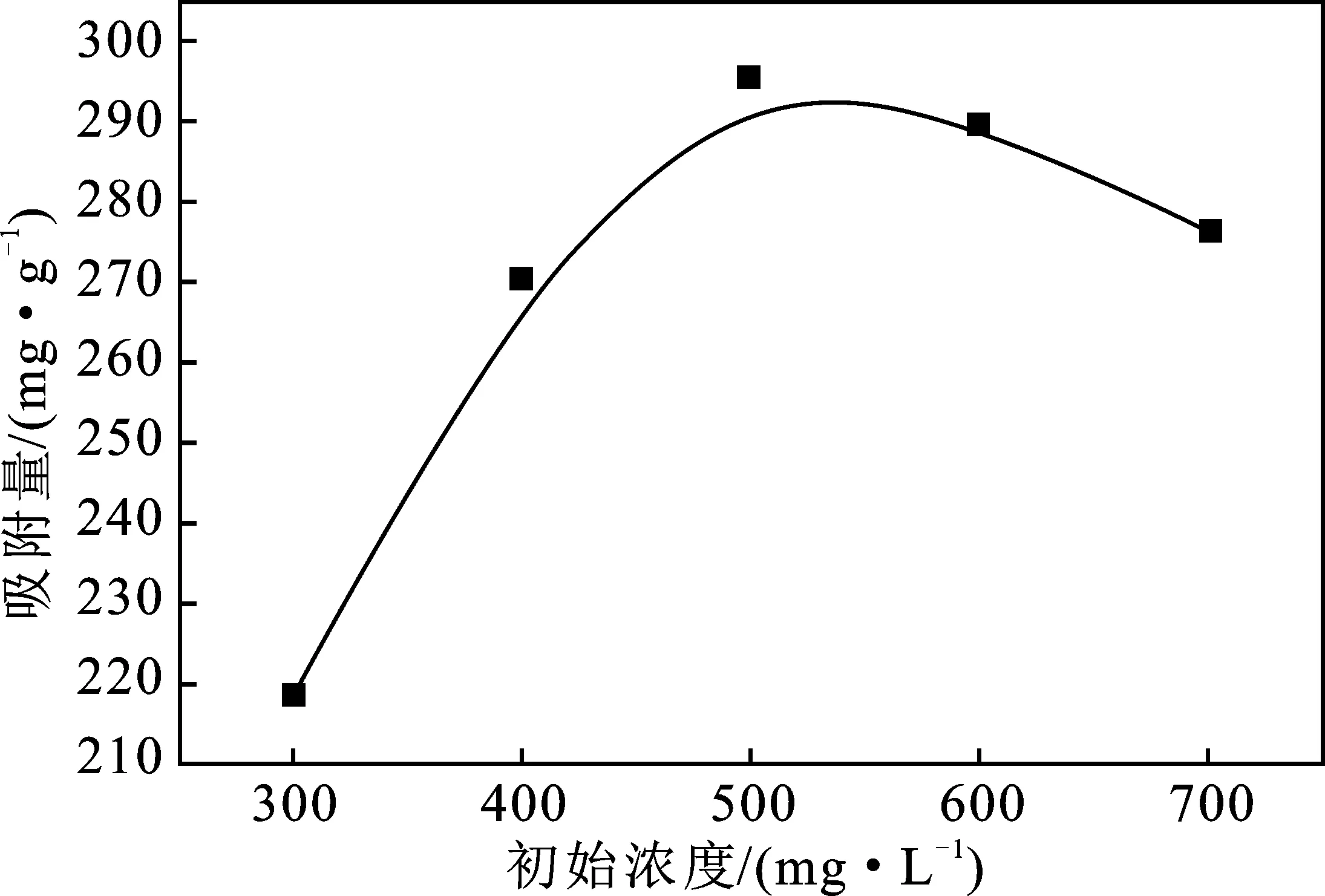
图5 MB溶液的浓度对XSBACH吸附量的影响Fig.5 The effect of initial MB concentration on adsorption capacity of XSBACH
由图5可知,在300~500 mg/L的浓度之间,吸附量随着浓度的增加呈上升趋势,是因为开始吸附的时候XSBACH的吸附点数量多于MB溶液的数量,因而导致吸附量一直增加。当溶液的浓度到500 mg/L时,吸附量最大,为295.36 mg/g,而当溶液的浓度超过500 mg/L时,吸附量不再增加,反而有下降的趋势,这是由于MB分子占满了XSBACH的接触位点,吸附量不再增加。
2.3.2 pH值对吸附性能的影响 吸附时间为120 min,MB初始浓度为500 mg/L,温度为30 ℃,XSBACH的投加量为0.05 g时,溶液的pH值对XSBACH吸附量的影响见图6。
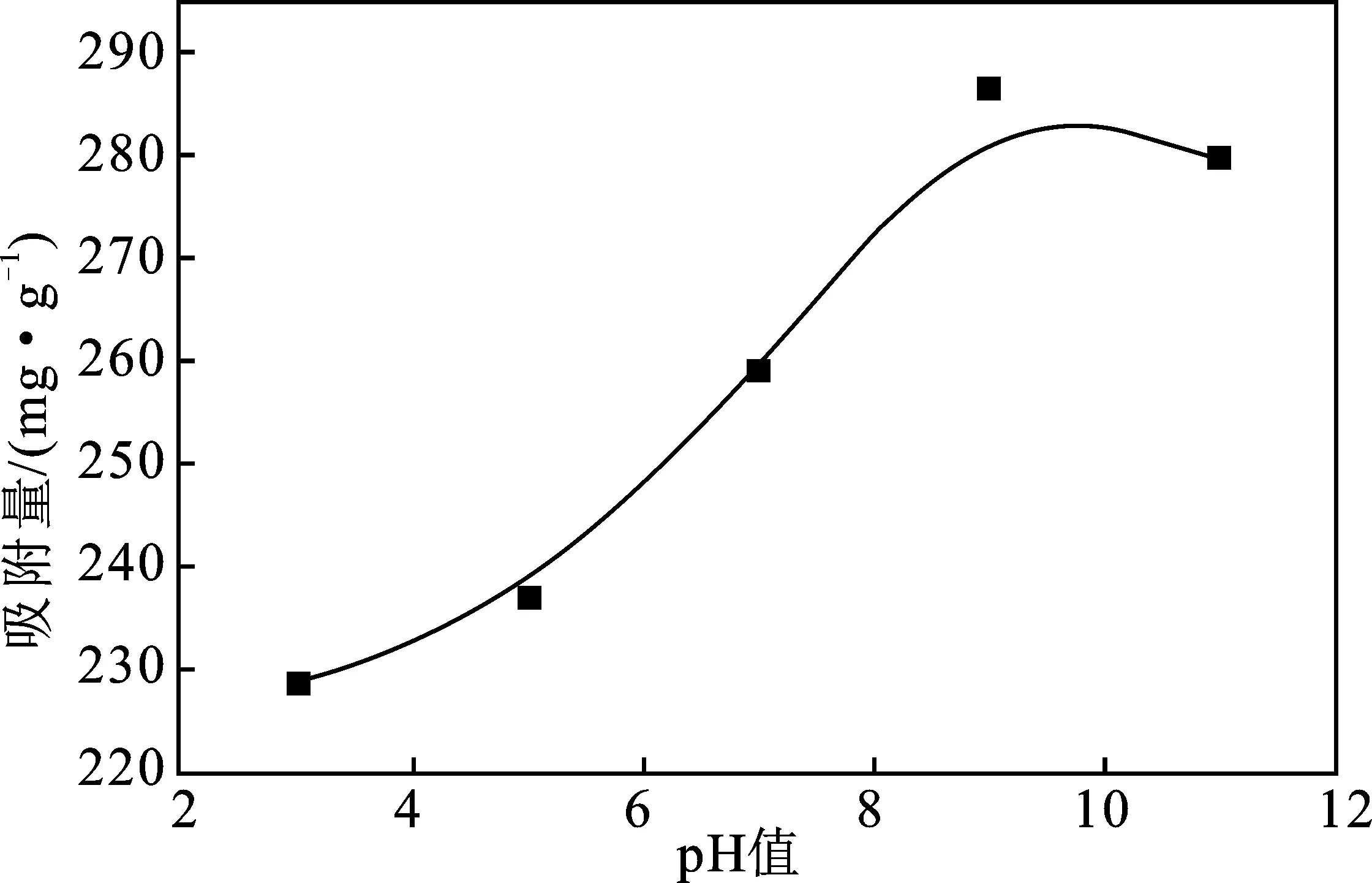
图6 pH值对XSBACH吸附量的影响Fig.6 The effect of pH values on adsorption capacity of XSBACH
由图6可知,在pH值<9时,吸附量随着pH值的增加而增大,是因为XSBACH的功能基团在酸性条件下通过释放氢离子去质子化,带负电荷的位点越来越多,促进了MB的吸附[11]。当pH=9时,吸附量达到最大,为286.73 mg/g,继续增加溶液的pH值,吸附量下降。这是因为当溶液pH值超过9以后,碱性增强,XSBACH的功能团发生电离,与带正电的MB静电排斥,抑制了吸附,吸附量就会有一定程度的下降。
2.3.3 温度对XSBACH吸附性能的影响 吸附时间为120 min,初始浓度为500 mg/L,XSBACH的投加量为0.05 g时,温度对XSBACH吸附量的影响见图7。
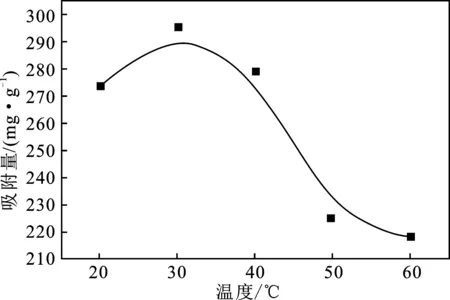
图7 温度对XSBACH吸附性能的影响Fig.7 The effect of temperature on adsorption capacity of XSBACH
由图7可知,在温度为30 ℃的时候,吸附量最大,为295.36 mg/g。温度高于30 ℃以后,随着温度的上升,吸附量一直往下降,说明最佳反应温度为30 ℃。温度上升,吸附量就下降,这是由于XSBACH吸附MB是一个放热反应,温度越高,就越会抑制吸附反应的进行。
2.3.4 时间对吸附性能的影响 MB溶液浓度为500 mg/L,温度为30 ℃, XSBACH的投加量为0.05 g 时,MB溶液的吸附时间对XSBACH吸附量的影响见图8。
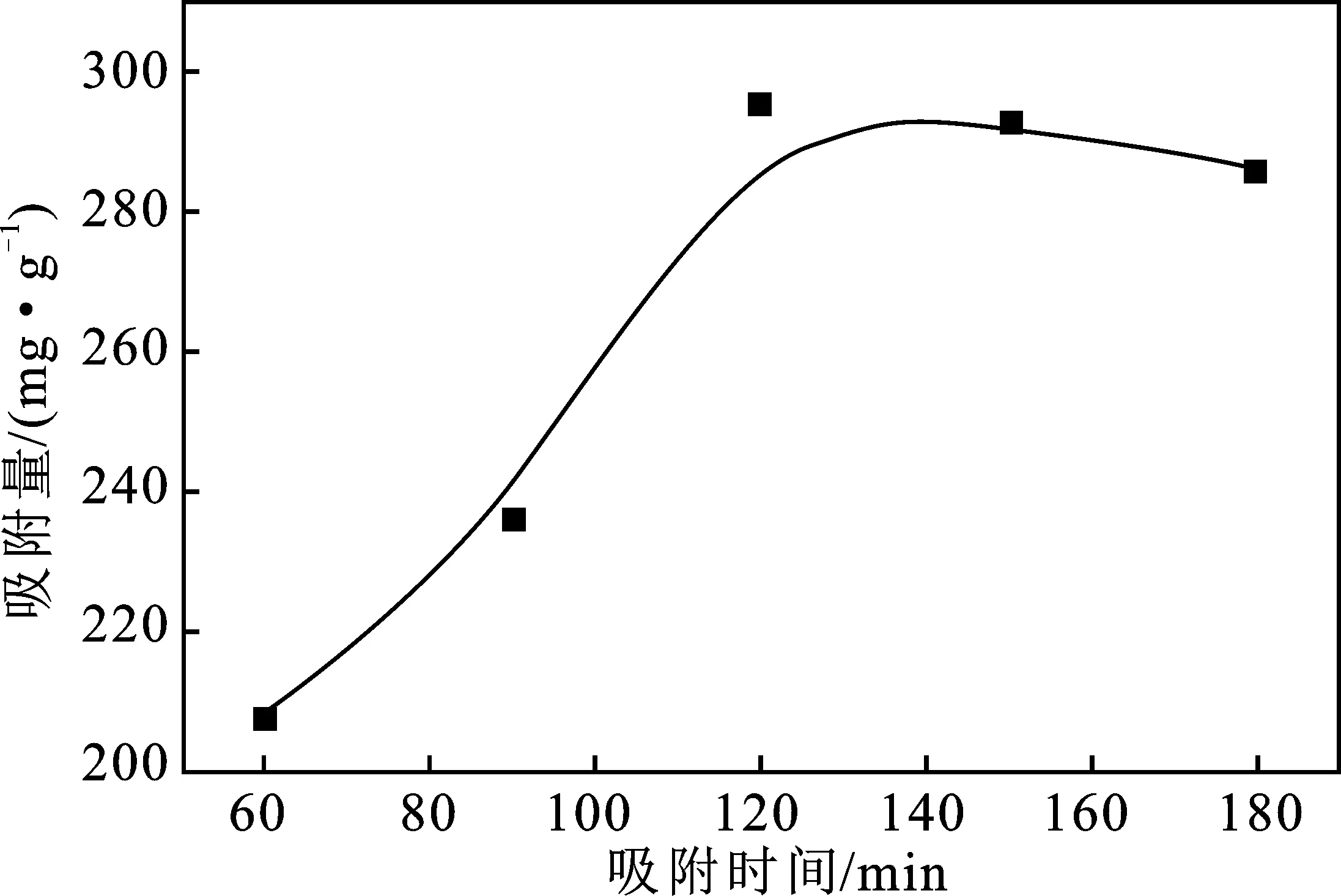
图8 时间对XSBACH吸附性能的影响Fig.8 The effect of time on adsorption capacity of XSBACH
由图8可知,在120 min之前,吸附强度随着反应时间的增加而上升,这是因为此时的XSBACH的表面大量的吸附点还没有被覆盖,因而吸附点与MB溶液的接触面积也比较大,触碰概率也较大,所以造成了吸附量随着吸附时间的增大而增大。在吸附时间超过120 min以后,吸附量有些下降,吸附点吸附了大量的MB溶液以后,吸附点剩下不多,吸附的速度也会下降,在120 min左右时,吸附接近饱和状态,所以延长吸附时间,吸附量的变化不大。
2.4 吸附动力学
分别运用(式2~4)动力学模型描述XSBACH吸附MB的速率快慢[12-13],通过动力学模型对动力学数据进行拟合,研究其吸附机理,见图9和图10,动力学参数见表1。

表1 XSBACH吸附MB溶液的动力学参数Table 1 Kinetic parameters on adsorption of MB by XSBACH
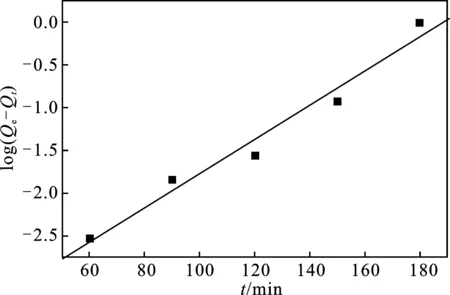
图9 XSBACH吸附MB的伪一级动力学模型Fig.9 Pseudo-first-order adsorption kinetic equations of MB by XSBACH
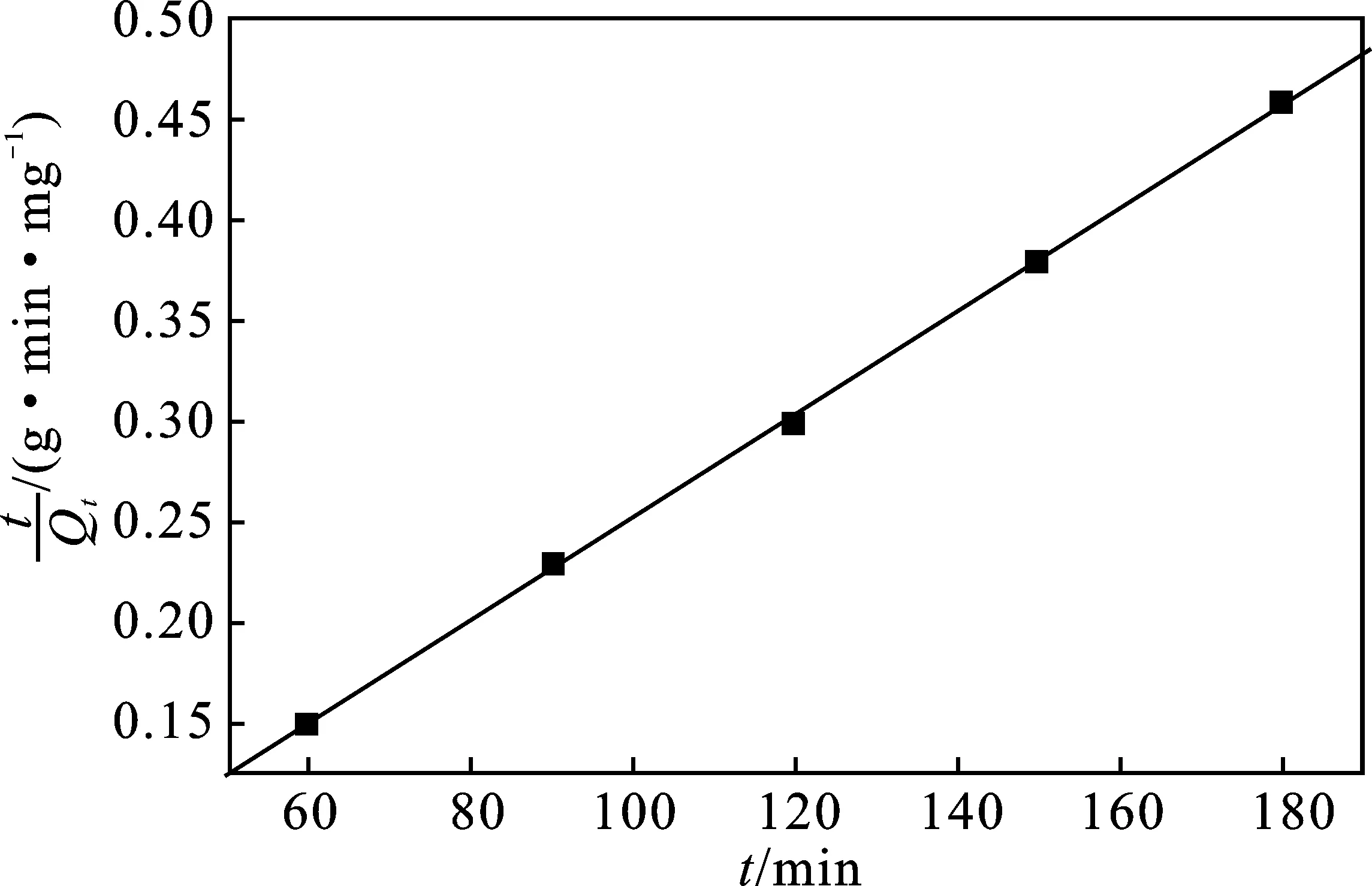
图10 XSBACH吸附MB的伪二级动力学模型Fig.10 Pseudo-second-order adsorption kinetic equations of MB by XSBACH
伪一级动力学模型:
(2)
伪二级动力学模型:
(3)
粒子内扩散动力学模型:
Qt=Kit0.5
(4)
式中Qe——平衡吸附量,mg/g;
Qt——时间为t时的吸附量,mg/g;
K1——一级动力学速率常数,min-1;
K2——二级动力学速率常数,g/(mg·min);
Ki——粒子内扩散速率常数,mg/(g·min0.5)。
由表1可知,伪一级和伪二级动力学的线性相关系数R2分别是0.985 11和0.999 75,理论吸附量分别为629.39 mg/g和326.95 mg/g,实际吸附量为295.36 mg/g。因此,伪二级动力学的线性相关系数R2最靠近1,理论吸附量和实际吸附量相差也不大。所以,XSBACH吸附MB溶液符合伪二级动力学模型的拟合,得出的结果是属于化学吸附。
2.5 吸附等温线
分别用公式(5)和(6)吸附等温线模型拟合改性XSBACH吸附MB的实验数据[14],拟合曲线见图11、图12。
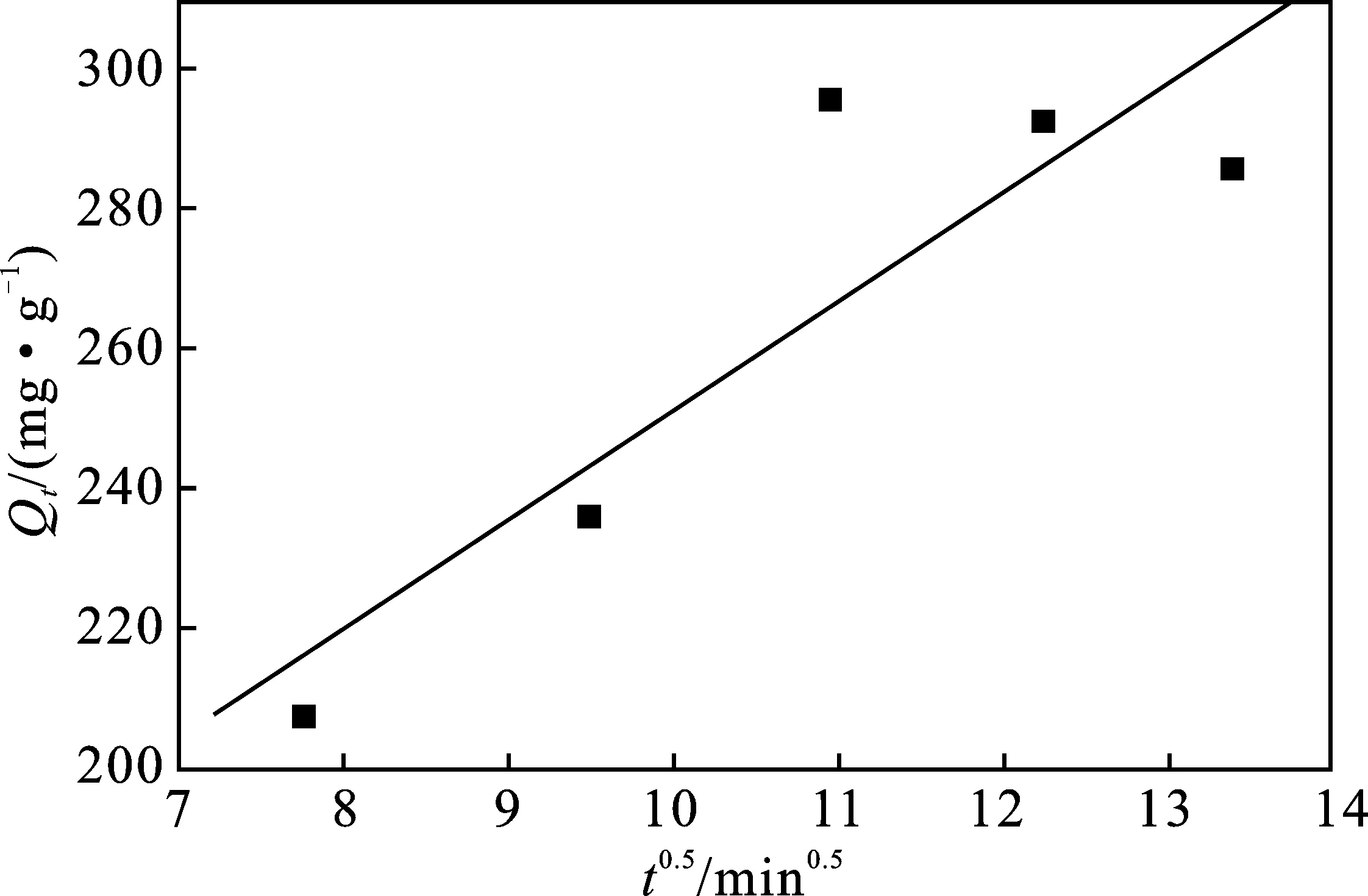
图11 XSBACH吸附MB的粒子内扩散动力学模型Fig.11 Intra particle diffusion kinetic equations of MB by XSBACH
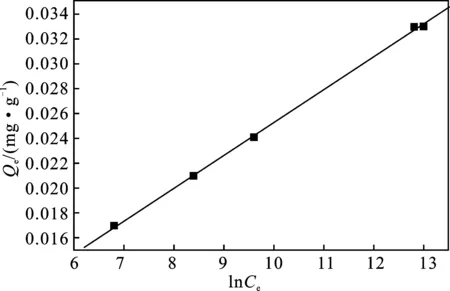
图12 Langmuir吸附等温线Fig.12 The adsorption isothermal curve of Langmuir
Langmuir吸附等温线:
(5)
Freundich吸附等温线:
(6)
式中Ce——液相吸附平衡浓度,mg/L;
Qe——液相平衡吸附量,mg/g;
Qmax——理论最大吸附量,mg/g;
KL——Langmuir常数,L/mg;
Kf、n——常数。
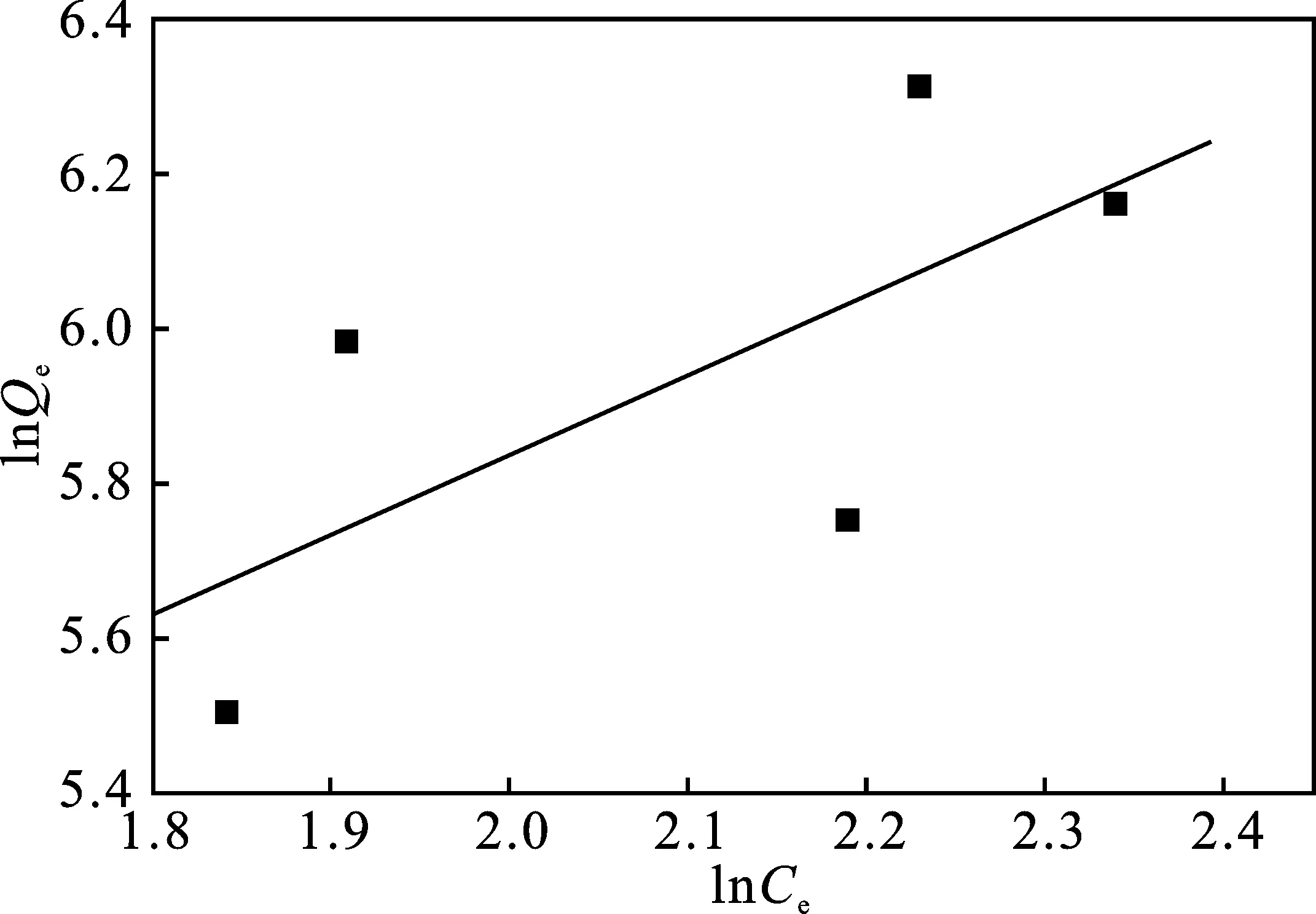
图13 Freundich吸附等温线Fig.13 The adsorption isothermal curve of Freundich
表2是XSBACH吸附MB溶液的Langmuir等温线和Freundlich等温线的相关系数。
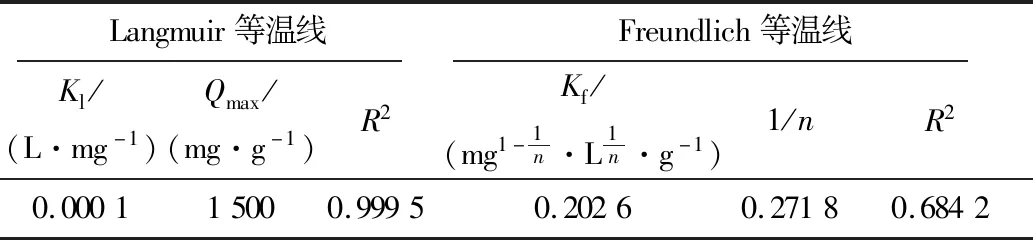
表2 XSBACH吸附MB的等温线参数Table 2 Adsorption isotherm parameters on adsorption of MB by XSBACH
由表2可知,Langmuir等温线和Freundlich等温线的线性相关系数R2分别为0.999 5和0.684 2,经过对比, Langmuir等温线的线性相关系数R2更靠近1,所以XSBACH吸附MB符合Langmuir等温线拟合模型[15]。
2.6 吸附热力学参数
利用公式(7)~(9)计算吸附热力学参数,计算公式如下:
(7)
ΔG°=-RTlnK
(8)
K=Qe/Ce
(9)
式中ΔG°——吉布斯自由能,kJ/mol;
ΔH°——反应焓,kJ/mol;
ΔS°——吸附熵,J/(mol·K);
T——吸附温度,K;
R——理想气体常数,8.314×10-3kJ/(mol·K)。
由表3可知,ΔH°<0,说明XSBACH吸附MB过程是个放热反应;ΔG°<0,表明溶液中的MB容易被吸附在XSBACH表面,XSBACH吸附MB是自发进行的,ΔS°<0,说明在反应过程中,XSBACH和MB溶液界面上分子运动的无序性下降。因此可得出,XSBACH吸附MB是一个自发放热熵减的过程。

表3 XSBACH吸附MB的热力学参数Table 3 Thermodynamic parameters on adsorption of MB by modified XSBACH
3 结论
(1)通过对XSBACH 和XSBAC的FTIR、BET表征分析,结果表明XSBACH相比于XSBAC表面引入了一些新的官能团,吸收峰数目增多,促进XSBACH表面极性的减弱,有利于吸附。XSBACH的表面结构类似于碳墨结构,孔隙发达,吸附能力较强。
(2)XSBACH吸附有机染料MB的结果可得,当反应时间达到120 min时,MB溶液的浓度为500 mg/L,吸附温度为30 ℃,XSBACH的加入量为0.05 g时,XSBACH吸附MB的吸附量最大为295.36 mg/g。
(3)吸附动力学和等温线模型显示:XSBACH对MB的整个吸附过程符合伪二级动力学和Langmuir吸附等温线模型,是个自发进行的放热熵降低反应。
