参金止痢口服液对腹泻哺乳仔猪肠道微生物菌群影响的差异性分析
2021-07-19丁俊仁李思聪李旭廷范景胜
涂 腾,丁俊仁,3*,李思聪,魏 勇,李旭廷,杨 锐,梁 歌,范景胜
(1.四川省畜牧科学研究院,成都 610066;2.动物遗传育种四川省重点实验室,成都 610066;3.四川省畜牧总站,成都 610066)
1 材料与方法
1.1 试验药物及检测试剂 参金止痢口服液是由党参15 g、金银花 10 g、干姜 10 g、半夏 15 g、藿香 10 g、甘草 10 g、茯苓 10 g、陈皮 10 g 和白术 10 g 加水煎煮,制成每1 g含原生药3.2 g的提取物后,再用纯化水配成浓度为3.2 g生药/mL的药液(达到最大可抽吸浓度),由四川省畜牧科学研究院自制。IL-1β、IL-6、TNF-α所用ELISA试剂盒均购自南京建成生物工程研究所。
1.2 试验动物与试验设计 选用7~15日龄体重相近的“杜×长×大”三元杂交仔猪共计9头,其中自然染毒并带有腹泻症状的哺乳仔猪6头,所有仔猪均选自东河牧业有限公司猪场,以3头为一组随机将其分为两组,分别是腹泻空白组(FXK)和腹泻中药组(FZ),另选3头健康仔猪作为健康空白组(JK),三个组同时进行处理,FZ组灌服参金止痢口服液,给药量为4 mL/头,灌胃给药,每天两次,连续灌胃5 d,FXK组及JK组则灌胃相应剂量的生理盐水(4 mL/头),每天两次,连续灌胃5 d。
1.3 试验动物饲养管理 实验开始前对猪舍、料槽及水槽均进行全面消毒,对实验仔猪采取分舍饲养措施,每组单独一栏饲养,每一栏哺乳母猪均健康且体况相近,保持猪舍温度正常恒定,并按常规程序进行免疫和驱虫,自由采食和饮水。
1.4 实验样品采集 在对仔猪给药后的第8天对各组进行采样,用注射器从颈静脉采取新鲜血液10 mL装入15 mL 灭菌指形管,37 ℃恒温箱内静止1 h,然后置于4 ℃冰箱后过夜,而后4 ℃,3000 r/min离心10 min,分离血清,分装成小份后储藏在-20 ℃,用于分析血液抗体及细胞因子水平。采血完毕后,将仔猪采用颈静脉放血的方法处死然后立即打开腹腔,迅速结扎并分离出结肠,在结肠中段各取10 g左右食糜,装入15 mL 灭菌指形管中并迅速放入-80 ℃冰箱中进行超低温保存,用于后续的肠道菌群测序。
1.5 血清中抗体及细胞因子水平的测定 血清中IgG和IgM浓度应用全自动生化分析仪根据使用说明书进行测定;血清中细胞因子IL-1β、IL-6、TNF-α应用ELISA试剂盒根据相应使用说明书进行测定。
1.6 结肠微生物总DNA抽提及PCR扩增测序 对超低温保存以待测序的样本严格按照粪便基因组DNA提取试剂盒说明书对各样本的总DNA进行抽提,抽提完成后采用Nanodrop及1.2%琼脂糖凝胶电泳检测对抽提出的DNA进行质检。
质检合格的DNA样本利用前端引物338F 5'-ACTCCTACGGGAGGCAGCAG-3', 806R 5'-GGACTACHVGGGTWTCTAAT-3'采用全式金公司的Pfu高保真DNA聚合酶对细菌16S rRNA的V3-V4可变区进行PCR扩增,在扩增样本中设置阴性对照,扩增完毕后对PCR扩增产物进行1.2%琼脂糖凝胶电泳检测,若样品条带清晰且阴性对照未出现条带则质检合格,可作为测序样本。检测合格后的测序样本根据Illumina MiSeq测序平台(Illumina 公司,美国)的标准操作流程进行建库测序,原始数据上传到NCBI数据库中。
根据目标大桥所采用的悬挂导向机构的悬挂油缸参数可知,油缸的行程为50 mm,因此,悬挂系统的适应高度差为50 mm,满足悬挂导轨不平度±25 mm的要求.
1.7 测序结果分析 将测序所得的原始序列数据进行质控和过滤,对过滤后的数据(OTU)进行聚类和物种分类学以及物种组成分析、Alpha/Beta多样性分析,并采用LEfSe分析比较各分组肠道菌群在物种分类水平上的差异。
1.8 数据处理和统计分析 实验数据均采用SPSS 22.0软件进行处理,采用单因素方差进行分析,所有数据均以平均值±标准差(X±S)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 参金止痢口服液对哺乳仔猪血清免疫指标的影响 由表1可知,三个组在IgG的含量上,FXK组显著低于FZ组和JK组(P<0.05),在IgM的含量上,FXK组显著高于FZ组和JK组(P<0.05),在IL-1β的含量上,FXK极显著高于FXZ和JK(P<0.01),IL-6含量上,FXK组极显著高于FZ组(P<0.01),显著高于JK组(P<0.05),TNF-α含量上,FXK组极显著高于FZ组和JK组(P<0.01)。

表1 参金止痢口服液对哺乳仔猪血清免疫指标的影响Tab 1 The effect of Shenjin Zhili Oral Liquid on Serum immune index of suckling piglets
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),无字母表示差异不显著(P>0.05)。下同。
2.2 参金止痢口服液对哺乳仔猪肠道微生物菌群的影响
2.2.1 测序样品16S RNA高通量测序结果 测序结果表明,样品平均有效序列条数为51171条,有效序列占测序序列总条数的90%以上(表2)。序列长度分布在350~440 bp内,其中长度在430 bp的序列最多,序列长度分布情况与16S rDNA V3-V4序列长度相吻合,说明测序效果较理想,可用于后续分析。
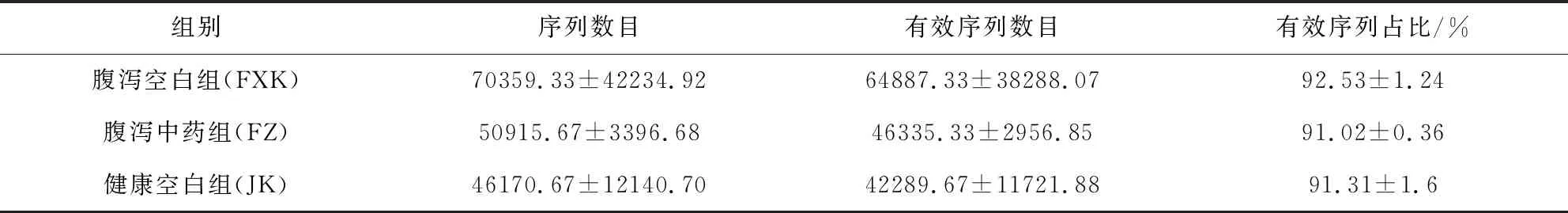
表2 样本测序序列情况统计表Tab 2 Sample sequencing sequence statistics table
2.2.2 OTUs分析及物种注释 Venn图显示不同组之间共有及特有的OTUs个数,如图1 A所示,三个组共鉴定出3898个OTU,其中三个组共有的OTU共72个,占1.85%;FZ组和FXK组共有的OTU共59个,占1.51%;FZ组和JK组共有的OTU共147个,占3.77%;JK组和FXK组共有的OTU共63个,占1.62%;说明各组间菌群类别差异较大,从各组总体及各自特有的OTU数量上看,FXK组较另外两组显著降低,而FZ组和JK组则较为接近,说明腹泻可影响哺乳仔猪肠道菌群的结构,造成菌群多样性降低,而参金止痢口服液可在一定程度上维持腹泻仔猪的肠道菌群结构及多样性趋于正常水平。
2.2.3 菌群 α 多样性分析 α多样性反映的是单个测序样本自身内部的微生物物种多样性情况。其中Alpha指数稀释曲线用来表示不同测序深度样本的物种丰富程度,当曲线趋于平缓时表明此时的测序深度已基本覆盖了测序样本的所有物种,可反映该样本的总OTU数。由图1 B所示,三组样本的曲线随着本实验测序深度的增加都分别先后出现了明显的转折点并随后趋于平缓,说明本实验深度充分,能反映各样本的总OTU数。
Coverage指数是指各测序样品的文库覆盖率,本实验各组测序样本中的文库覆盖率均在0.95以上,说明样本中未被测出序列的概率较低。Observed species指数反映所测序样品所含的物种数目,Chao1指数反映样本所含OTU数目指数,Shannon指数及Simpson指数均反映样本所含物种多样性及分布均匀度,以上指数数值越大表明样品物种多样性越高,其中Shannon指数越大说明各物种分布越均匀, 本实验中,FZ组、JK组的Observed species、Chao1、Shannon及Simpson指数(表3)均较FXK组均呈升高趋势。
丰度等级曲线(Rank abundance)用以表示被测序物种的丰度和均匀度,曲线的水平宽度表示物种的丰富度,而曲线下降的平滑程度则反映物种的均匀度。由图1 C可知所测样本的曲线水平宽度较宽且下降趋势较平缓,说明测序样本中物种的丰富度和均匀度均较合理。

表3 各组仔猪肠道菌群多样性指数Tab 3 Diversity index of intestinal flora of piglets in each group
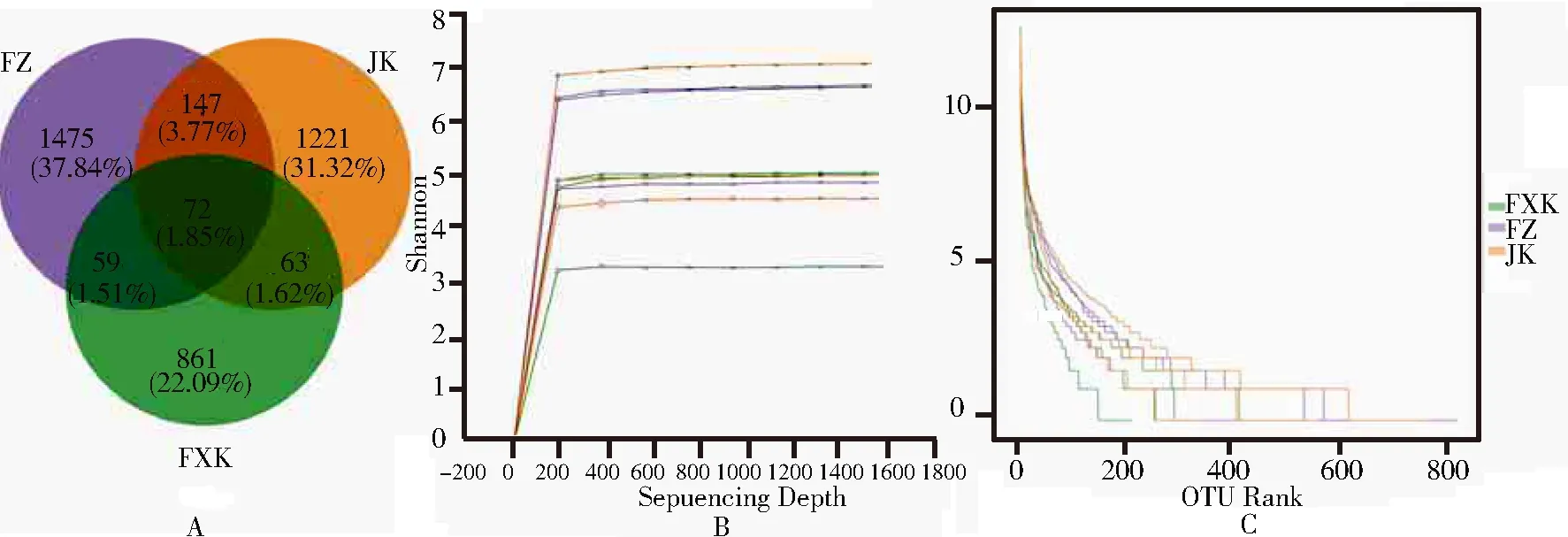
图1 肠道菌群OTUs分析及α多样性分析(A.Venn图;B.Alpha指数稀释曲线;C.丰度等级曲线)Fig 1 OTUs analysis and α diversity analysis of intestinal flora(A.Venn diagram;B.Alpha Exponential Dilution Curve;C.Abundance Rating Curve)
2.2.4 菌群β多样性分析 β多样性反映的是不同测序样本之间的微生物物种多样性情况。本实验同时采用主成分分析(PCA)、主坐标分析(PCoA)和非度量多维尺度分析(NMDS)进行分析。通过PCA和PCoA分析结果显示,3组的菌群结构差异明显(图2 A,B)。而NMDS分析可通过点与点的距离体现样本之间的差异大小,结果表明3个组之间样本的肠道菌群构成有明显差异(图2 C)。
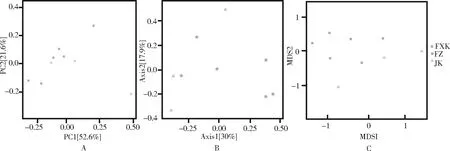
图2 肠道菌群β多样性分析(A.主成分分析(PCA);B.主坐标分析(PCoA);C.非量度多维尺度分析(NMDS))Fig 2 Analysis of β diversity of intestinal flora(A.Principal component analysis (PCA);B.Principal coordinate analysis (PCoA);C.Analysis of non-metric multi-dimensional scaling(NMDS))
2.2.5 肠道微生物菌群结构分析 门水平上,3个组共检测出12个菌门,由图3可知,仔猪肠道中排名前十的优势菌门分别是厚壁菌门(Firmicutes,43.9%)、拟杆菌门(Bacteroidetes,19.44%)、变形菌门(Proteobacteria,18.06%)、梭杆菌门(Fusobacteria,12.97%)、疣微菌门(Verrucomicrobia,3.05%)、螺旋体门(Spirochaetes,1.96%)、互养菌门(Synergistetes,0.24%)、放线菌门(Actinobacteria,0.20%)、黏胶球形菌门(Lentisphaerae,0.008%)、蓝菌门(Cyanobacteria,0.004%),以上菌门占总菌门的99%以上。

图3 门水平上的肠道微生物相对丰度Fig 3 Relative abundance of intestinal microbes at the phylum level
组间存在显著差异的菌门有拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)(表4),其中拟杆菌门FXK组显著低于FZ组(P<0.05),而变形菌门FXK组显著高于FZ组(P<0.05),极显著高于JK组(P<0.01)。
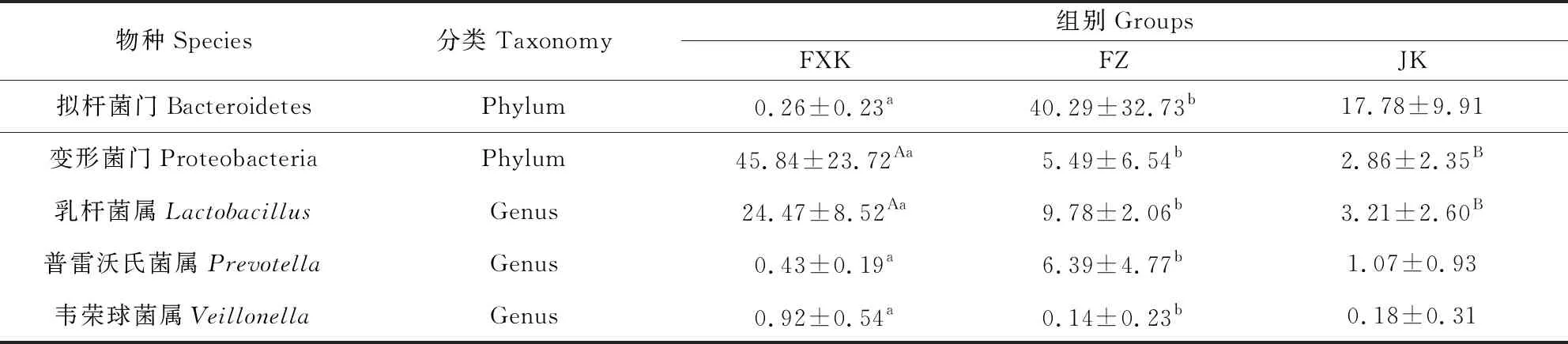
表4 各组间差异显著菌群的相对丰度(%)Tab 4 The relative abundance of the significant differences on intestinal flora between the groups
属水平上,仔猪肠道中前20位的优势菌属分别为乳杆菌属(Lactobacillus,12.49%)、瘤胃球菌属(Ruminococcus,7.31%)、梭杆菌属 (Fusobacterium,5.42%)、拟杆菌属(Bacteroides,4.67%)、颤螺菌属(Oscillospira,3.86%)、阿克曼氏菌属(Akkermansia,3.05%)、普雷沃氏菌属(Prevotella,2.49%)、考拉杆菌属 (Phascolarctobacterium,2.13%)、密螺旋体属(Treponema,1.95%)、瘤胃球菌([Ruminococcus],1.84%)、多雷亚菌属(Dorea,1.42%)、链球菌属(Streptococcus,1.05%)、罗斯氏菌属(Roseburia,0.96%)、副拟杆菌属(Parabacteroides,0.90%)、丁酸弧菌属(Butyricimonas,0.64%)、韦荣球菌属(Veillonella,0.41%)、梭菌属(Clostridium,0.40%)、SMB53属(0.39%)、布劳特氏菌属(Blautia,0.32%)、脱硫弧菌属(Desulfovibrio,0.32%),以上菌属占总菌属的比例为52.02%(图4)。三组间存在显著差异的菌属共83种,其中属于排名前20的优势菌属共3种(表4),除普雷沃氏菌属属于拟杆菌门外,乳杆菌属及韦荣球菌属均属于厚壁菌门。
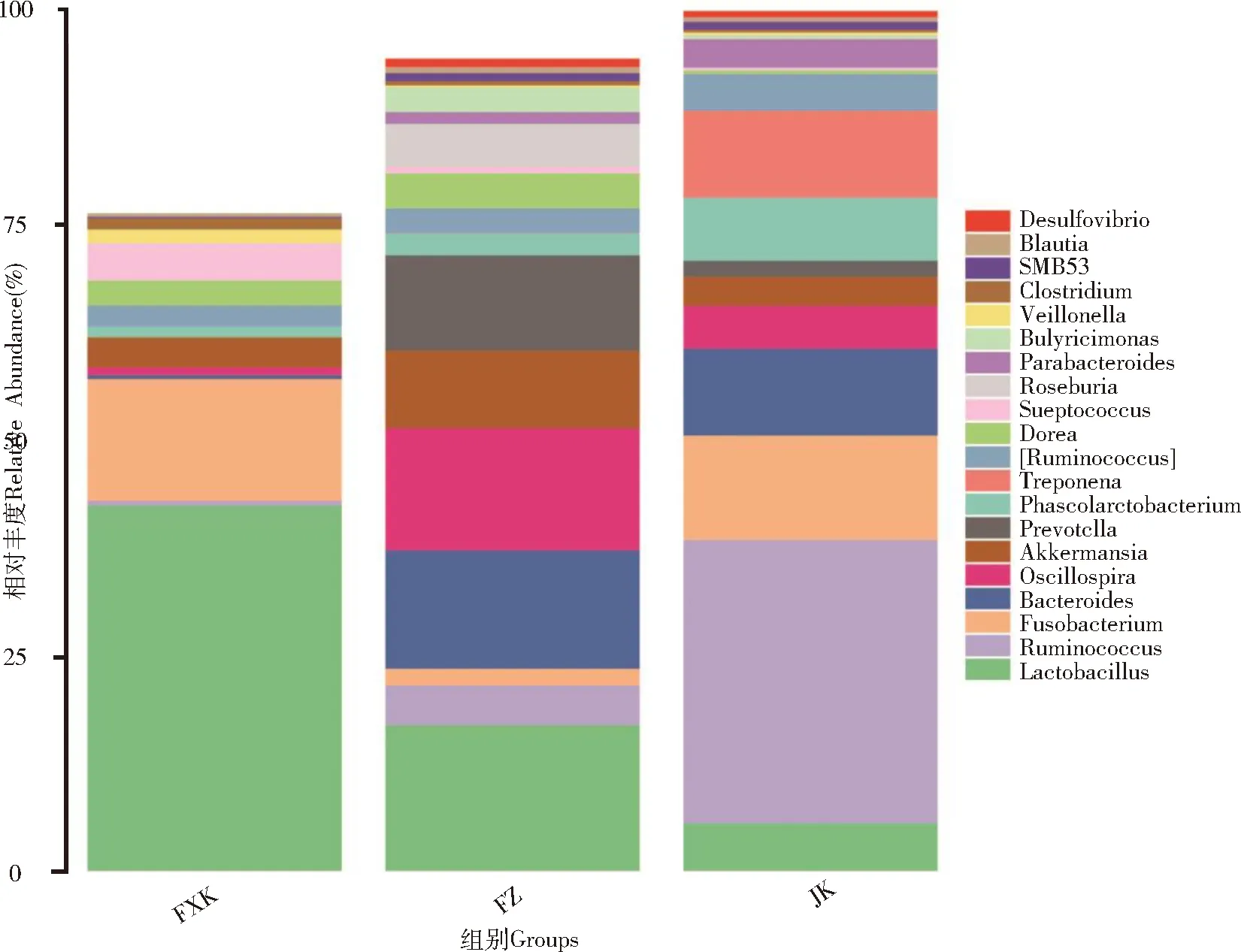
图4 属水平上的肠道微生物相对丰度Fig 4 Relative abundance of intestinal microbes at the genus level
2.2.6 肠道微生物菌群差异分析 为了进一步探究对组间菌群结构具有显著影响的菌群,对各组样本进行了LEfSe分析,该分析可实现多个分组间差异的比较,从而筛选出在丰度上具有显著差异的菌种。LDA score柱状图展示了LDA值大于设定值(本实验默认为2)的物种,结果显示(图5),FZ组在Prevotella(普氏菌属)、Coprococcus(粪球菌属)丰度较高,FXK组在Bacilli(芽孢杆菌纲)、Lactobacillus(乳杆菌属)、Collinsella(柯林斯氏菌属)、Shigella(志贺氏杆菌属)丰度较高。
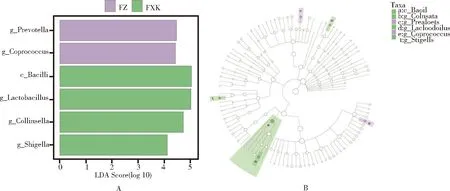
图5 各组肠道菌群的LEfSe分析图Fig 5 LEfSe chart of each group of intestinal flora
3 讨论与结论
仔猪腹泻是现代养猪业较为常见的疾病,其发病率高、发病原因复杂、发病后死亡率高,对养猪业影响较大。参金口服液组方源自“半夏藿香汤”,具有芳香化湿、和胃止呕之功效,用于脾胃不和与霍乱吐泻之症,前期临床治疗研究结果已表明其对治疗仔猪腹泻的药物有效率较高,具有较好的防治效果[3-4]。
IgG、IgM是机体内主要的免疫球蛋白,由活化的B淋巴细胞产生,可反映机体体液免疫状况。其中,IgG是血清中含量最高的免疫球蛋白,约占整个血清免疫球蛋白含量的70%~75%,在抗细菌、抗毒素和抗病毒中起着的主要作用,IgM 是活化B细胞受抗原刺激后产生的最早的免疫球蛋白,在机体初期体液免疫中起着重要作用[5-6]。本研究中,腹泻中药组(FZ)的IgG含量显著高于腹泻组,说明参金止痢口服液显著提高了腹泻仔猪肠道中IgG的含量水平,而IgM在腹泻组(FXK)的含量显著高于腹泻中药组(FZ)和健康空白组(JK),可能是因为腹泻组的IgM并未进行病原清除,因而其浓度并未发生显著变化,而治疗组和空白组的IgM均进行了体内病原的清除,因而浓度随清除作用迅速下降,其具体机制还需进一步探究[7-8]。IL-1β、IL6、TNF-α均属于促炎因子,在炎症的发生及发展进程中起着重要作用,本研究中治疗组IL-1β、IL6、TNF-α含量均较腹泻组显著降低并趋近于正常值,说明参金止痢口服液参与并调节了腹泻仔猪的炎性因子水平。
α多样性分析可反映单个测序样本自身内部的微生物物种多样性情况,其中α指数稀释曲线可表示不同测序深度情况下样本的物种丰富程度,当曲线趋于平缓时说明测序深度已基本覆盖样本所有物种,本研究中三组样本均先后出现了较平缓的曲线,说明三组样本测序深度均充分,能反映各样本总OTU数。Coverage指数指各测序样品的文库覆盖率,本研究中各组均为0.95以上,说明未被测出序列较少,序列可靠程度高。而Observed species指数反映测序样品所含物种数目,Chao1指数反映样本所含OTU数目指数,Shannon指数及Simpson指数均反映样本所含物种多样性及分布均匀度,以上指数数值越大表明样品物种多样性越高,通过对比发现,本研究中腹泻空白组(FXK)肠道菌群多样性较健康空白组(JK)低,这与Hermann-Bank等的报道一致[9]。而腹泻中药组(FZ)的多样性较健康空白组(JK)和腹泻空白组(FXK)高,可能是因为参金止痢口服液在一定程度上提高了腹泻仔猪的肠道菌群多样性。β多样性分析可反映不同测序样本之间的微生物物种多样性情况,本研究采用主成分分析(PCA)、主坐标分析(PCoA)和非度量多维尺度分析(NMDS)进行分析,结果表明,三个组之间肠道菌群结构具有较为明显的差异,且FXK组较FZ组和JK组差异更显著,说明参金止痢口服液可能参与调节腹泻仔猪肠道菌群结构,从而发挥治疗腹泻的作用。
肠道微生物群落结构分析表明,在门水平上,三个组厚壁菌门、拟杆菌门,变形菌门占了总菌群相对丰度的80%以上,为主要优势菌群,这与Chen 等[10]的研究一致,Bin P等[11]研究发现,相比正常仔猪,腹泻仔猪肠道中拟杆菌门的相对丰度较低,而Liu C S等[12]发现,腹泻仔猪肠道中变形菌门相对丰度增加而拟杆菌门相对丰度降低。本研究发现FZ组仔猪肠道拟杆菌门相对丰度显著高于FXK组,变形菌门相对丰度显著低于FXK组,而FZ组与JK组之间拟杆菌门及变形菌门的相对丰度差异均不显著。这些结果说明,参金止痢口服液可以调节腹泻仔猪肠道中某些菌门的相对丰度,使相对丰度趋近于正常。
属水平上存在显著差异的菌属有三种,分别是乳杆菌属(Lactobacillus)、普雷沃氏菌属(Prevotella)以及韦荣球菌属(Veillonella),乳酸菌是一种常用的益生菌,在肠道中起着与肠道中病原菌竞争肠粘膜结合位点,抑制肠道中病原体、维持肠道正常菌群的作用[13],有研究表明,乳杆菌属能降低仔猪的腹泻率[14],本研究中乳杆菌属在FXK组的相对丰度显著大于FZ组,与JK组差异不显著,而汪群[15]等研究也发现腹泻仔猪肠道中乳杆菌属的相对丰度显著高于健康仔猪,与本研究结论一致。先前的研究发现,韦荣球菌属的丰度在感染流行性腹泻仔猪的肠道中上调显著,属于感染流行性病毒腹泻仔猪肠道中的优势菌群[16-17]。De等[18]发现在非洲儿童中利用普氏菌属抑制致病性志贺氏菌属可降低胃肠道疾病及腹泻的发病率。本研究发现,FXK组仔猪韦荣球菌属的丰度显著高于FZ组,而FZ组和JK组无显著差异,FZ组普氏菌属丰度显著高于FXK组,而FZ组和JK组无显著差异,说明参金止痢口服液可能通过调节肠道中某些菌群的结构从而抑制了腹泻仔猪肠道中某些有害菌的增殖。
本研究采用LEfSe(LDA effect size)分析在各组之间具有显著差异的贡献菌及类型,结果表明,FXK组发现4个分类群,分别为志贺氏菌属、柯林斯菌属、芽孢杆菌纲和乳杆菌属,有报道表明致病性的志贺氏杆菌可造成仔猪腹泻,推测志贺氏杆菌可能是造成仔猪腹泻的潜在病原菌[19-20]。乳杆菌属属于芽孢杆菌纲,其可调节肠道菌群的平衡,并通过乳酸发酵刺激宿主免疫系统,产生细菌素,调节肠道pH从而影响宿主健康[21],本研究腹泻组肠道中乳杆菌属丰度较治疗组和空白组更高,该结论与汪群等的结论一致[15],柯林斯氏菌属被发现在腹泻的猫肠道中丰度增加显著,该菌被证实在哺乳动物炎症性肠病的治疗中有良好的效果[22-23],以上菌属丰度的升高可能是由于这两种菌在腹泻仔猪肠道中起到了保护和调节作用,具体机制还有待进一步研究。FZ组发现两个分类群,分别为Coprococcus(粪球菌属)和Prevotella(普氏菌属),Kang等[24]发现在健康儿童肠道中普氏菌属与志贺氏菌属的丰度呈负相关,本研究FZ组肠道中普氏菌属相对丰度显著高于FXK组,志贺氏菌属含量则低于FXK组,且FZ组这两种菌的相对丰度与JK组仔猪差异不显著。粪球菌属的代谢产物在结肠上皮细胞中起着提供细胞能量供应的作用,同时也参与了肠道免疫调节和肠屏障功能的建立和维持[25],以上菌属丰度的变化可能是由于参金止痢口服液参与调节了腹泻仔猪肠道中某些有益菌属的相对丰度并降低致病菌属的丰度,从而使肠道菌群其趋于正常。
综上所述,参金止痢口服液可能参与调节了免疫相关及炎性相关因子的表达量,同时增加了腹泻仔猪肠道中有益菌拟杆菌门、普氏菌属等的相对丰度,降低了有害菌变形菌门、韦荣球菌属、志贺氏菌属等的相对丰度并调节腹泻仔猪肠道菌群使之趋于正常,从而缓解了仔猪腹泻症状,起到了治疗仔猪腹泻的作用。
