中兽药注册退审原因分析
2021-07-19王学伟刘自扬梁先明董义春苏富琴
王学伟,刘自扬,梁先明,董义春,苏富琴
(中国兽医药品监察所,北京 100081)
新兽药研发周期长、投入大、专业技术性强[1]。由于畜牧业发展的需要以及伴侣动物行业的快速发展,新兽药的研发一直方兴未艾。近年来,我国中兽药的研发质量和水平有一定程度的提高,但面对当前中兽药研发和注册的现状进行冷静思考,可以发现其中尚有许多问题有待挖掘和解决[2]。本文对近年中兽药注册技术评审结论进行回顾性分析,以注册退审原因为切入点,剖析当前中兽药研发和注册评审可能存在的问题,为相关研发注册和评审管理工作提供参考。
1 方 法
1.1 数据来源和统计 查询2016~2020年农业农村部兽药评审中心中兽药注册技术评审意见文件,检索并整理近五年评审结论为“建议退审”的品种。逐个查询上述品种退审的具体原因,并进行分析和归类。对每大类原因和具体原因进行编号。将每个退审品种和其退审原因一一对应后,输入Excel表格,统计各大类原因所涉及的退审品种数量,及其占全部退审品种数量的百分比,分析各大类原因中具体原因的分布情况。通过统计各类退审原因涉及品种的数量及其百分比,直观反映各类退审原因的主次情况,区分主要原因和次要原因。最后,在整体上对中兽药注册退审的原因进行综合分析,总结其中的规律,并探讨其中反映的问题[3]。
1.2 数据整理的相关说明 中兽药注册申请主要包括新兽药注册,具体分为一、二、三、四类,此外还有变更注册和消毒剂注册。本文分析的注册申请涵盖上述三种情况。兽药注册技术评审是一个动态的过程,本文统计的时间为农业农村部兽药评审中心发文时间,范围为2016年1月起至2020年12月止,评审结论为“建议退审”的品种。
2 结 果
2.1 近年中兽药注册申请退审品种情况 2016~2020年中兽药注册评审结论为“建议退审”的品种共56个,主要集中于三类新兽药。具体分布见表1。

表1 近五年中兽药注册申请退审品种情况Tab 1 The number of disapproved traditional veterinary drug registration application
2.2 中兽药注册申请退审原因整理归类通过分析和归纳,退审原因共13大类,37种具体原因。具体情况见表2。

表2 近年中兽药注册申请退审原因Tab 2 Reasons for disapproved traditional veterinary drug registration application

大类原因具体原因主要药效学问题试验设计不合理。如给药方案缺少依据,评价指标不科学,试验与功能主治不相关等。试验结果不支持功能主治。如试验结果无效,缺少支持性试验,未做生物统计等。毒理学问题试验设计不合理。如剂量设计缺乏依据,观测指标不全,观察周期不够等。试验质量控制差。如组织病理图片有误,实验动物不符合要求,试验数据异常等。试验结果不支持安全性。靶动物安全性问题研究不完整。如缺少相关试验或评价指标不全,缺少个体数据等。方法不可靠。如采用仪器进行鸡血细胞分类计数等。用药不安全。组方合理性问题处方化裁依据不充分。处方来源不清,缺少处方筛选试验。处方药味组成与拟定功效不一致。临床定位问题临床定位不清,无法判断预防还是治疗。临床试验与功能主治脱节。功能与主治不对应。研发立题问题缺少临床价值。工艺路线不合理,浪费药材资源。变更理由不合理。中兽医理论符合性问题病例纳入与主治证候不符。主治证候不明确。合规性问题临床试验未取得批件。临床试验受试药未经检验。未按法规提交相应资料。申请人主动撤回
2.3 各类退审原因及分布情况 分别统计各大类原因涉及的退审品种数量、每类退审品种数量占全部退审数量的百分比和每大类原因的具体原因分布情况,以直观反映各种退审原因的主次情况。具体见表3。

表3 近年中兽药注册申请退审品种数量、百分比及具体原因分布Tab 3 The quantity, percentage and specific reason distribution of disapproved traditional veterinary drug registration application
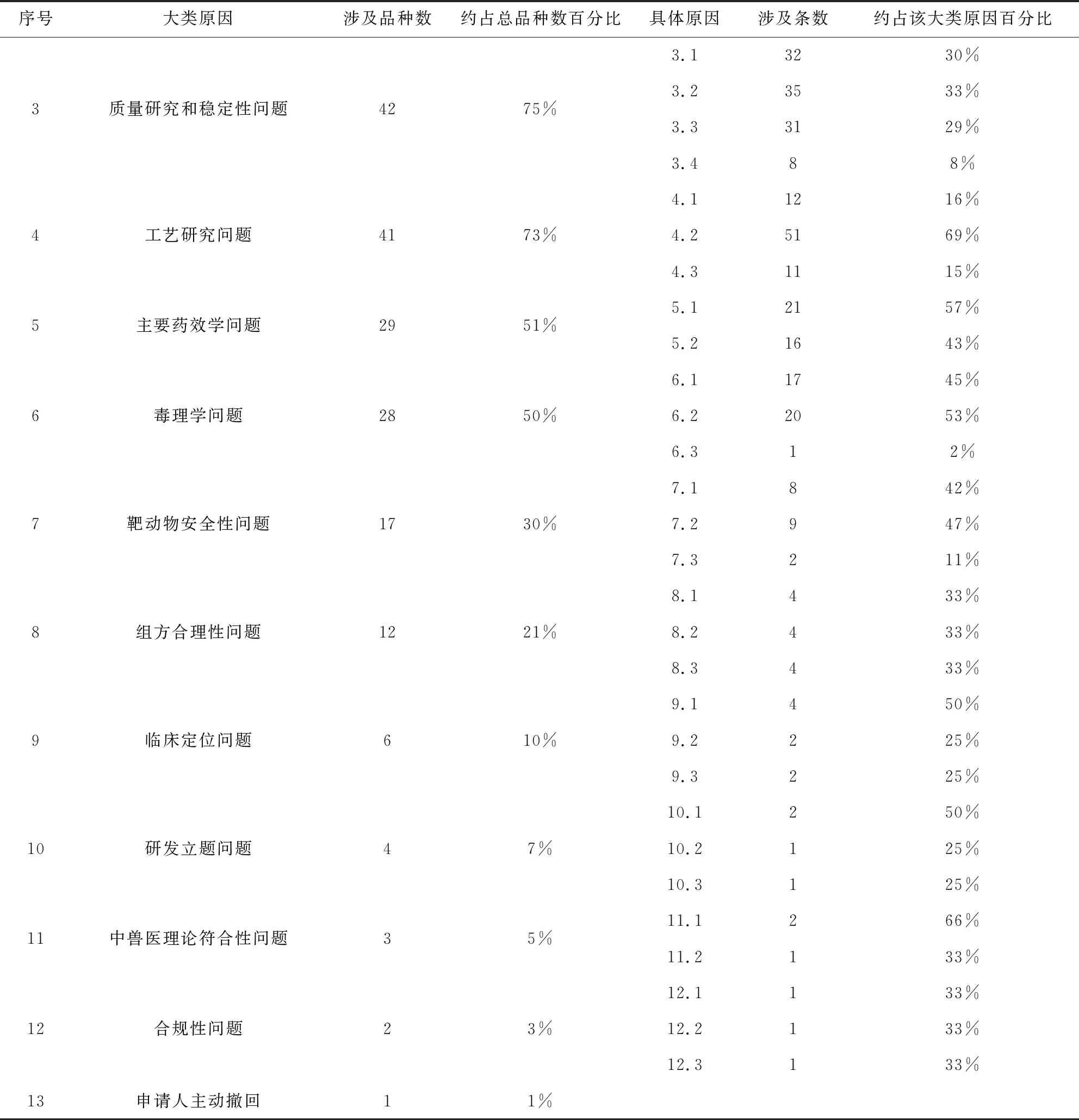
序号大类原因涉及品种数约占总品种数百分比具体原因涉及条数约占该大类原因百分比3质量研究和稳定性问题4275%3.13230%3.23533%3.33129%3.488%4工艺研究问题4173%4.11216%4.25169%4.31115%5主要药效学问题2951%5.12157%5.21643%6毒理学问题2850%6.11745%6.22053%6.312%7靶动物安全性问题1730%7.1842%7.2947%7.3211%8组方合理性问题1221%8.1433%8.2433%8.3433%9临床定位问题610%9.1450%9.2225%9.3225%10研发立题问题47%10.1250%10.2125%10.3125%11中兽医理论符合性问题35%11.1266%11.2133%12合规性问题23%12.1133%12.2133%12.3133%13申请人主动撤回11%
3 分析与讨论
兽药技术评审是综合分析和判读兽药获益风险,并进行技术决策的过程。对一个新兽药注册申请做出退审处理,是基于各种考虑因素,包括药学、药理毒理、临床、生物统计学等专业因素以及政治、经济、文化等社会因素,进行的一种综合判断[4]。在中兽药注册评审过程中,要综合考虑和评判申报品种是否符合中兽医理论、有无临床用药经验以及非临床药效学研究结果是否支持其进入临床试验等因素。如果申报品种与传统中兽医理论的符合度较差,但其有确切的临床用药经验,或者已有非临床药效学研究结果支持其进行临床试验,并且提供了有说服力的临床试验研究资料,此时就不宜依据不符合中兽医理论这个原因做出退审处理[5]。因此,本文中单个品种的退审原因往往同时涉及几个大类原因,其中包括关键原因,也包括其他非关键原因。如果不是关键原因,往往不会仅因为其中的某一条原因而致使品种退审。
3.1 退审集中原因 近年来中兽药注册品种涉及临床有效性问题、注册资料真实性和规范性问题、质量研究和稳定性问题、工艺研究问题这四大类原因品种退审数量最多,分别为45个、44个、42个、41 个,均达到总退审品种数量的70%以上。提示这四个方面的问题是当前中兽药研发过程中的薄弱之处,同时也是技术评审重点关注和审查的内容。从中兽药研发的角度看,这四个方面贯穿研发的整个过程。这些问题反映出不论是前期的药学研究还是后期的临床研究总体研究水平还不高。研究资料的真实性和规范性问题也很突出。
3.2 退审关键原因 大部分品种退审的关键原因是临床有效性问题,包括临床试验设计不合理、不科学,试验质量控制差,数据不可靠,试验报告不完整、不规范等。在全部退审品种中,该类评审意见共117条,平均每个退审品种达2条。这些退审的具体原因反映出注册资料可评价性差,无法支持申报品种的有效性。临床试验设计不合理、不科学占到该类原因的50%,说明中兽药后期研发过程中,在临床试验的设计和方法学等方面还面临巨大的挑战[6]。研发单位缺少专业的临床兽医,对主治病证理解不清楚,不能正确运用随机对照临床试验设计方法。近年来,中兽药注册评审技术要求较以往更强调临床应用价值和有效性,强化临床试验数据质量管理要求,进一步提高了临床试验研究资料的评审标准[7]。而部分注册申请人和研究机构尚未能完全适应这种变化,尤其对于一些早年就开始临床试验的品种,沿用以往思路和方法,导致上述现象的发生。
注册资料真实性和规范性问题也是退审的关键原因,几乎与临床有效性问题相当。该类问题主要包括试验数据不真实,试验数据不符合逻辑或不符合实际,试验数据不规范等。该类评审意见共95条,其中明确试验数据不真实的意见占18%。此外,试验数据不符合逻辑和不符合实际的意见约占37%。这两类意见虽没有明确指出数据不真实,背后也隐含了资料真实性问题。真实性问题约占该大类意见的55%,折射出国内兽药研发行业一定程度上存在自律和诚信缺失的问题[8]。试验数据不规范约占该大类原因的45%。规范性问题贯穿药学、药理毒理和临床研究的各个方面,反映出整个注册资料质量不高,研究不够专业。
3.3 退审伴随原因 质量研究和稳定性问题以及工艺问题涉及的退审品种居于第三、四位。然而,这两大类原因往往不是产品退审的关键原因,一般伴随临床有效性问题或资料真实性问题等退审关键原因一并提出。质量研究和工艺问题反映出研发单位在中药药学方面研究不够专业,缺乏有经验的中药专业研发人员。工艺研究资料和中试生产资料及批生产记录常常不一致,不仅反映出研究过程的不规范,同时也说明研发注册与实际生产相脱节[9]。这也反映出评审对产品有效性和资料真实性关注度高,对产品的质量可控性关注还不够,在以后的评审中应加强对质量可控性的把握。
3.4 退审常见原因 涉及主要药效学问题、毒理学问题和靶动物安全性问题退审的品种也较多,分别为29个、28个、17个,约占全部退审数量的51%、50%、30%。兽药研发过程中非临床有效性考察和毒理学研究在我国中兽药研发和技术评审中依然处于重要地位。在处方来源不清楚,组方依据不充分,缺乏临床用药经验的情况下,主要药效学研究和毒理学研究是药物开发和进入临床研究的基础。这三大类原因中,绝大部分具体原因是试验设计不合理,试验质量控制差。如经过评审发现,毒理学研究设计或方法学存在问题,致使不能提供充分的非临床安全性依据,而非由于申报品种存在毒性反应导致退审。这种现象反映出中兽药前期研发在毒理学设计和方法学方面还可能做不到有充分的把握,而对毒理学研究结果的科学合理分析和安全性风险的综合评估则显得更为困难。在这种背景下,兽药注册评审关注主要药效学和毒理学研究设计和方法,是切合实际的[10]。
3.5 退审其他原因 涉及组方合理性、临床定位、研发立题、中兽医理论符合性、合规性和申请人主动撤回等六大类原因退审产品数量不多,分别为12个、6个、4个、3个、2个、1个。涉及这几类原因的退审产品虽然不多,但依然值得关注。这些退审原因通常是退审的关键原因。目前,这些方面在评审过程中还未得到足够的关注。随着临床价值理念的强化,评审将更加关注临床定位、研发立题等方面,以后将加强这方面的审查力度,可能会增加因这些原因导致退审的数量。此外,在注册管理方面强调中兽药评审方式应符合其自身特点[11],今后对中兽药组方和中兽医理论符合性方面将成为评审重点,研发申报单位应引起足够重视。
4 结 语
综上分析,近年来我国中兽药注册申请退审原因涉及多个方面,其中主要包括临床有效性问题、注册资料真实性和规范性问题等。分析这些原因形成的背景和规律,可以一定程度上反映当前我国中兽药研发和注册管理方面的问题,这些问题值得进一步予以关注和深入探讨。
申报单位应立足拟开发品种的临床价值,研发立题时充分论证拟定的主治病证,充分调研目前的治疗手段和同类产品上市情况,找准拟开发品种的临床定位,发挥中兽药防治畜禽疾病的优势和特点。来源于课题研究成果的品种,应紧密结合临床实际,解决临床存在的问题,并最终用于生产。申报单位在药学、药理毒理和临床研究等方面应具备一定专业水平的人员,或委托专业的研究机构进行研究。临床试验主要研究者应为临床兽医,熟悉畜禽养殖一线动物疾病的实际情况。临床试验设计既要有科学性还要兼顾实际可操作性。新兽药研发单位应加强自律,诚实守信,保证注册资料的真实性,不断提高研究水平。
兽药评审机构应制定和细化相关研发技术指导原则,与申报单位建立有效沟通交流机制,及时介入研发过程,指导研发单位科学、规范开展研究。注册管理部门应加强研发监管,从制度和措施上加大造假成本和处罚力度[12],使研发主体真实试验,诚实整理资料,客观评价,不敢造假,不想造假,引导行业形成风清气正的研发环境,推进兽药产业高质量发展。
