敲低Ube2w增加葡聚糖硫酸钠诱导的小鼠溃疡性结肠炎的易感性
2021-07-19王少鑫崔立红李晓伟刘新尧闫志辉
王少鑫,崔立红,李晓伟,刘新尧,罗 哲,闫志辉
(解放军总医院第六医学中心 消化内科, 北京 100048)
UBE2W[ubiquitin-conjugating enzyme (E2)W]是一种新型泛素结合酶(E2),催化泛素化过程,在人和鼠组织中均有表达[1-2]。在前期研究中发现UBE2W参与了核因子-κB(nuclear factor-κB,NF-κB)转录活性的调控[3],而NF-κB通路作为一种重要的信号传导枢纽,在炎性反应、免疫反应和细胞增殖、凋亡在内的多种生物学效应中均发挥作用,是细胞内的关键信号通路之一[4-6]。由此推测UBE2W可能通过调控NF-κB通路在炎性反应进展中发挥重要作用。本研究中采用小鼠溃疡性结肠炎模型模拟炎性反应过程,探讨UBE2W在葡聚糖硫酸钠(dextran sodium sulfate,DSS)诱导的小鼠溃疡性结肠炎中的作用。
1 材料与方法
1.1 材料
1.1.1 细胞及动物:小鼠成纤维细胞系L929(军事医学科学院国家生物医学分析中心)。C57BL/6雄性小鼠,约6周,共10只,体质量约20 g(北京唯尚立德生物公司,SPF级,无菌环境中饲养)。
1.1.2 试剂:转染试剂Lipofectamine RNAiMAX(Invitrogen公司);小鼠体内转染试剂(英格恩生物有限公司);葡聚糖硫酸钠(dextran sodium sulfate, DSS, MW:36~50 ku)(MP生物医药公司);UBE2W siRNA 1#-3#(广州锐博生物公司合成),靶序列分别为siRNA 1#:5′-GTGGATCGTAGACATGGAA-3′, siRNA 2#:5′-GTAGTCGATACCCTTTTGA-3′,siRNA 3#:5′-CGACTACAAAAAGAACTGT-3′。 UBE2W抗体(Thermo Fisher Scientific公司);GAPDH抗体(锐尔康生物科技公司);PCR检测试剂盒(TaKaRa公司);Q-PCR引物(Invitrogen公司合成)。具体序列见表1。

表1 PCR引物序列
1.2 方法
1.2.1 Western blot检测UBE2W蛋白:小鼠成纤维细胞L929于DMEM培养基中培养,种植于12孔培养皿中,采用转染试剂Lipofectamine RNA iMAX共转,染2次sicontrol/siUbe2w(50 nmol/L)48 h后收集细胞。然后, 将裂解缓冲液加入混匀后, 沸水浴变性10 min;冷却至室温后进行Western blot,主要包括电泳、转印、孵育抗体及显影过程。 一抗为抗UBE2W兔多抗(1∶500),肌动蛋白鼠单抗(1∶1 000)为内参。
结肠组织行Western blot检测:将液氮冻存的结肠组织放置预冷的研钵中研磨, 待组织成粉末状后,加入等量2×蛋白质缓冲液,沸水浴变性再冷却后按上述方法行Western blot。
1.2.2 构建小鼠溃疡性结肠炎模型:将10只C57BL/6雄性小鼠随机分为2组,分别在第0、4和8天分3次尾静脉注射siRNA,进行体内转染siUbe2w和si-control(2.5 mg/kg),根据转染siRNA不同,分别为siUbe2w组和si-control组。其转染的siRNA与转染试剂按2∶1比例配备稀释液进行鼠尾注射,每只鼠尾注射液为200 μL,包括核酸稀释液100 μL(siRNA 和10%葡萄糖各50 μL)、转染试剂稀释液100 μL(转染试剂25 μL和10%葡萄糖50 μL,余纯水补足)。在实验第3天开始饮用2.5% DSS浓度,给药5 d后饮用普通饮用水,小鼠恢复4 d后被处死,第13天实验结束。建模结束时取小鼠全结肠固定于10%甲醛溶液中,同时取材部分小鼠结肠组织分别置于1 mL Trizol和RNAlater(组织保存试剂)中液氮保存。
1.2.3 RT-qPCR检测mRNA:将RNAlater保存的小鼠结肠组织从液氮取出,在预冷的研钵中研磨至粉末状,然后进行RT-qPCR实验。主要包括提取总RNA、cDNA合成、反转录PCR 3部分,PCR反应条件为:95 ℃ 3 min;95 ℃ 5 s,60 ℃ 31 s的步骤,40个循环。结果以2-ΔΔCt表示。
1.2.4 溃疡性结肠炎性反应评价指标:在小鼠溃疡性结肠炎建模过程中每日测量小鼠体质量(g),计算体质量变化(每日体质量/初始体质量)%。组织学评价:以HE(hematoxylin-eosin)染色全结肠中所见溃疡数目评分与溃疡范围评分之和作为组织学评分[7]。
1.3 统计学分析
2 结果
2.1 L929细胞中UBE2W 的蛋白表达
在L929细胞中转染siUbe2w,与对照组相比,转染后3个干扰序列siRNA的UBE2W蛋白表达均有不同程度的抑制,其中siRNA 2#干扰序列的Ube2w敲低效果最佳,选作后续体内转染干扰序列(图1)。
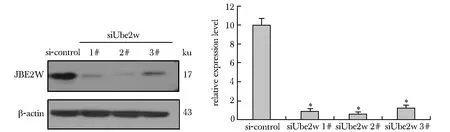
*P<0.05 compared with si-control group
2.2 两组小鼠溃疡性结肠炎组织Ube2w mRNA和蛋白水平比较
Ube2w敲低组小鼠结肠组织中Ube2wmRNA表达水平相对于对照组0.35±0.02,明显降低(n=5,P<0.05)。敲低组UBE2W蛋白表达亦明显低于对照组,因此,siUbe2w体内转染后,敲低组小鼠结肠组织中UBE2W mRNA和蛋白水平明显受抑制(图2)。
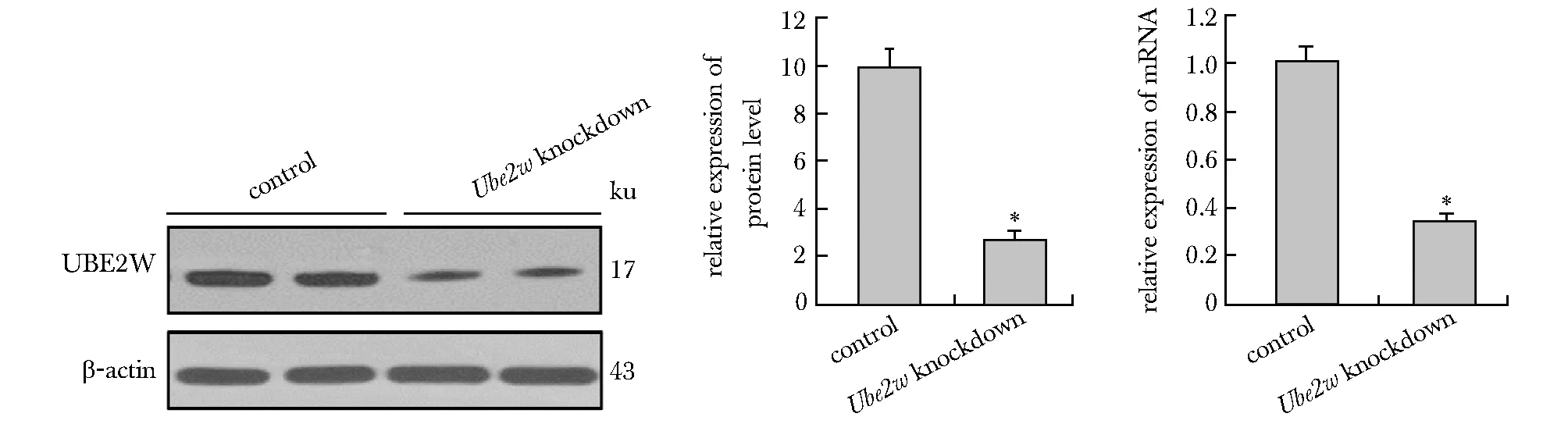
*P<0.05 compared with control group
2.3 UBE2W对两组结肠炎小鼠体质量变化的影响
结肠炎过程中,敲低组小鼠体质量下降较对照组明显,第11天敲低组小鼠体质量丢失至初始体质量的76%左右,而对照组体质量丢失为85%左右(P<0.05)(图3)。
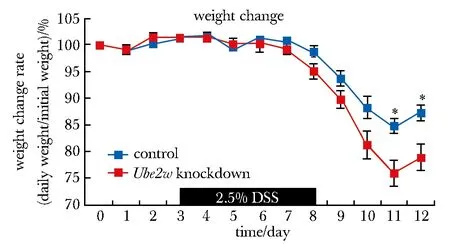
*P<0.05 compared with control group
2.4 两组结肠炎小鼠结肠黏膜病理组织学比较
小鼠全结肠进行组织学HE染色,敲低组小鼠溃疡性结肠炎组织中结肠黏膜表面的溃疡数目明显多于对照组,且溃疡范围更大,即黏膜炎性反应比对照组更严重。敲低组小鼠的结肠炎组织学评分为(8.60±0.24)分,明显高于对照组(5.20±0.49)分(P<0.05)(图4)。
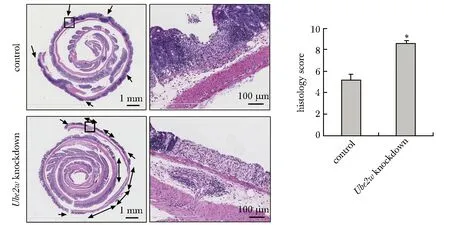
Arrow.the ulcer or ulcer range; *P<0.05 compared with control group
3 讨论
在炎性反应、化学刺激、环境变化等应激反应状态下,可能出现包括NF-κB信号通路在内的各种信号通路的失调,而在不同通路激活过程中,需要泛素化磷酸化等多种蛋白质修饰过程参与[8]。
UBE2W作为一种新型泛素结合酶,催化泛素与靶蛋白的结合,通过泛素化过程,参与了信号传导和DNA损伤等多种生物学过程。目前研究发现,UBE2W可能参与了CHIP和PHD的单泛素化,还可能通过对FA-BRCA通路的调控,与细胞分裂相关[9-11]。另有研究发现,UBE2W在DNA损伤反应中并不发挥重要作用,只在Rnf4缺乏的情况下可能加重DNA损伤[12]。但目前为止,关于UBE2W的生物学功能研究仍鲜有报道。前期研究发现UBE2W参与调控了NF-κB转录活性[3],而NF-κB通路是最主要与炎性反应相关的信号通路之一,参与调控了包括炎性反应、免疫反应和细胞增殖、凋亡在内的多种生物学过程[4,9]。由此设想UBE2W可能参与了炎性反应的调控。为验证这种假设,本研究选择DSS小鼠溃疡性结肠炎模型模拟炎性反应过程,通过建立对照组和Ube2w敲低组结肠炎小鼠,观察不同组小鼠溃疡性结肠炎性程度变化,进而探讨UBE2W对结肠炎性反应的影响。
结肠炎是由多种病因综合作用所致的炎性反应病变,可能涉及包括免疫、遗传、环境和感染等。葡聚糖硫酸钠盐(DSS)诱导的结肠炎性反应很好的模拟了慢性肠道炎性反应过程,现已成为经典结肠炎动物模型,广泛用于实验研究中[13]。
本研究中选择DSS模型模拟小鼠的炎性反应过程,两组小鼠在造模过程中出现不同程度的消瘦、腹泻等表现,结合组织学表现,选择体质量变化和组织学评分评价DSS结肠炎的严重程度和易感性。本研究结果表明,Ube2w敲低组小鼠在DSS诱导的结肠炎中体质量丢失更多、结肠黏膜组织损伤更为明显,因此推测UBE2W参与了炎性反应过程,Ube2w敲低后DSS小鼠溃疡性结肠炎易感性增加。但目前关于UBE2W如何影响了结肠炎的进展过程,以及调控机制仍不清楚,还有待进一步研究。目前新近报道表明UBE2W下调能够促进细胞凋亡[14],是否其在结肠炎进展中也影响了结肠癌的发生,亦是尚待解决的课题,值得进一步深入探讨。
