杂化SiO2微孔膜膜厚对Mg2+、Li+截留性能的影响
2021-07-18刘浩月牛淑锋
刘浩月,牛淑锋,漆 虹
(1.南京工业大学 化工学院 膜科学技术研究所,材料化学工程国家重点实验室,江苏 南京 211800;2.翃翌陶瓷膜研究院,南京翃翌陶瓷纳滤膜有限公司,江苏 南京 210009)
Li作为一种战略性资源,在电池、冶金、润滑剂等领域得到广泛应用[1]。近年来,随着电动汽车行业的飞速发展,全球锂资源消耗量成倍增长。固体锂资源的不断枯竭,使得Li的生产方式逐步过渡到以盐湖提锂为主。盐湖提锂的主要方法有煅烧浸取法、沉淀法、萃取法、吸附法和离子交换膜法等[2]。沉淀法通常适用于低镁锂质量比的盐湖卤水,其工艺成熟、操作简单、适用范围广,已实现工业化。而当卤水镁锂质量比较高时,需消耗大量的沉淀剂,且Li回收效率低,不具备工业化价值[3]。吸附法更适用于高镁锂比的盐湖卤水,其具有选择性好、回收率高、成本低和易规模化等优势,但存在吸附剂渗透性较差、溶剂损失较严重、吸附性下降且造粒困难等问题[4]。
纳滤膜法作为一种高效、绿色和环保的分离方法,可以利用膜的荷电性,实现不同价态离子间的选择性分离,并用于盐湖卤水中Mg2+/Li+的分离。如:Xu等[5]将聚乙烯亚胺复合膜用于Mg/Li分离,可将模拟卤水中镁锂质量比值由20降至1.3;Somrani等[6]采用NF90纳滤膜对ChottDjerid盐湖卤水进行分离,其对卤水中的Mg2+、Li+截留率之差高达85%;康为清等[7]采用DK纳滤膜对3种不同组成的卤水进行单级过滤,过滤后m(Li)∶m(mg)的比值由48.5、42.3和28.3分别下降至4.04、3.21和1.86。但有机膜存在的化学稳定性低、不耐污染和耐氯性差等缺点,限制了它的发展[8]。无机陶瓷膜具有力学强度高、化学稳定性好、能耗低等优点,但其通量和选择性间存在Trade-off效应,制备难度大,目前市场上还没有用于高镁锂比盐湖卤水分离的商业化陶瓷膜[9]。
有机无机杂化膜作为一种新型膜材料,可以利用有机膜和无机膜各自的性能优势,提高膜材料的性能,是当前膜领域的研究热点之一[10]。如Wang等[11]在聚砜支撑层上负载TiO2溶胶制备的杂化膜,通量为原纳滤膜的3倍,其对2 g/L Na2SO4溶液的截留率为96.94%;金丽梅等[12]在聚酰胺复合膜中引入纳米SiO2制得杂化纳滤膜,其在含油体系中脱盐率约50%;Wang等[13]将制备的ZIF-8杂化膜用于水净化,其对甲基蓝染料的截留率达到98.6%。由于有机无机杂化膜具有制备简单、可循环利用等优点,有望在盐湖提锂领域取得较大的进展和突破[14]。
作为一种分子尺度上的有机无机复合材料,以倍半硅氧烷为前驱体制备的杂化膜,被广泛用于渗透汽化[15]、气体分离[16]和反渗透脱盐[17]等领域。本课题组前期[18]采用1,2-双(三乙氧基硅基)乙烷(BTESE)为前驱体,制备管式杂化SiO2膜,考察了烧成温度和制膜液浓度对杂化SiO2膜分离性能的影响。在最佳制备参数下,该杂化SiO2膜纯水渗透率为97.4 L/(m2·h·MPa),对0.002 mol/L LiCl和MgCl2溶液的截留率分别为68.9%和23.9%。但目前,影响杂化SiO2膜性能的因素研究尚不透彻,需要进一步优化制膜的工艺,最终提升膜的分离性能。
膜的厚度是影响膜性能的重要参数之一。通常,膜层较薄时,膜的渗透通量高,但膜层容易产生缺陷,从而影响膜的分离精度[19];当膜层较厚时,能够保证膜的完整性和分离精度,但过程渗透通量较低,且膜层过厚易导致开裂。因此,对每一种膜材料,均存在一个临界膜厚,使得膜在完整无缺陷的前提下,实现选择性和渗透性的统一。而这种统一对于分离精度要求越高的膜材料,其难度越大。综上,本文以BTESE为前驱体,采用多次涂覆,通过改变涂膜次数来调控膜厚,详细探究膜厚对杂化SiO2微孔膜性能及其对Mg2+、Li+分离性能的影响。
1 实验
1.1 试剂与材料
1,2-双(三乙氧基硅基)乙烷(BTESE,纯度≥97%),德国ABCR化学试剂公司;无水乙醇(纯度≥99.7%),德国Merck化学试剂公司;浓HNO3溶液(质量分数为65%),上海凌峰化学试剂有限公司;LiCl、六水合氯化镁(分析纯),西陇化工股份有限公司;去离子水(电导率<5 μS/cm),实验室自制。
以平均孔径为5 nm的管式TiO2膜(南京翃翌陶瓷纳滤膜有限公司提供)为载体,长度为110 mm,内外径分别为8和10 mm,有效过滤面积为22.6 cm2。
1.2 溶胶、粉体及杂化SiO2微孔膜的制备
将BTESE前驱体充分溶解到无水乙醇中,在搅拌过程中逐滴加入去离子水,并滴加HNO3为催化剂,各组分摩尔比为n(BTESE)∶n(C2H5OH)∶n(H2O)∶n(H+)=1∶16.5∶13.9∶0.05。将上述混合溶液置于恒温水浴60 ℃下,回流反应90 min,得到平均粒径为5 nm的杂化SiO2溶胶(以下简称BTESE溶胶)。
取适量BTESE溶胶,用无水乙醇将溶胶中Si的浓度稀释至0.17 mol/L,采用浸渍提拉法,涂覆于管式TiO2膜上。膜管经恒温恒湿条件(温度40 ℃,相对湿度25%)干燥3 h后,置于管式炉内,在N2气氛下烧成,煅烧温度为400 ℃,保温时间3 h,升温/降温速率均为0.5 ℃/min,最终制得杂化SiO2微孔膜(BTESE膜)。分别将上述制膜步骤重复1、3、5次,得到3种BTESE膜分别命名为M1、M3和M5。
在室温下,将BTESE溶胶置于培养皿内,通风橱内干燥24 h,然后将得到的凝胶用研钵进行研磨,得到杂化SiO2粉体(以下简称BTESE粉体)。粉体煅烧条件与膜煅烧条件相同,且分别将经过1、3、5次煅烧的粉体命名为P1、P3和P5。
1.3 BTESE溶胶、粉体及膜的表征
采用粒径及Zeta电位分析仪(NPA152,美国Microtrac公司)测定BTESE溶胶粒径和BTESE粉体的Zeta电位;采用傅里叶变换红外光谱(Nicolet 8700,美国Thermo Nicolet公司)测定BTESE粉体的化学结构;采用物理吸附仪(Labstar MB10,美国Micrometritics公司)测定BTESE粉体的微孔结构,测试前样品在100 ℃下真空脱气12 h,粉体的孔体积分布用NLDFT模型计算得到;采用场发射扫描电镜(S4800,日本Hitachi公司)观察BTESE膜的微观形貌;采用电导率仪(DDS-307,上海雷磁仪器厂)测定盐溶液中离子的电导率。
1.4 膜的性能测试
配制浓度为0.01 mol/L的LiCl和MgCl2溶液,采用自制的管式膜错流过滤装置[20],在温度(20±2) ℃、膜面流速2 m/s、操作压力0.6~2.0 MPa的条件下,分别测定M1、M3、M5膜的纯水通量及其对锂镁离子的截留性能。根据文献[20]中公式分别对BTESE膜的纯水通量及其对镁锂离子截留性能进行计算。
2 结果与讨论
2.1 BTESE粉体的性能
2.1.1 BTESE粉体的微结构
图1是BTESE粉体的N2吸附-脱附曲线和NLDFT孔径分布图。从图1(a)中可以看出,3种BTESE粉体的N2吸附-脱附等温线均为I型等温线,表明3种粉体均具有典型的微孔结构。由BTESE粉体的孔径分布图1(b)中可以看出,3种粉体的孔径分布在0.6~2.0 nm 之间,平均孔径约为0.63 nm。其中,在0.6~0.65 nm之间分布最为集中,有少量孔分布于2.0~4.0 nm之间。
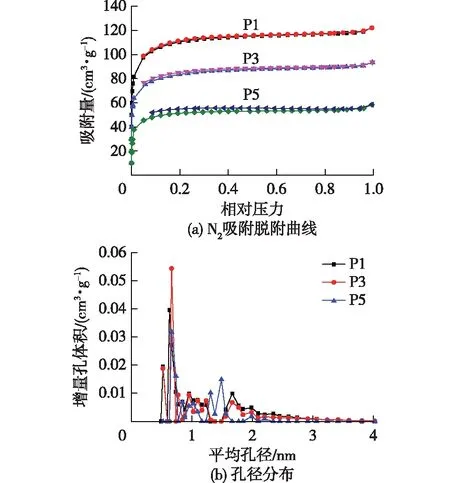
图1 BTESE粉体的N2吸附-脱附曲线和孔径分布Fig.1 N2 adsorption-desorption isotherms and pore size distributions of BTESE powders
表1是BTESE粉体的孔结构数据。由表1可知,随着煅烧次数增加,BTESE粉体的比表面积和孔体积均逐渐减小,比表面积由346.6 m2/g下降至157.0 m2/g,孔体积由0.184 cm3/g下降至0.116 cm3/g,孔结构趋于致密化。
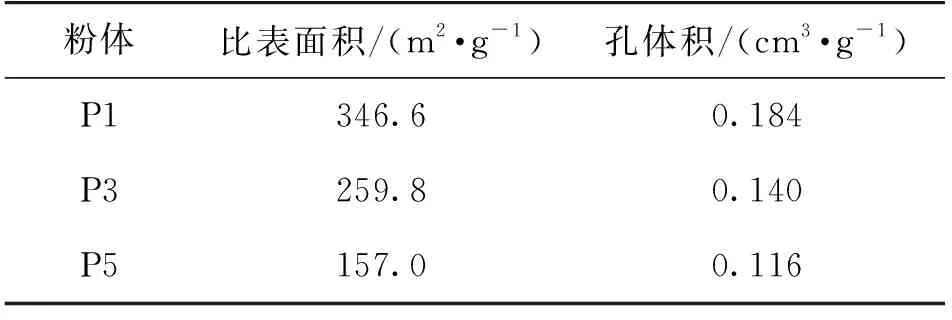
表1 BTESE粉体的孔结构数据Table 1 Pore structure data of BTESE powders
图2为BTESE粉体的傅里叶变换红外光谱图。图谱中,2 906、1 415和1 270 cm-1处分别对应C—H键的伸缩振动峰、剪式振动峰和面外摇摆振动峰,770和1 020 cm-1处分别对应Si—O—Si键的不对称振动峰和对称伸缩振动峰,700 cm-1和3 450 cm-1处分别对应Si—C键和Si—OH键的伸缩振动峰[21],表明3种BTESE粉体均具有完整的有机无机杂化网络结构。同时,随着煅烧次数的增加,BTESE粉体的Si—C键和Si—OH键的特征峰强度依次减弱。表明持续热处理会促进粉体中的硅羟基发生脱羟基反应和有机链段的分解,孔结构趋于致密化,这与表1中BTESE粉体的比表面积和孔体积的变化趋势一致。
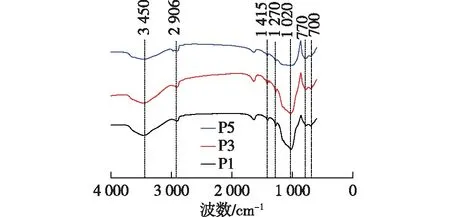
图2 BTESE粉体的FT-IR图谱Fig.2 FI-IR spectra of BTESE powders
2.1.2 BTESE粉体的荷电性能
图3是BTESE粉体在0.01 mol/L LiCl和MgCl2溶液中的Zeta电位图。由图3可知, BTESE粉体在pH为1~10范围内的Zeta电位均为负值,表明粉体表面荷负电。Zeta电位绝对值随pH的增大不断增大,这是因为粉体荷负电,粉体的荷电基团和溶液中的Li+、Mg2+、H+、OH-结合。随着溶液pH增加,H+浓度降低,粉体对金属离子的吸附性增强,使得Zeta电位的绝对值呈上升趋势[22-23]。当pH为7时,BTESE粉体分别在LiCl和MgCl2溶液中的Zeta电位之差为18.2 mV,表明在中性电解质溶液中,BTESE粉体表面的电荷密度在一价和二价离子溶液中差异较大,有利于不同价态阳离子的分离[24]。
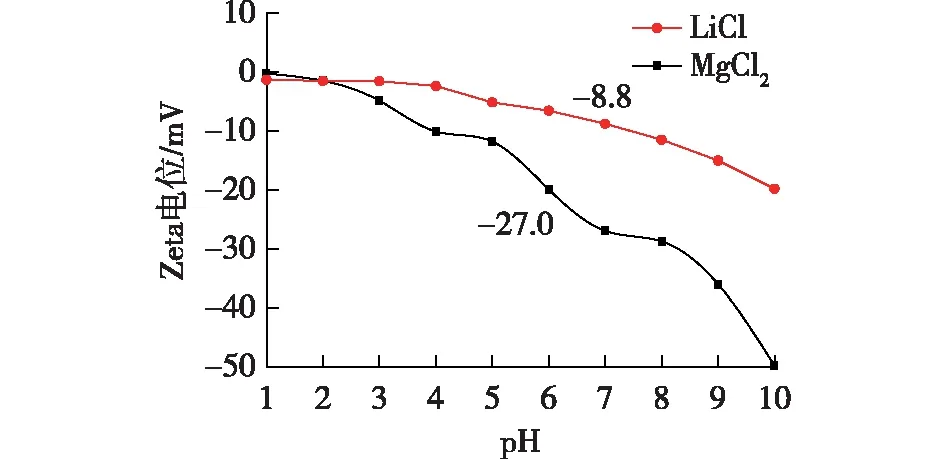
图3 BTESE粉体在0.01 mol/L LiCl和MgCl2溶液中的荷电性能Fig.3 Zeta potential of BTESE powders immersed in LiCl and MgCl2 solutions (c=0.01 mol/L)
2.2 杂化SiO2微孔膜的性能
2.2.1 杂化SiO2微孔膜的微观形貌
图4是不同膜厚BTESE膜的SEM图。由BTESE膜的断面SEM图可观察到清晰的膜层,M1、M3和M5膜的厚度分别为1.16、1.28和1.45 μm。随涂膜次数增加,膜厚逐渐增加。M3、M5膜的膜厚相较于M1膜分别增加了0.12和0.29 μm。由于载体的吸浆能力的不同,涂膜次数不同,膜的厚度有较大差异。在平均孔径为5 nm的管式TiO2膜上涂覆一次BTESE溶胶,膜厚为1.1 μm左右,而在此基础上继续增大涂膜次数,膜厚的变化要小得多,约为0.1 μm。

图4 BTESE膜断面和表面SEM图Fig.4 Cross-sectional and surface SEM images of BTESE membranes
由BTESE膜的表面SEM图可知,随着膜厚的增加,BTESE膜表面更加平整,且3种膜厚下的BTESE膜均没有可见的裂纹或缺陷。因此,通过控制涂膜次数,可以制备出不同膜厚的BTESE膜,且3种不同膜厚均在文献[25]报道的有机硅膜临界膜厚范围内,可以保证膜的表面完整性。
2.2.2 杂化SiO2微孔膜的纯水渗透性能
图5为3种不同膜厚的BTESE膜的纯水渗透率。随着膜厚的增加,BTESE膜的纯水渗透率发生了明显变化。M1、M3和M5膜的渗透率分别为245.4、109.9和29.2 L/(m2·h·MPa)。当膜厚由1.16增加至1.28 μm时,其纯水渗透率分别下降了51%,膜厚由1.16增加至1.45 μm时,其纯水渗透率分别下降了87%。这是因为随着膜层厚度的增加,BTESE膜表面更加平整,微小缺陷得到弥补;同时,膜层厚度增加,膜孔趋于致密,传质阻力增大,水分子透过阻力增大,导致膜的纯水渗透率明显下降。
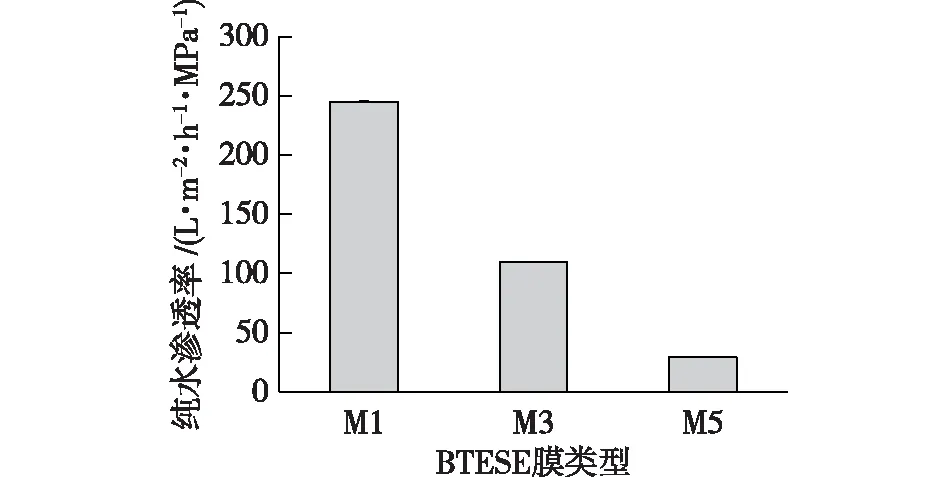
图5 BTESE膜的纯水渗透率Fig.5 Pure water permeability of BTESE membranes
2.2.3 杂化SiO2微孔膜对Mg2+、Li+的截留性能
图6为3种不同膜厚的BTESE膜在单组分0.01 mol/L LiCl和MgCl2溶液中的通量随压力的变化关系。从图6中可以看出,M1、M3、M5膜的渗透通量随跨膜压差的变化呈线性变化,符合Darcy定律。且同一膜厚下,BTESE膜在0.01 mol/L LiCl和MgCl2溶液中的渗透率相差不大。M1、M3、M5膜分别在LiCl和MgCl2溶液中的渗透率为225.9和242.6、97.1和112.0、26.0和23.3 L/(m2·h·MPa)。
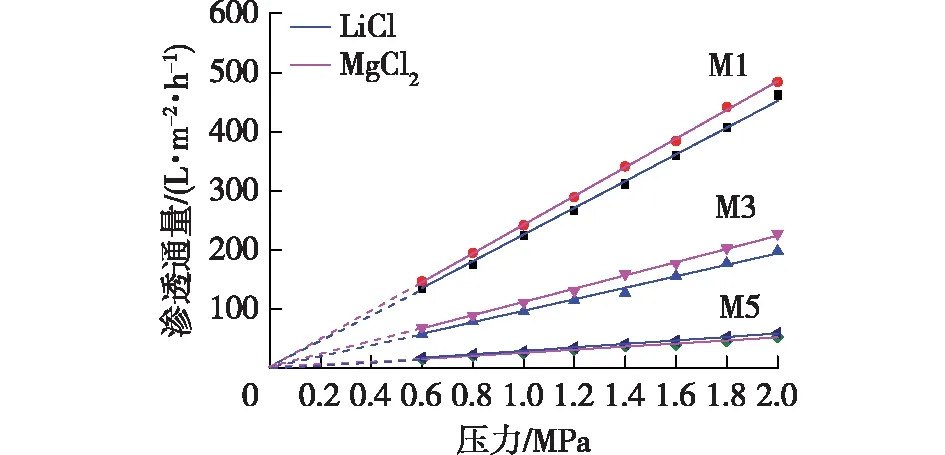
图6 BTESE膜在0.01 mol/L LiCl和MgCl2溶液中的通量随压力的变化关系Fig.6 Flux of BTESE membranes as a function of transmembrane pressures (test condition: LiCl and MgCl2 solutions(c=0.01 mol/L))
图7为3种不同膜厚的BTESE膜对单组分0.01 mol/L LiCl和MgCl2溶液的截留性能。由图7可见,M1、M2和M3膜对0.01 mol/L LiCl溶液的截留率分别为31.1%、58.1%和66.3%,对0.01 mol/L MgCl2溶液的截留率分别为0.9%、1.5%和2.4%。M2和M3膜对Li+和Mg2+截留率的差值均大于50%,表明制备的BTESE膜具有良好的Mg2+、Li+分离性能。且同一膜厚下的BTESE膜对LiCl溶液的截留率均大于对MgCl2溶液的截留率。这是因为BTESE膜表面荷负电,由道南效应可知,在渗透过程中,BTESE膜对带负电的Cl离子产生排斥,而带正电的Mg2+和Li+进入膜孔。由于膜表面荷负电,对阳离子有强烈的吸引作用,二价阳离子Mg2+的电荷密度远大于一价阳离子Li+的电荷密度。因此,膜表面对Mg2+的吸引力大于时Li+的吸引力,MgCl2溶液比LiCl溶液更容易透过膜孔,从而导致BTESE膜对MgCl2溶液的截留率相对较低[24,26]。
由图7还可以看出,随着膜厚的增加,BTESE膜对LiCl和MgCl2溶液的截留率均逐渐增大。这是因为采用浸渍提拉法涂膜时,被稀释的制膜液浓度、黏度均较低,涂覆在管式TiO2膜上会存在大孔缺陷。但随着涂膜次数的增加,新的膜层会修补上层膜层的表面缺陷,使得膜表面大孔数量急剧下降,膜层平均孔径减小,导致膜对LiCl和MgCl2溶液的截留率逐渐提升。表2是本文制备的BTESE膜性能与文献的对比。由表2可知,在0.01 mol/L的MgCl2和LiCl溶液中,本文制备的M3膜具有较高的渗透性能(109.9 L/(m2·h·MPa))和良好的选择性(LiCl和MgCl2溶液的截留率之差为56.6%)。
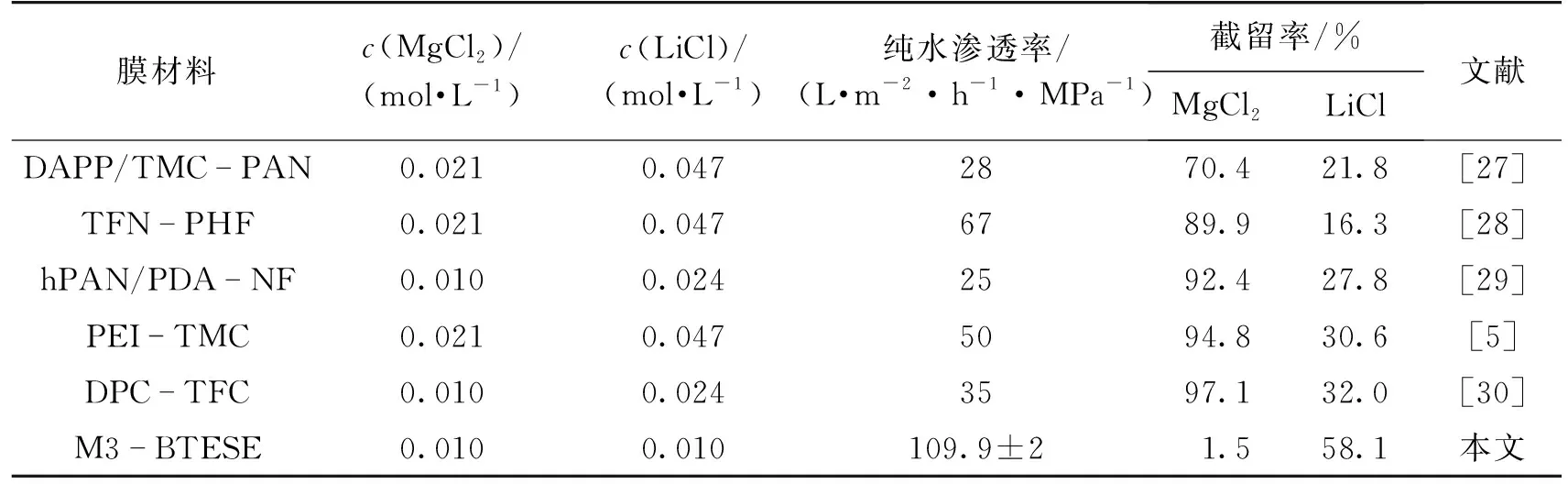
表2 微孔膜对MgCl2和LiCl溶液截留性能的对比Table 2 Comparison of MgCl2 and LiCl solutions rejections of microporous membranes
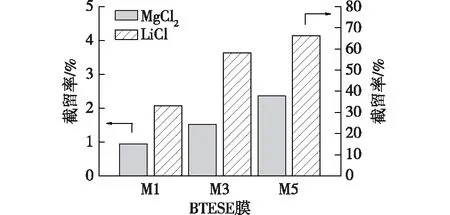
图7 BTESE膜对0.01 mol/L LiCl和MgCl2溶液的离子截留性能Fig.7 The ion retention performance of BTESE membranes to LiCl and MgCl2 solutions (c=0.01 mol/L)
图8是在压力1.0 MPa、膜面流速2 m/s的条件下,M3膜的纯水渗透率和对0.01 mol/L LiCl溶液的截留率随过滤时间的变化。从图8中可以看出,在连续运行过程中,M3膜的纯水渗透率和对LiCl溶液的截留率基本保持稳定,纯水渗透率稳定在(109.9±2)L/(m2·h·MPa),对0.01 mol/L LiCl的截留率稳定在(50.4%±1%)。
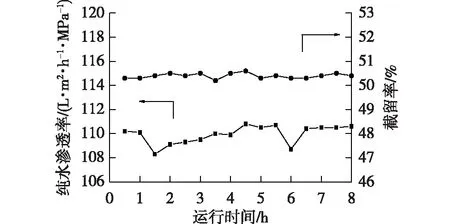
图8 M3膜的纯水渗透率和对0.01 mol/L LiCl溶液的截留率随时间的变化Fig.8 Variation of rejections and permeabilities of M3 membrane with regard to 0.01mol/L LiCl solution as the operation time extended
3 结论
1)通过控制涂膜1、3、5次,成功制备出不同膜厚且完整无缺陷的杂化SiO2微孔膜,M1、M3和M5膜的膜厚分别为1.16、1.28和1.45 μm。
2)随着膜厚的增加,杂化SiO2微孔膜的纯水渗透率逐渐减小,对0.01 mol/L LiCl和MgCl2溶液的截留率逐渐增加。
3)膜厚是影响杂化SiO2微孔膜对Li+、Mg2+截留性能的关键。当膜厚为1.28 μm时,M3膜的纯水渗透率为109.9 L/(m2·h·MPa),对0.01 mol/L LiCl和MgCl2溶液的截留率分别为58.1%和1.92%。在1.0 MPa压力下过滤8 h后,其纯水渗透率和对LiCl溶液的截留率基本保持稳定。
