缺氧地下水中石油烃类去除的原位生物修复
2021-07-17孙瑞,殷瑶,*
孙 瑞,殷 瑶,*
(1.上海市政工程设计研究总院<集团>有限公司,上海 200092;2.上海申环环境工程有限公司,上海 200092)
世界人口增长、农业生产以及工业废物的处置不当,导致地下水环境的维持面临巨大挑战。石油烃(PHCs)化合物使用广泛,已成为最常见且难降解的地下水污染物之一[1]。当前,修复被石油烃污染的地下水的传统方法通常包含原位曝气、土壤气相抽提、好氧生物降解方法[2]。生物修复技术因具有操作相对简单、低成本、二次污染小和潜在修复效果好等优点[3],被认为是处理石油烃污染的最具前景的技术[4-5]。在生物修复过程中,微生物利用有机污染物作为能源或营养物质来源[6]。微生物修复技术主要包括通过施加营养物质进行的生物刺激和通过接种具有可分解碳氢物质能力的微生物或菌团。
目前,围绕石油污染的修复研究主要集中在好氧条件的选取[7]。然而,许多受石油烃污染的场地由于有机污染物自然衰减耗氧而处于厌氧环境[2]。因此,采用好氧生物降解污染物时需添加大量氧气以创造有氧环境[8]。氧气的溶解度低,并会与缺氧地下水中的亚铁等还原组分反应,导致注入氧气成本昂贵且效率低下,这就需要采用厌氧微生物来处理。厌氧菌降解石油烃过程中,石油烃作为碳源,在代谢途径中属于电子供体,硝酸盐、硫酸盐或三价铁氧化物作电子受体将有机化合物氧化为二氧化碳[9],通过外源投加电子受体等调控方式可促进石油烃类污染物的降解[10-11]。原位厌氧生物修复技术主要被用于厌氧还原降解氯代烃污染物[12],其厌氧氧化石油烃降解通常以实验室研究为主[13-14],国内实际工程应用研究较少。原位厌氧强化氧化生物修复技术(EAOB)主要针对石油烃类污染物,可以原位完全生物降解该类污染物[15]。在实际工程中,通常采用厌氧生物降解技术作为后续补救以及控制污染的重要手段。生态环境部印发的《污染地块地下水修复和风险管控技术导则》(HJ 25.6—2019),要求当修复达标后仍需进行两年的监测,其时间跨度大且由于土壤和地下水修复目标值差异,可能导致地下水出现个别点位浓度复增,可采用原位厌氧生物修复再次降低污染物残留浓度,从而保证场地修复的可持续,导则发布为该技术应用提供了新机遇。因此,探索缺氧条件下石油烃的原位微生物氧化降解具有重要意义。
论文通过开展中试试验,在此基础上,进行缺氧地下水原位厌氧生物修复应用研究。在探明中试区域环境特征的基础上投加强化菌株,利用地下水中石油烃修复过程浓度变化、污染晕分析以及降解动力学表征这3方面数据评价原位厌氧生物强化作用功效,探讨地下水石油烃厌氧生物修复技术的适用性和可行性,以期为原位厌氧生物修技术的推广应用提供技术支撑。
1 试验材料与方法
1.1 试验材料及过程
投加的具有醌呼吸能力C8菌株源自采油井附近原油田石油污染土壤,其为以硝酸盐氮作为电子受体的反硝化菌株,与芽孢杆菌(Bacillussp.)具有99%的相似度[16]。投加前,先将筛选的菌株接种至含硝酸盐氮的LB培养基(蛋白胨5 g/L、氯化钠10 g/L、酵母粉10 g/L、KNO34 g/L,调节pH值为7.0)进行富集培养。通入氩气3 min,振荡培养,温度为30 ℃,转速为150 r/min,培养10 d后再使用,从而使培养基中的易降解碳源基本消耗殆尽,此时微生物浓度达到最大化。
生物表面活性剂-鼠李糖脂购自西安瑞捷生物科技有限公司,浓度为60 g/L(纯度为80%);分析纯硝酸钾(纯度≥99.0%)购自国药集团化学试剂有限公司。
1.2 试验设计
1.2.1 污染场地概况
污染场地位于上海市奉贤区,历史上主要为量具厂,其生产工艺使用机油作为清洗液,产生的废油多被直接倾倒。量具厂生产车间位于污染场地西北侧,部分历史车间在污染范围内。场地调查表明,西北地块边界外侧也存在较高浓度的地下水石油烃污染。场地位置概况如图1所示。
图1 场地位置概况
污染地下水为浅层地下水,最大污染深度在地面下7.5 m。地下水流向大致为自西北向东南方向,平均埋深为1.5 m。场地4 m以下普遍存在一层粉砂层,渗透性较高,易造成污染的纵向迁移,最大污染深度均到达潜水含水层底板隔水层,但未穿透。场地地面下8 m范围内地质条件为填土层(厚度为1.7~3.4 m)、粉质黏土层(厚度约为2.2 m)、粉砂土层(1.0~2.5 m)和灰色淤泥质粉质黏土层(顶板埋深为4.5~5.0 m)。
1.2.2 土壤微生物性质调查
前期调查结果表明,场地土壤和地下水中均存在石油烃污染。考虑到地下水中微生物种群较小导致测量精度差等问题,对场地范围内不同点位和深度的土壤进行了微生物性质的调查,旨在借助调查结果,分析受污染地下水中微生物种群分布特征。为防止对建井区域造成干扰,所选择点位S1、S2和S3分布在中试区域边界位置,且靠近土壤石油烃污染较重处呈三角形分布(图2)。参考场地平均地下水位(约为1.5 m),深度从表层土至污染最深层处,在地下水位上(地下1 m)、下(地下3 m)及深层(地下5 m)进行了土壤均布采样。
1.2.3 中试试验
选取场地西北侧地下水污染严重区域,设置3组地下水试验井(井深为6 m),开筛范围为地表下2.0~5.5 m。其中GW1、GW2、GW3为微生物注入井,横向间距为3 m。在GW1的北侧、西侧、东侧1 m处均布设1口监测井,南侧1 m处布置3口间隔为1 m的监测井;在GW2和GW3的南侧1 m处均布设1口监测井(图2)。试验使用蠕动泵在注射井液面下0.5 m处注入菌液,单井单次注入2 L。另外,GW1同时投加500 mL生物表面活性剂-鼠李糖脂和2 L浓度为25 g/L KNO3的电子受体-硝酸盐氮,GW3则只额外投加500 mL生物表面活性剂-鼠李糖脂。中试试验开展共计63 d,具体试验记录如表1所示。
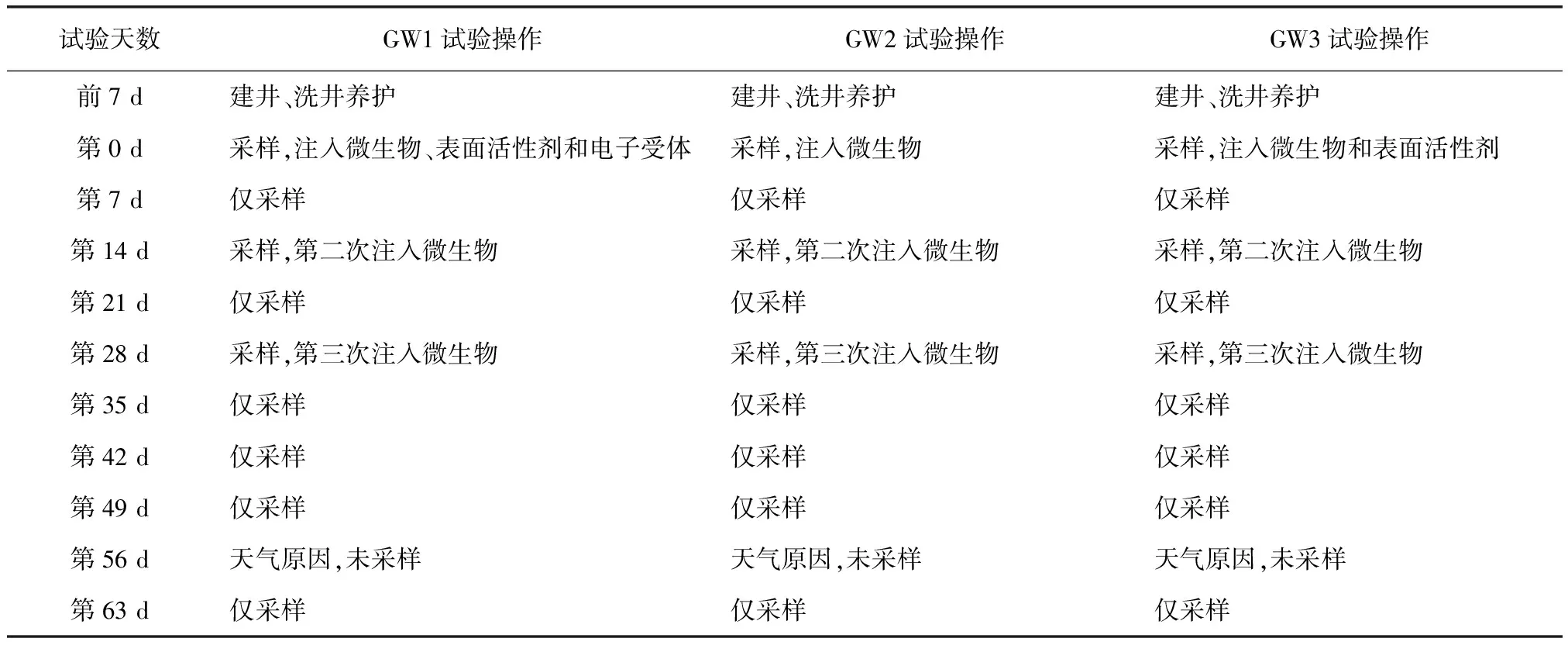
表1 中试过程记录

图2 地下水井和土壤采样点布置平面图
1.3 样品采集与测试
采样点布置如图2所示,采样前先用贝勒管进行洗井,贝勒管汲水位置为井管底部。每口监测井需洗出净化3~5倍滞水体积,并测量地下水质指标(如pH、温度、电导率)的变化。开始洗井时,控制贝勒管缓慢下降和上升,记录洗井开始和结束时间和至少5次水质指标变化情况,待连续3次采样水质指标稳定后,浊度在5 NTU以下则停止洗井作业。洗井过程可清除井内初次渗入的地下水中夹杂的混浊物,也可提高井内与周边地下水之间的水力联系。洗井过程中产生的废水,统一收集处理。洗井作业结束,井水静置2 h后开始取样。对同一个监测井采样时,贝勒管在液面0.5 m下连续不间断采样,确保水样不受外界环境污染。
地下水样品采集后立即送往实验室于1周内完成分析,测试指标为PHCs和分段PHCs浓度,所有测试均委托具有CMA和CNAS资质的实验室检测。PHCs采用《水质 可萃取性石油烃(C10-C40)的测定气相色谱法》(HJ 894—2017)相关分析方法,分段PHCs(C10-C12、C13-C16、C17-C21、C22-C40)采用《GCFID法测定 非卤代有机物》(USEPA 8015D—2003)相关分析方法。土壤微生物性质调查的样品,采集后委托有资质的生工生物工程(上海)股份有限公司进行生物宏基因组分类测序试验,在测序公司提供的平台上进行分析。
2 结果与讨论
2.1 地下水PHCs污染特征
参考原《上海市污染场地风险评估技术规范》,采用《荷兰土壤修复通告》(DutchSoilRemediationCircular2009)中地下水石油烃污染干预值(600 μg/L)作为地下水PHCs污染评价标准。基于未注入菌株前采样结果,使用Surfer 13.0软件进行PHCs浓度Kriging插值分析。地下水PHCs污染晕以GW2-S井为原点,呈西北向东南方向分布,与地下水流方向趋于一致(图3)。GW2-S监测井中PHCs浓度最高达87.8 mg/L,GW1、GW2、GW3中PHCs(C22-C40)占比为68.43%~79.30%。初步判断场地PHCs以长碳链为主,存在中短碳链PHCs。当存在PHCs时,地下水中溶解氧极易耗尽[9]。现场溶解氧测试浓度为0.24~0.41 mg/L,参考国内外原位厌氧生物修复受污染地下水基本应用条件[14,17-18](溶解氧小于2 mg/L),可进行原位厌氧生物修复受污染的地下水。
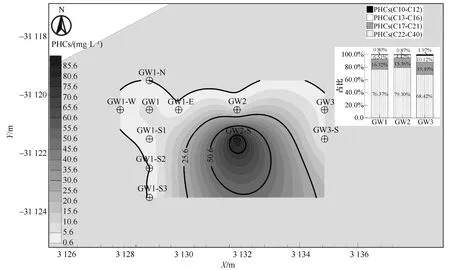
图3 地下水PHCs污染分布特征
2.2 可降解石油烃厌氧菌分布
采集的土壤微生物样品经预处理(去除嵌合体及非特异性扩增序列),通过生物序列分布对物种分类排序,可得种群级别的微生物分布。结合已报道可厌氧降解石油烃的微生物种类,筛分场地中厌氧微生物菌群,主要的10种分别为:Geobacter[19]、Thauera[20]、Dechloromonas[21]、Desulfuromonas[22],Ralstonia[23-24]、Desulfitobacterium[19]、Desulfovibrio[25-27]、Desulfatiferula[28]、Desulfatibacillum[29]、Rhodocyclus[30],每种菌株的代谢类型如表2所示。由此可知,场地地下存在一定量能够进行厌氧微生物降解的微生物,但是与细菌分布整体(丰度达41 265)相比,其丰度较低,其存在可能与场地石油烃污染有一定关联。
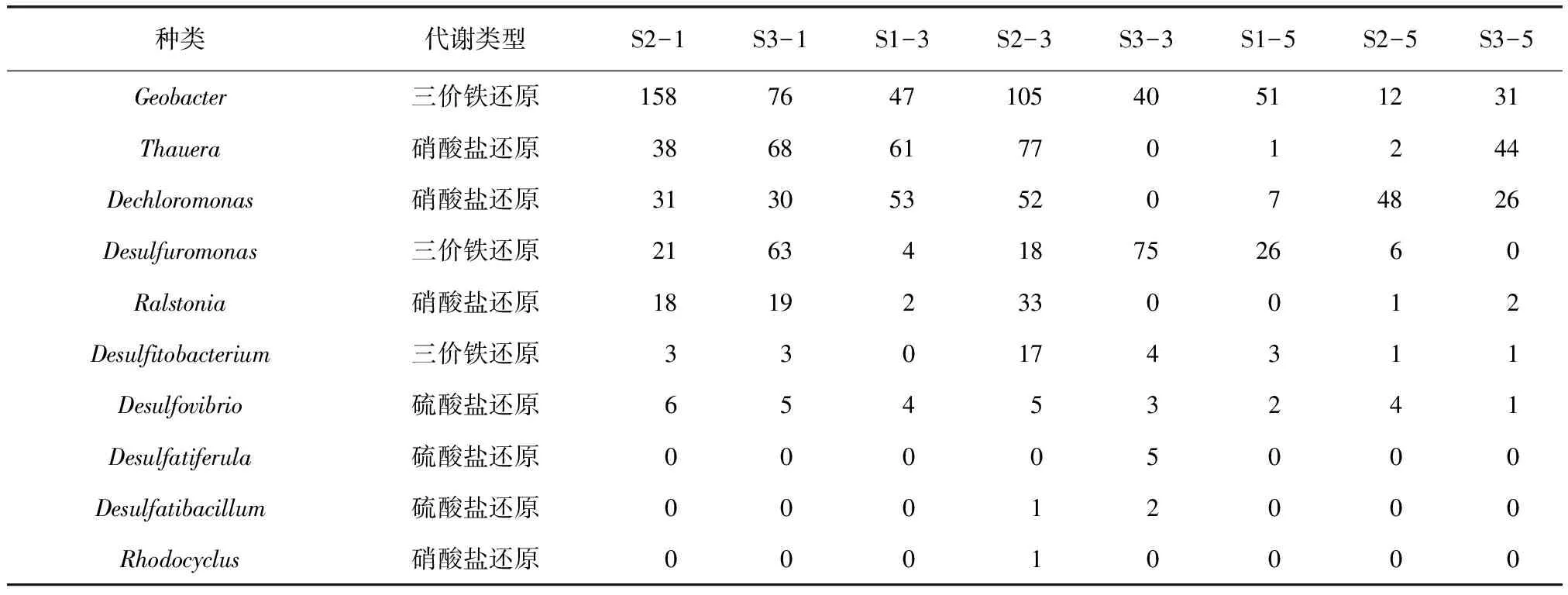
表2 可降解石油烃厌氧细菌分布丰度
2.3 地下水中PHCs污染变化
与厌氧微生物降解过程相比,好氧生物降解通常较缓慢[31-32],因此,厌氧生物强化修复过程选取GW1、GW2和GW3进行分段PHCs浓度监测。试验开始后,地下水中分段PHCs降解变化如图4所示。2个多月(63 d)的修复过程中,地下水分段PHCs浓度占比均呈现中短链石油烃占比下降趋势,甚至完全降解。这符合强化菌株C8降解石油烃特征:对于部分长碳链石油烃(尤其是碳链长度高于28)降解能力有限[16]。GW1中PHCs(C10-C12)、PHCs(C13-C16)、PHCs(C17-C21)和PHCs(C22-C40)初始占比分别为0.79%、6.51%、16.32%和76.37%,63 d厌氧修复后仅残留PHCs(C17-C21)和PHCs(C22-C40),分别占3.01%和96.99%。GW2中PHCs(C10-C12)、PHCs(C13-C16)、PHCs(C17-C21)和PHCs(C22-C40)初始占比分别为0.87%、4.47%、15.36%和79.30%,63 d厌氧修复后仅残留PHCs(C17-C21)和PHCs(C22-C40),分别占8.40%和91.60%。GW3中PHCs(C10-C12)、PHCs(C13-C16)、PHCs(C17-C21)和PHCs(C22-C40)初始占比分别为1.97%、10.12%、19.49%和68.42%,63 d厌氧修复后残留PHCs(C13-C16)、PHCs(C17-C21)和PHCs(C22-C40),分别占0.56%、2.56%和96.88%。需要说明的是,中试场地在14~21 d时遭受外来破坏(临近土层被挖),短链占比在此时出现了复增上升情况。
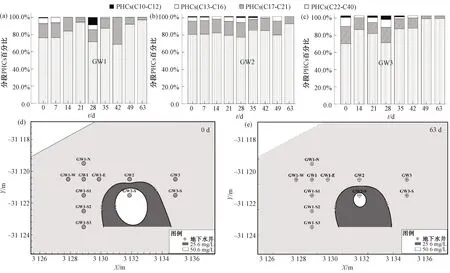
图4 分段PHCs占比变化(a)~(c)及PHCs污染晕分布范围对比(d)~(e)
由地下水中PHCs污染晕分布范围对比(图4)可知,地下水修复期间,PHCs污染晕分布明显收缩。以地下水中PHCs浓度在25.6 mg/L(深灰)和50.6 mg/L(白色)以上的污染面积为例,25.6 mg/L的分布范围呈明显收缩趋势,而50.6 mg/L的分布由约3.899 m2缩减至0.568 m2左右,厌氧微生物强化修复作用效果较为明显。尽管PHCs污染晕的面积明显缩小,但地下水PHCs浓度最高的位置仍停留在GW2-S附近,并未在对流、弥散作用下沿地下水流方向迁移,说明GW2-S处可能存在残留于土壤含水层介质中的PHCs,并仍作为潜在的污染源向地下水中不断释放。然而,污染晕的范围不增大反而明显减小,这仅依靠自然状态下土壤的吸附作用短时间难以达到,说明地下水中PHCs受到生物降解作用的影响,大部分PHCs污染物被消耗。
2.4 PHCs降解动力学表征
确定厌氧微生物强化作用在污染场地存在后,PHCs降解动力学表征可进一步评估生物修复作用对地下水中PHCs的影响程度。中试修复场地进行了3次周期性微生物注射,在第一次注药时,同时分别按中试试验设计加入表面活性剂-鼠李糖和硝酸盐氮,最后一次注药在修复后第28 d。综合考虑添加表面活性剂-鼠李糖和硝酸盐氮的时间以及注药结束时间,分析GW1、GW2、GW3中分段PHCs(C<22)污染变化(图5)。PHCs(C<22)石油烃在前14 d呈现明显下降,之后降解效果趋于平缓。前3次注入菌剂在28 d时完成,且前14 d内总石油烃降解受外源刺激影响显著,同时需考察菌株C8的场地应用效果。因此,选择中试修复前14 d和28~63 d的监测数据分段进行降解动力学模拟。

图5 PHCs(C<22)降解动力学表征及修复过程浓度变化
利用前14 d的地下水中分段PHCs(C<22)数据,依据一级反应动力学方程对该段中试期间分段PHCs(C<22)的衰减速率进行计算,GW1、GW2和GW3的分段PHCs(C<22)衰减速率分别为0.177 9、0.056 1 d-1和0.109 3 d-1。由衰减速率可知,添加生物表面活性剂-鼠李糖脂和硝酸盐氮的GW1井降解速率最大,其次为添加表面活性剂-鼠李糖脂的GW3,只添加强化菌株C8的GW2降解速率最低。中试前14 d的效果表明,菌株C8存在时,向地下水中投加表面活性剂和电子受体(硝酸盐氮),可以显著刺激和强化菌株C8的降解能力。PHCs是疏水性有机物,水中溶解度极低,浓度较高时漂浮水面,降低了其与菌株C8的接触。微生物摄取PHCs主要依靠表面活性剂介导和界面接触两种模式[33],强化菌株C8摄取PHCs为表面活性剂介导模式[16]。添加生物表面活性剂-鼠李糖脂,增加了PHCs水相溶解,有效促进了微生物对石油烃的利用。同时,菌株C8以硝酸盐氮作为电子受体进行厌氧生化[16],投加电子受体可以显著加速PHCs降解[34]。因此,表面活性剂的存在和投加充足的电子受体,明显提高了PHCs的降解速率。
依据中试修复后28 d的地下水中分段PHCs(C<22)浓度变化(表3),采用一级反应动力学方程对该段中试期间分段PHCs(C<22)降解动力学拟合。自然对数化GW1、GW2和GW3监测井内地下水中分段PHCs(C<22)浓度,以修复时间为横坐标绘制散点图(图5)。通过拟合PHCs(C<22)浓度自然对数相对于时间的趋势线,得出GW1、GW2和GW3内强化菌株C8降解PHCs(C<22)过程符合假一级动力学。由于污染场地地下条件较为复杂,线性回归所得R2相对较低,但能够真实反映降解情况。如图5所示,14 d后PHCs降解趋于平缓,推测地下水井内投加的生物表面活性剂降解消耗殆尽,投加的硝酸盐氮也基本反应消耗完全,额外投加表面活性剂和硝酸盐氮的促进作用已减弱甚至已消失。GW2井仅投加菌株C8,比较GW2井14 d前和GW1、GW2、GW3井28 d后分段PHCs(C<22)的降解速率,两者近乎相同(约0.055 d-1)。因此,推测28 d后的降解主要依靠菌株C8自身降解PHCs能力。
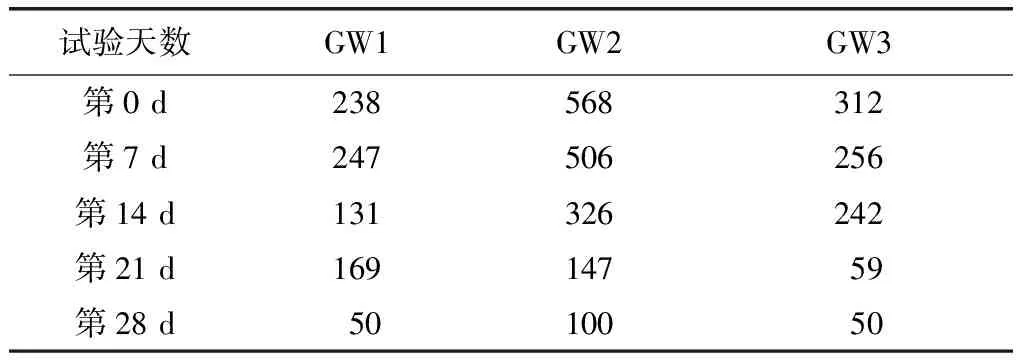
表3 28 d起各井中分段PHCs(C<22)浓度 (单位:μg/L)
在自然衰减作用下,Guo等[35]研究表明最适温度条件下,含水层中PHCs降解30年的平均自然衰减率估值在0.003 76 d-1,即半衰期为184.3 d。Lü等[36]研究也发现,地下水中PHCs自然衰减速率在0.001 0~0.002 5 d-1,平均速率为0.001 5 d-1,即半衰期为462.1 d。中试区域GW1、GW2、GW3中地下水PHCs修复28 d后的降解速率在0.044 1~0.059 6 d-1,半衰期为11.63~15.72 d,比自然衰减的速率常数高出一个数量级,说明厌氧微生物强化修复作用远强于自然衰减作用。对比类似研究,Dou等[37]分离出可降解苯的蜡样芽孢杆菌(Bacilluscereus),在厌氧硝酸盐还原体系下,当苯初始浓度低于150 mg/L时能够在25 d内被完全生物降解。Singh等[38]分离出短小芽孢杆菌(Bacilluspumilus)具有较高的降解潜力,能够在两周内达到86.94%的柴油生物降解,且接种混合菌株降解效果要低于单一菌株。与自然衰减条件相比,中试采用的原位厌氧生物强化修复技术在地下水石油烃降解效率上提高了至少10倍,但综合考虑强化菌株C8对于降解高碳链(C不小于28)石油烃污染物存在一定困难,需要较多时间,故保守估计中试地下水石油烃降解效率至少提高了50%以上。缺氧环境中原位厌氧生物修复石油烃污染地下水工程应用需考虑污染物源头阻隔、生物药剂适宜环境塑造、污染物与微生物结合概率和提供充足的反应电子受体等影响因素,且在设计和运行时,需对修复过程定期监控,将场地环境调整至厌氧生物修复最佳应用条件。
3 结论
(1)中试区域地下水受到了不同程度的PHCs污染,在GW2-S处污染浓度最高,沿地下水流向污染降低。场地地下存在一定量能够进行厌氧微生物降解的微生物,但丰度较低。
(2)厌氧微生物强化修复过程中,地下水中分段PHCs浓度占比均呈现中短链石油烃占比下降趋势,甚至完全降解,PHCs污染晕的范围随修复的进行明显减小。
(3)强化菌株C8降解PHCs(C<22)过程符合假一级动力学。投加生物表面活性剂-鼠李糖脂和电子受体硝酸盐氮后14 d内,地下水PHCs(C<22)降解速率为0.056 1~0.177 9 d-1,受外源投加因素影响大。同时,投加鼠李糖脂和硝酸盐氮条件下PHCs(C<22)降解速率最高,其次是只投加鼠李糖脂,均明显高于单一添加强化菌株C8。表面活性剂诱导下,同时提供充足电子受体,有利于刺激和强化菌株C8的厌氧降解作用。
(4)菌株C8降解PHCs(C<22)28 d后主要依靠菌株自身降解PHCs能力,降解速率为0.044 1~0.059 6 d-1,半衰期为11.63~15.72 d,地下水修复区域厌氧微生物强化修复作用远强于自然衰减作用,降解效率至少提高50%以上。
