不同品系杜氏藻的多相特征研究
2021-07-17尹旭岗吕俊平南芳茹刘旭东谢树莲
高 帆 尹旭岗 冯 佳 吕俊平 刘 琪 南芳茹 刘旭东 谢树莲
(山西大学生命科学学院, 太原 030006)
杜氏藻(Dunaliella)属于绿藻门(Chlorophyta),绿藻纲(Chlorophyceae), 团藻目(Volvocales), 杜氏藻科(Dunaliellaceae), 多分布于盐湖、海洋及湿地,单细胞, 无细胞壁, 可进行无性或有性生殖, 是一类特色微藻资源[1]。杜氏藻耐盐性较强, 在代谢水平上, 该藻主要通过甘油合成代谢来调节胞内外渗透压平衡[2]; 在细胞水平上, 该藻可通过质膜ATPase泵驱动钠/氢离子的吸收与释放来响应盐胁迫[3]; 在分子水平上, 该藻可通过耐盐基因的差异表达来应答不同浓度的盐胁迫[4]。杜氏藻易繁殖, 可提取天然β-胡萝卜素、甘油等高附加值产品, 还可固定CO2, 可有效减缓温室效应, 已广泛应用于食品、医药和化妆品等工业领域[5]。
目前, 国内外对于杜氏藻属的研究多限于局部范围内部分品系的分类鉴定[6]、耐盐机理机制的探索[7]、代谢途径中关键基因挖掘及活性产物的特性研究[8]。藻类研究者从形态和分子水平已鉴定到杜氏藻属种类共28个[9,10], 然而对于不同地理来源的多种杜氏藻资源, 其多相化分类研究仍然很少, 这在一定程度上限制了国内外杜氏藻的系统分类和多样性研究。杜氏藻广谱耐盐, 研究者们已探索了杜氏藻的部分盐胁迫应答机制, 耐盐基因及其代谢途径[11—13], 但相关研究多以模式藻株D. salina为实验材料[14,15], 杜氏藻属的耐盐普通机制仍须系统深入地研究。我国土壤盐渍化严重, 挖掘高耐盐杜氏藻特色品系, 为深入探究其盐胁迫响应普适机制,进而利用生物手段改良盐碱地具有重要的现实意义。
本研究以国内外不同来源的20株杜氏藻为研究对象, 对其进行形态学、生理生化和分子水平的多相化特征研究, 筛选特色耐盐藻株的同时, 进一步揭示了杜氏藻属不同品系间的系统发育关系。研究结果可为杜氏藻属的分类鉴定、特色资源的筛选与保护、以特色藻株为生物反应器进行活性产物的工业化开发与利用奠定基础。
1 材料与方法
1.1 实验材料
在山西运城盐湖进行采样, 辅以国内外藻种库搜集, 共获得20株不同地理来源的杜氏藻藻株(表1)。

表1 国内外不同品系杜氏藻信息Tab. 1 Information of Dunaliella in the world
1.2 藻株培养及杜氏藻属鉴定
藻株在分离纯化后, 以实验室前期优化的BG11培养基(3 g/L NaCl, 1.5 g/L NaNO3, 0.04 g/L K2HPO4,0.075 g/L MgSO4·7H2O, 0.036 g/L CaCl2·7H2O, 0.02 g/L Na2CO3, 0.006 g/L C6H8O7, 0.006 g/L C6H10FeNO8,1000 mL ddH2O定容)对20株杜氏藻进行室内扩大培养。在培养过程中定期通过显微镜观察藻株生长状态, 排查有无染菌, 每20天左右注入少量新鲜培养基补充液保证总体积不变。以1株实验室前期已鉴定的Dunaliellasp. YC01[16]为参考, 利用18S rDNA对20株杜氏藻进行属内初步鉴定。利用CTAB法[17]提取60d左右的藻株DNA, 18S rDNA扩增正向引物: 5′-TTGGGTAGTCGGGCTGGTC-3′,反向引物: 5′-CGCTGCGTTCTTCATCGTT-3′。18S rDNA-PCR的反应体系(25 μL)为: 2.5 μL dNTPs(2 mmol/L), 1.5 μL Mg2+(25 mmol/L), 1 μL DNA,0.3 μLTaq酶(5 U/μL)和2.5 μL 10×反应缓冲液,1 μL引物对, ddH2O补齐。PCR反应程序为: 94℃5min, 94℃ 40s, 53℃ 40s, 72℃ 1min, 循环35次后72℃延伸10min。扩增产物经华大基因测序验证后, 利用MEGA 6.0及最大似然法(Maximum likelihood)构建系统发育树。
1.3 基于ITS的杜氏藻系统发育分析
ITS序列扩增同1.2的方法, 提取杜氏藻DNA。设计并合成杜氏藻ITS扩增通用引物对(正向引物: 5′-GGAAGGAGAAGTCGTAACAAGG-3′,反向引物: 5′-TCCTCCCTTATTGATATGC-3′)。ITS-PCR反应体系、反应程序同1.2。电泳检测并收集800—1000 bp特异性扩增产物。纯化后送华大基因测序。
系统发育树构建ClustalX2.0联合MEGA6.0软件对测序数据进行比对, 利用MEGA6.0软件中Modles模块进行ITS替换矩阵极大似然估计, 根据Tamura-Nei模型估算碱基替代模式和比率[18]。利用MEGA6.0软件的Distance模块计算遗传距离, 选择成对计算模式。利用MEGA6.0和MrBayes 3.1.2软件, 基于最大似然法、临接法(Neighbour-joining)和贝叶斯法(Bayesian)分别构建系统发育树, 后验概率表示拓扑结构支持率[19]。外类群物种选用莱茵衣藻(Chlamydomonas reinhardtii)。
1.4 基于cox2-3的杜氏藻系统发育分析
同1.2的方法, 提取杜氏藻DNA。设计并合成杜氏藻cox2-3扩增通用引物对(正向引物: 5′-AC CAGCATTATTCTTATTAGTAG-3′, 反向引物: 5′-CCAATTAATAATGGTAAAAT-3′), 扩增产物大小约500 bp左右,cox2-3-PCR反应体系、反应程序同1.2。外类群物种同样选用莱茵衣藻(C. reinhardtii)。cox2-3的系统发育树构建方法同1.3。
1.5 细胞密度及耐盐性测定
以实验室前期对杜氏藻细胞的监测结果[16,20],利用紫外-可见光分光光度计测定685 nm处的藻液吸光值, 绘制OD685-藻细胞密度标准曲线, 测算优化培养基配方条件下不同生长时期的杜氏藻细胞密度。富集新鲜藻细胞, 以3×104个/mL接种浓度,约100 mL的接种量分别接种到含0、0.5、1.0、2.0和4.0 mol/L NaCl的1000 mLBG11培养液中, 最终的NaCl浓度梯度为: 0.005、0.46、0.91、1.82和3.64 mol/L, 每个盐度设置3个平行。
1.6 生理生化指标测定
光合效率测定参考常毅洪等的方法[21], 将0.46 mol/L NaCl胁迫条件下的藻液在不同生长周期(5d、15d、30d和60d)分别暗适应30min后, 利用MINI-PAM(WALZ, 德国)超便携式调制叶绿素荧光仪测定不同杜氏藻品系的最大荧光产量(Fm), 可变荧光产量(Fv), 计算PSII的潜在最大光合能力(Fv/Fm)。
中性脂含量测定取0.46 mol/L NaCl胁迫条件下的100 mL成熟期藻液(60d左右), 参考Takagi等[22]的方法, 测定不同品系杜氏藻的中性脂干重。
β-胡萝卜素含量测定取0.46 mol/L NaCl胁迫条件下的5 mL成熟期藻液(60d左右), 参考王婷等[20]的方法分离杜氏藻的β-胡萝卜素提取液, 绘制OD480-β-胡萝卜素含量标曲, 测定不同品系杜氏藻的β-胡萝卜含量。
3-磷酸甘油磷酸酶活性测定取0.46 mol/L NaCl胁迫条件下的5 mL成熟期藻液(60d左右),参考Hunt等[23]的方法, 测定3-磷酸甘油磷酸酶酶活性, 酶活单位以每mg蛋白每小时释放无机磷的μg数表示[μg Pi/(mg·pro·h)]。
2 结果
2.1 杜氏藻的鉴定与系统发育分析
由20株杜氏藻的18S rDNA系统发育树可知,所有藻株间的亲缘关系较近(以Dunaliellasp. YC01为参考), 均属于杜氏藻属, 可用于下一步种内的系统发育分析。
20株杜氏藻ITS的PCR扩增结果均呈阳性。在杜氏藻ITS基因中, A和G之间的替换率最高(A/G:13.71, G/A: 14.54), 其他碱基间的替换率较低(表2)。杜氏藻ITS基因间的遗传距离为0.01—0.58。将最大似然树、邻接树和贝叶斯树结合, 以邻接树为模板作为结合树形, 并在节点处辅以3种算法的支持率进行显示(图1A)。杜氏藻ITS系统发育结果显示, 20株杜氏藻品系整体亲缘关系较近(各分支的支持率相对较高, 与外类群显著分离), 大体可分为两簇。第一簇中D19和D20间的支持率达100/1/100,证实这2个品系确为D. salina, D1和D5间的支持率也为100/1/100, 推测它们极可能为同1个品系, 也提示了两者的原始鉴定记录或有偏差。第二簇中D7、D11、D12、D15和D18间的支持率达100/1/100, 表明5株杜氏藻间遗传关系很近, 但其中又有遗传变异存在, 如D7与D12间仍存在部分差异(支持率: 74/−/89)。
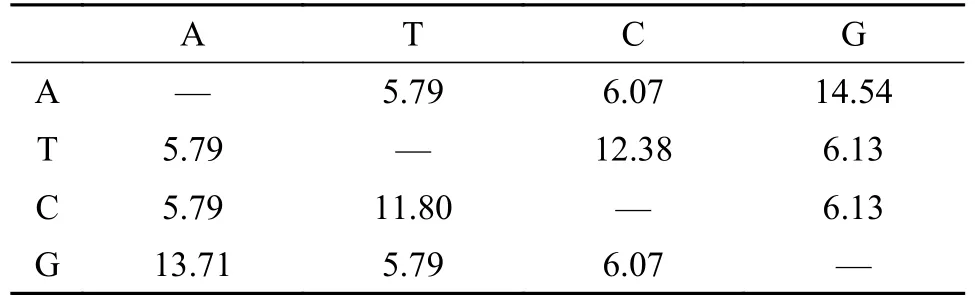
表2 杜氏藻ITS碱基替换矩阵的极大似然估计Tab. 2 Maximum likelihood estimation of ITS base substitution matrix in Dunaliella
20株杜氏藻cox2-3的PCR扩增结果均呈阳性。在杜氏藻cox2-3基因中, G和A、T和C之间替换率最高(A/G: 19.15, T/C: 15.21), 其他碱基间的替换较低(表3)。杜氏藻cox2-3基因间的遗传距离为0.01—0.68。杜氏藻的cox2-3系统发育结果显示(图1B), 20株品系可划分为两簇且亲缘关系较为接近(各分支的支持率相对较高, 与外类群显著分离)。第一簇的D1、D2、D3、D4、D9和D10遗传关系较近(支持率: 99/−/77), 聚为一个分支; D5、D6、D16和D17则依次单独聚为旁支。第二簇中的D13单独聚为一支, D7与D12聚为另一支且亲缘关系较近(支持率: 99/1/100); D8、D11、D14、D15、D18、D19和D20聚为另一个分支(支持率: 89/1/65),其中D11与D15亲缘关系极近(支持率: 100/1/100),推测它们可能属同一品种, 同时也提示两者的原始鉴定记录或有偏差。
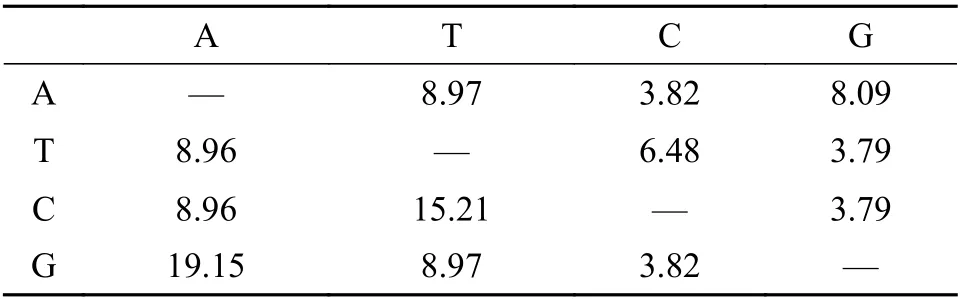
表3 杜氏藻cox2-3碱基替换矩阵的极大似然估计Tab. 3 Maximum likelihood estimation of cox2-3 base substitution matrix in Dunaliella

图1 基于ITS和cox2-3的20株杜氏藻系统发育树Fig. 1 Phylogenetic trees of 20 strains of Dunaliella based on ITS and cox2-3
2.2 杜氏藻形态多样性
观察20株杜氏藻60d左右的形态(图2A和2B),总结其主要形态学特征(表4)。
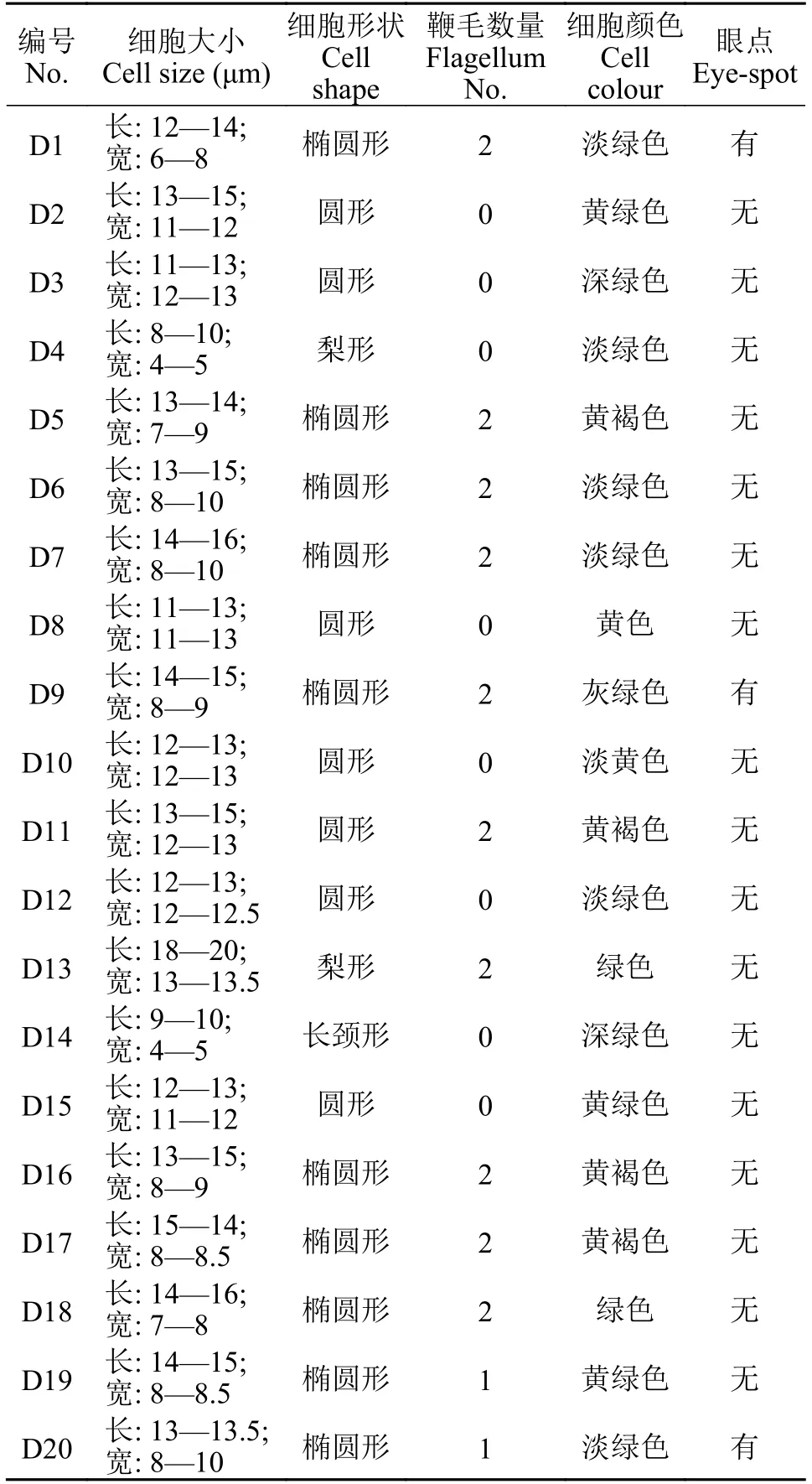
表4 杜氏藻细胞形态指标Tab. 4 Morphological indicators of Dunaliella cells

图2 20株杜氏藻成熟期形态Fig. 2 Morphology of 20 strains of Dunaliella at maturity phase
不同品系杜氏藻60d左右的细胞大小显示:D13体型最大(细胞长18—20 μm, 细胞宽: 13—13.5 μm), D4和D14体型最小(细胞长8、9—10 μm,细胞宽4—5 μm), 体积相差近6倍, 这可能与其品系的天然遗传特征有关, 其他品系则体型差异较小。从细胞形状看, D1、D5、D6、D7、D9、D16、D17、D18、D19和D20为椭圆状, D2、D3、D8、D10、D11、D12和D15为圆形, D4和D1为梨形,D14为长颈形。多样的细胞形态可能与其适应环境渗透压胁迫能力有关。与从细胞颜色看, D1、D4、D6、D7、D12和D20为淡绿色, D5、D11、D16和D17为黄褐色, D2、D15和D19为黄绿色,D3和D14为深绿色, D13和D18为绿色, D8为黄色,D9为灰绿色, D10为淡黄色。细胞微观颜色与宏观藻液颜色多数一致, 少数存在偏差, 这可能与其不同的细胞密度有关。从有无鞭毛看, D1、D5、D6、D7、D9、D11、D13、D16、D17和D18具有2条等长的鞭毛; D19与D20只发现1条鞭毛, 其余藻株均未发现鞭毛存在, 表明这些藻细胞未发育或鞭毛退化消失, 游动能力差, 更适合静态水域或湿地生存。D1、D9和D20发现眼点, 其余藻细胞均未发现, 表明这3株品系感光性更强。
2.3 杜氏藻生长周期及耐盐性
由图3A可知, 20株杜氏藻在0—15d内的细胞密度增长量较低, 平均增幅(177±12)×103/mL, 为生长延迟期。在15—50d, 各品系藻细胞密度快速增长, 平均增幅(3859±168)×103/mL, 为对数生长期, 其中D6和D10生长速度最快(第45天左右即达到最大生物量), 可作为工业化快速培养的特色品系。在50—60d, 多数品系的藻细胞生长速度减缓, 各品系藻细胞密度平均增幅(590±21)×103/mL, 进入稳定期生长期。从第60天以后, 多数品系的藻细胞密度呈缓慢下降趋势, 仅D15仍缓慢生长, 但增幅仅(140±8)×103/mL, 显示其生长能力较差。
由图3B可知, 在杜氏藻的成熟生长期(60d左右), 不同品系的耐盐性各不相同。在微量NaCl(0.005 mol/L NaCl)胁迫条件下, D2藻细胞密度最大, 达(1107±10)×103/mL, 显示该品系也可适应淡水环境。在0.46和0.91 mol/L NaCl胁迫条件下, D6藻细胞密度均最大, 分别达到(4947±17)×103/mL和(4767±24)×103/mL, 表明该藻株为低耐盐品系。在1.82 mol/L NaCl胁迫条件下, D5藻细胞密度最大,达(3507±17)×103/mL, 表明该藻株为中度耐盐品系。在3.64 mol/L NaCl胁迫条件下, D18藻细胞密度最大, 达(1564±13)×103/mL, 表明其为高耐盐品系, 适合作为藻类耐盐机制研究的实验材料。
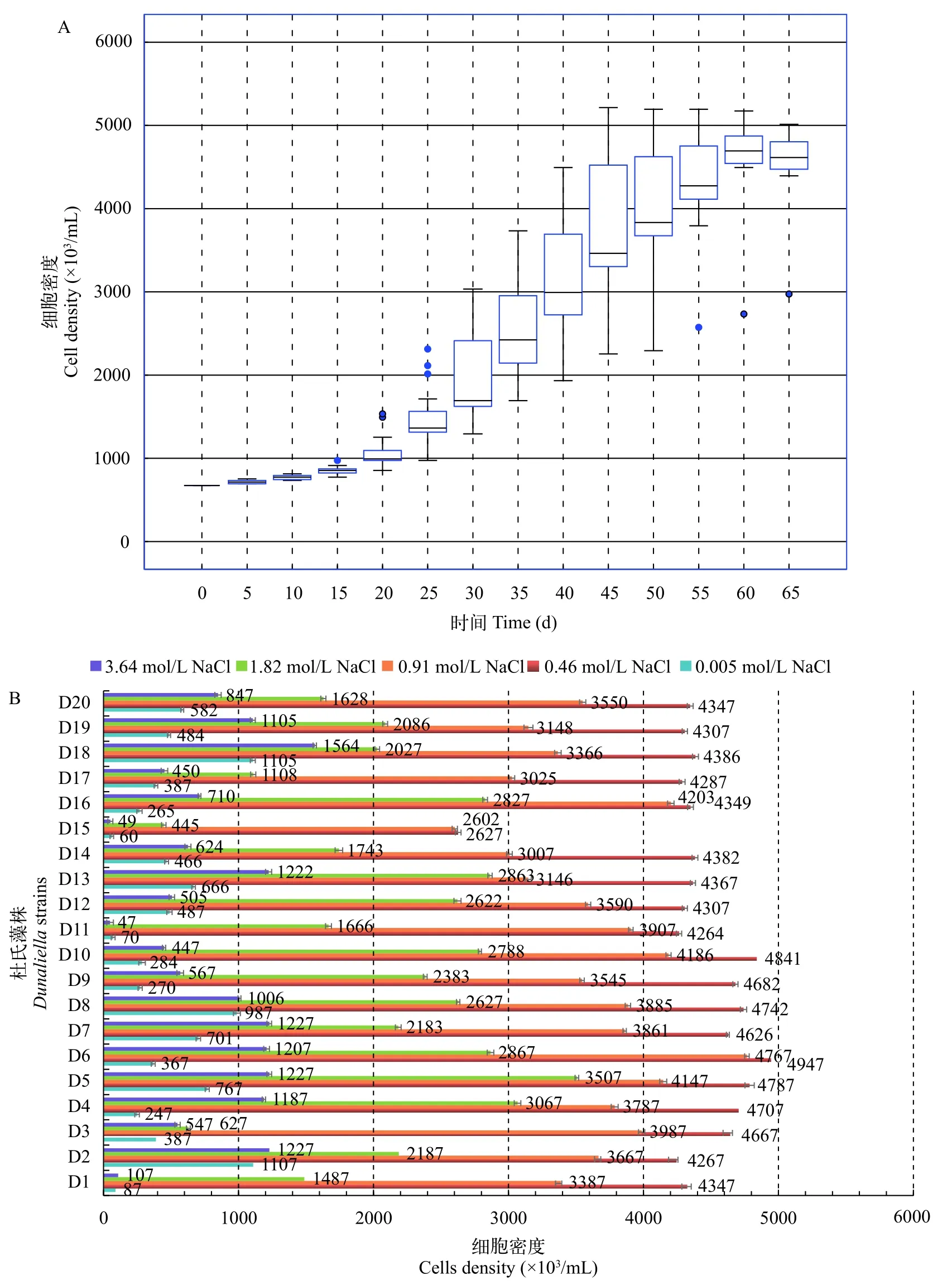
图3 20株杜氏藻细胞密度及耐盐性Fig. 3 Cell density and salt tolerance of 20 strains of Dunaliella
2.4 杜氏藻生理生化特征
由图4A可知, 不同生长阶段的杜氏藻最大光合效率各不相同, 总体变化趋势是先下降后升高。在第5天, D9的Fv/Fm值最大(0.62±0.082), 表明该品系在生长延迟期光合效率较高。在第15、30和60天, D7的Fv/Fm值均最大, 分别达到0.28±0.079、0.23±0.059和0.55±0.130, 表明该品系在整个生长周期内(延迟期除外)的光合效率最高。
一般来说, 杜氏藻生物量越大, 胞内中性脂积累量越高[24]。因此, 杜氏藻成熟期的中性脂含量侧面反映了其产脂能力。由图4B可知, D6和D18的中性脂干重最高, 分别达到(2.77±0.044)和(2.78±0.028) mg/mL, 属于高产油品系, 适合用于藻类生物柴油的开发与利用。D15的中性脂干重最低, 仅(1.36±0.035) mg/mL, 为低产油品系。
同中性脂积累相似, 杜氏藻成熟期的β-胡萝卜素含量反映了其次生代谢产物的产出能力[25]。由图4C可知, D11的β-胡萝卜素含量最高, 每100 mL藻液可提取β-胡萝卜素(86.26±2.05) mg, 可作为β-胡萝卜素生产加工的适用品系。
3-磷酸甘油磷酸酶是杜氏藻甘油合成代谢的关键酶之一[26], 其酶活力的测定对于高产油杜氏藻特性的研究可提供参考。由图4D可知, 成熟期的D7在90min内酶活力均处于较高水平, 最高达27.38 μg Pi/(mg·pro·h)(75min), 结合其较高的中性脂积累能力(2.64±0.033) mg/mL(图4B), 推测该藻株亦属高产油品系, 可作为微藻脂类代谢的实验研究。

图4 20株杜氏藻生理生化指标测定Fig. 4 Determination of physiological and biochemical indexes of 20 strains of Dunaliella
3 讨论
ITS序列是植物系统分类研究中常用的参考基因,cox2-3则常用于动物物种的分类学研究。藻类尤其是鞭毛藻从进化上更接近于植物, 但从功能上又有原生动物的某些特征[27]。鉴于此, 本研究同时选用上述2种基因并结合3种不同算法对20株杜氏藻资源进行系统发育研究。为避免生物数据库相关藻类基因信息的误差, 本研究对20株藻的ITS和cox2-3基因进行了重新扩增并测序, 增加了结果的可信度。从2个基因的分析结果看, 2种系统发育分析结果整体较一致, 海洋品系(D3、D9和D10)在2种预测结果中均聚为一簇, 其他盐湖品系的聚类结果无显著与地理性相关的特征。本研究的杜氏藻系统发育结果较以往研究者利用传统单一基因联合已报道生物数据建树结果[6,10]更加可靠, 适用于藻类, 尤其是微藻的系统发育研究。
张会永等[28]对7株杜氏藻的RAPD分析结果发现,D. bioculata、D. parva、D. pericei和D. primolecta亲缘关系较近。上述藻株对应本研究品系分别为D4/D15、D6、D7和D9。2种基因的系统发育结果同时显示, D4、D6和D9聚为一类, D7和D15聚为一类, 这部分验证了张会永等[28]的研究结果, 差异可能是由于系统分类的遗传标记不同所致。D. pericei与其他杜氏藻品系的遗传关系仍待进一步研究。王伟等[6]、姜玮等[29]和王冬梅等[30]通过不同基因的系统进化分析发现,D. viridis与其他杜氏藻品系间亲缘关系均较近。本研究利用2种不同的基因构建系统发育树, 发现2种建树结果中, 2株D. viridis品系(D2和D12)同时分别被划分在2个不同的分支且与其他品系亲缘关系较近, 这提示了D. viridis可能是20株品系中更古老的种类。鉴于搜集的少数杜氏藻种类与系统发育结果不一致, 我们不排除藻株最初鉴定结果有误差。目前, 模式杜氏藻D. salina的细胞器基因组[31]和核基因组序列(版本: NSFN00000000.1)已经公布, 下一步搜集全球范围内更多杜氏藻资源, 利用基因组重测序或泛基因组技术对其进行基因组或泛基因组水平的进化分析, 将有助于全面揭示杜氏藻属的起源与进化问题。
20株杜氏藻细胞形态整体相似, 但仍有一定差异, 其原因首先可能是遗传变异的影响, 这种影响可能不仅局限于不同种间, 同种不同品系间的差异也会存在, 如D13和D14同为D. salina, 但前者细胞体积远大于后者, 而后者细胞形态呈独特的长颈形。其次, 尽管杜氏藻广谱耐盐, 但当不同品系遭遇不同浓度盐胁迫时, 细胞形态可能发生适应性改变, 这种改变可能与藻细胞调节渗透压平衡的能力有关。另外, 一些品系观察到鞭毛和眼点, 鞭毛(含信号转导和能量代谢相关蛋白)和眼点(具感光性)均有助于杜氏藻逃逸或应答不利环境[32], 而稳定的栖息环境往往可能导致它们的功能退化甚至突变消失。
综合20株杜氏藻资源的耐盐性及4项代表性生理生化指标值, 我们发现, 耐盐性越强的品系, 其中性脂的积累量及3-磷酸甘油磷酸酶活性往往较高。研究显示[33], 脂类代谢尤其是甘油酯代谢与杜氏藻的耐盐性紧密相关, 高渗透压环境往往加速了藻细胞的脂代谢过程及相关酶活性, 而大量的油脂又进一步缓解了细胞膜的渗透压, 保证藻细胞耐受高盐环境。光合效率较强的杜氏藻细胞, β-胡萝卜素合成量一般较高。作为类胡萝卜素的一种, β-胡萝卜素合成量往往提示了该藻株的可见光吸收能力, 光合效率主要反映细胞对叶绿素合成代谢水平[34],两者有一定的联系但并非完全正相关。
4 结论
本研究以国内外不同地理来源的20株杜氏藻资源为研究对象, 从系统发育、形态和生理生化水平对其进行多相特征研究。结果表明, 20株杜氏藻的ITS和cox2-3系统发育树均划分为2大簇, 尽管少数品系拓展支持率略有差异, 但各品系间的亲缘关系仍较为相近。杜氏藻形态多样, 其中D13细胞体积最大, D14体积最小且呈独特长颈形, 藻细胞颜色多以绿色或黄绿色为主, 一些品系不具鞭毛和眼点。D6和D10生长速率快, 可用于杜氏藻工业化大规模培养。D18耐盐性最强, 可用于耐盐基因挖掘与盐胁迫响应机制的深入研究。在优化培养条件下, D7最大光合效率最高, 可用于杜氏藻光合与呼吸作用的研究。D6和D18富油能力最强, 可用作生物柴油研制的特色材料。D11的β-胡萝卜含量最高, 可作为工业提取胡萝卜素的生物原料。D7的3-磷酸甘油磷酸酶活性最强, 可用于杜氏藻甘油酯代谢调控机制的研究。研究结果为杜氏藻资源的挖掘与保护, 特色品系工业化开发与利用奠定了基础。
