紫苏叶可促进中国大鲵生长并改善部分生理功能
2021-07-17徐杭忠李伟龙陈拥军翟旭亮
徐杭忠 李伟龙 罗 莉 陈拥军 李 虹 翟旭亮 薛 洋 熊 林
(1. 西南大学水产学院, 重庆市水产科学重点实验室, 淡水鱼类资源与生殖发育教育部重点实验室, 重庆 400715;2. 重庆市水产技术推广总站, 重庆 401121; 3. 重庆市开州区水产技术推广站, 重庆 405400)
中国大鲵(Andrias davidianus), 俗称“娃娃鱼”,是重要的野生动物资源, 目前多种因素导致其野生种群数量下降, 而人工增殖放流是重要的主动保护对策。目前, 大鲵人工养殖技术逐渐成熟, 但饲料供给方面相对滞后[1]。本研究团队经5年的技术攻关, 开展了对大鲵的配合饲料原料优选、蛋白质需求量评定、脂肪需求量评定、桑叶提取物添加效果评价、饵料鱼与配合饲料饲喂效果对比、矿物质预混料与维生素预混料开发等方面的研究工作[2—5],创制了大鲵人工配合饲料并在重庆、四川、陕西、浙江、贵州和广西等地成功示范, 目前正在开展推广优化工作。
野生大鲵对生活环境要求严格, 养殖条件下出现应激反应在所难免。如何在日粮满足蛋白质和脂肪等营养素需求的前提下, 维护养殖动物的生理健康和提高对环境的适应能力也是营养学研究的重要内容。依据民间对紫苏传统的利用方法及其在养殖动物日粮中的初步应用情况[6], 本实验研究了不同添加水平的紫苏叶对中国大鲵生长、胃肠功能、肝脏健康、免疫及脂质代谢的影响, 旨在探讨中国大鲵配合饲料中紫苏叶的生物学效果。为大鲵饲料配方的优化改进提供技术指导, 同时为紫苏叶在水产饲料中的开发应用提供一定的科学参考。
1 材料与方法
1.1 实验材料
实验所需中国大鲵(陕西种, 子二代)购于陕西省汉中市绿源大鲵养殖场, 紫苏叶由重庆科峰新技术开发有限公司提供, 其他饲料原料均购于重庆大发饲料有限公司。
1.2 实验饲料
根据大鲵的营养需求, 配制以鱼粉、鸡肉粉和鱼油等为原料的大鲵基础饲料, 以基础饲料为对照组, 在其基础上分别添加1%、2%和3%含量的紫苏叶(实验用紫苏叶实测干物质含量85.05%, 粗蛋白含量23.13%和粗脂肪含量7.78%), 配制成4种等氮等脂的实验饲料, 分别命名为D0、D1、D2和D3。饲料原料粉碎后过40目网筛, 用软颗粒饲料制粒机(四川棉丰农业机械制造厂 9FZ-35C 型)制成直径4 mm左右的颗粒, 自然风干, 双层塑料袋包装并封口, –20℃冰箱保存备用。实验饲料配方及基本营养组成见表1。

表1 实验饲料配方及主要营养成分Tab. 1 Formulation and nutrient composition of the diet (%)
1.3 实验饲养管理
正式实验前, 先将购回的大鲵静养2d, 经1%的食盐水消毒后, 在室内淡水养殖池中暂养饥饿5d,再以大鲵基础饲料(D0)驯食15d。待体质恢复后选择质量均匀(54.23±0.26) g、体质健壮的大鲵128尾,随机分成4组, 每组设置4个重复, 每个重复8尾, 饲养于西南大学水产学院水产养殖系统的蓝色塑料方形箱中, 规格70 cm×45 cm×17.5 cm, 水深5 cm,水源为曝气自来水, 每天早晚各100%换水1次。因大鲵消化食物时间较长, 故连续投喂2d(17:30)后停食1d, 投喂3h后捞取残饵, 每隔3周称重1次, 然后根据实验大鲵的增重情况调整投喂量, 每次投喂量为大鲵体质量的0.7%—1.0%, 正式实验时间105d。饲养期间无光照, 利用空调维持水温22—25℃, 溶解氧>6.0 mg/L, 氨氮含量<0.10 mg/L, 亚硝酸盐含量<0.10 mg/L, pH 6.5—7.5。
1.4 样品采集
大鲵养殖实验结束后饥饿72h, 每组每个重复随机选取6尾大鲵用适量MS-222麻醉, 称重后用1 mL的一次性无菌注射器在尾静脉处取血, 4500 r/min离心10min制备血浆放入液氮罐中速冻后, 转入–80℃冰箱内保存, 用于血浆生化指标测定。后将大鲵于冰上解剖, 取出完整内脏团和肝脏, 分离胃、肠道和背部肌肉样品, 液氮速冻后, 转入–80℃冰箱保存备用。
1.5 指标测定
生长指标测定: 在养殖实验结束后, 停食72h,准确称量各组大鲵体质量和饲料质量, 计算其生长指标, 计算公式如下:

式中,W0为鲵初始尾均重(g);Wt为鲵终末尾均重(g);D为养殖实验天数;F为尾均干物质摄食量(g);N0为初始尾数;Nt为终末尾数。
实验饲料及肌肉常规营养成分的测定: 水分含量测定采用105℃恒温干燥法(GB/T 6435-2006), 粗蛋白(CP)含量测定采用凯氏定氮法(GB/T 6432-1994), 粗脂肪(CL)含量测定采用索氏抽提法(GB/T 6433-1994)。
抗氧化指标测定: 总抗氧化能力(T-AOC)、总超氧化物歧化酶(T-SOD)活性和丙二醛(MDA)含量采用南京建成生物工程研究所生产的试剂盒测定。
消化酶指标测定: 胃蛋白酶、胰蛋白酶、脂肪酶、淀粉酶、H+-K+-ATP酶和Na+-K+-ATP酶活性采用南京建成生物工程研究所生产的试剂盒测定。
肠黏膜通透性指标测定: 二胺氧化酶(DAO)活性、内毒素(LPS)和D-乳酸(D-LA)含量采用上海优选生物科技有限公司生产的Elisa试剂盒测定(公司代测)。
肝功能和血浆免疫指标测定: 谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(AKP)活性和一氧化氮(NO)含量采用南京建成生物工程研究所生产的试剂盒测定; 免疫球蛋白M(IgM)含量采用上海优选生物科技有限公司生产的Elisa试剂盒测定(公司代测)。
血浆脂质成分测定: 甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)含量采用南京建成生物工程研究所生产的试剂盒测定。
1.6 数据处理
实验结果用SPSS 22.0对数据进行单因素方差分析(One-Way ANOVA), 用Duncan氏多重比较分析组间差异显著性程度, 显著水平为(P<0.05), 数据用平均值±标准差(Mean±SD)形式表示。
2 结果
2.1 紫苏叶对大鲵生长性能及饲料利用的影响
随着饲料中紫苏叶添加量的增加, 大鲵FBW、WGR和SGR均呈先升后降趋势, 在D2组出现最大值(P<0.05), 较D0组分别升高了34.61%、99.79%和68.29%;FCR则随紫苏叶添加量的增加呈先降后升趋势, 在D2组出现最小值(P<0.05), 较D0组下降了24.00%; 存活率各组间差异不显著(P>0.05; 表2)。

表2 紫苏叶对大鲵生长性能及饲料利用的影响Tab. 2 Effects of perilla leaf on growth performance and feed utilization of Andrias davidianus
2.2 紫苏叶对大鲵摄食量的影响
在养殖过程中每3周为1周期, 计算大鲵不同阶段的摄食量。第1阶段(0—3周), 各组间摄食量差异不显著(P>0.05); 第2、第3和第4阶段(分别为3—6周、6—9周和9—12周), D2和D3组大鲵摄食量均显著高于D0组(P<0.05); 综合4个阶段发现:D0组大鲵摄食量先略微上升后趋于平稳, 而D1、D2和D3组均有持续上升趋势; 且D2组摄食量增长速率大于D3组, D3组增长速率大于D1组(表3)。

表3 紫苏叶对大鲵阶段摄食量的影响Tab. 3 Effects of perilla leaf on feed and feed efficiency intake of Andrias davidianus
2.3 紫苏叶对大鲵肌肉营养组成的影响
随着饲料中紫苏叶添加量的增加, 大鲵肌肉粗蛋白含量呈先升后降的趋势, 在D2组出现最大值(P<0.05), 较D0组提高了5.70%; 粗脂肪含量呈持续下降趋势, 但各组间差异不显著(P>0.05); 水分含量各组间差异不显著(P>0.05; 表4)。

表4 紫苏叶对大鲵肌肉营养组成的影响(鲜样)Tab. 4 Effects of perilla leaf on muscular composition of Andrias davidianus (fresh, %)
2.4 紫苏叶对大鲵肝脏和肠道抗氧化能力的影响
随着饲料中紫苏叶添加量的增加, 大鲵肝脏总抗氧化能力(T-AOC)和总超氧化物歧化酶(T-SOD)活性均呈先升后降趋势, 并均在D2组出现最大值(P<0.05), 较D0组分别提高了29.57%和46.54%; 丙二醛(MDA)含量则呈先降后升的趋势, 在D2组出现最小值(P<0.05), 较D0组下降了38.89%; 大鲵肠道T-AOC和T-SOD活性也呈先升后降趋势, 均在D2组出现最大值(P<0.05), 较D0组分别提高了35.24%和85.73%; MDA呈先降后升的趋势, 在D2组出现最小值(P<0.05), 较D0组下降了46.30%(表5)。
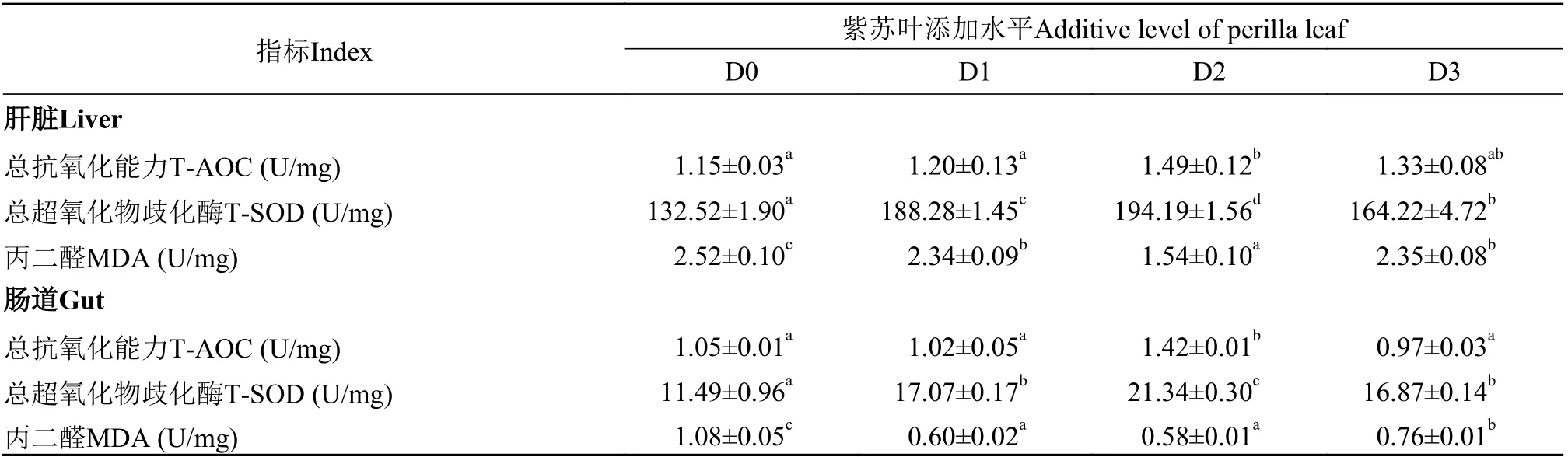
表5 紫苏叶对大鲵肝脏和肠道抗氧化能力的影响Tab. 5 Effects of perilla leaf on liver and gut intestinal antioxidant of Andrias davidianus
2.5 紫苏叶对大鲵胃肠消化吸收能力的影响
随着饲料中紫苏叶添加量的增加, 大鲵胃蛋白酶和H+-K+-ATP酶的活性呈先升后降趋势, 并在D1组出现最大值(P<0.05), 较D0组分别提高了108.20%和65.24%; 胰蛋白酶和淀粉酶呈上升趋势,在D3组出现最大值(P<0.05), 较D0组分别提高了133.00%和61.11%; 脂肪酶和Na+-K+-ATP酶活性则呈先升后降趋势, 并在D2组出现最大值(P<0.05),较D0组分别提高了140.13%和59.53%(表6)。

表6 紫苏叶对大鲵胃肠消化吸收能力的影响Tab. 6 Effects of perilla leaf on intestinal digestion and absorption function of Andrias davidianus
2.6 紫苏叶对大鲵肠黏膜通透性的影响
随着饲料中紫苏叶添加量的增加, 大鲵肠道二胺氧化酶(DAO)活性、内毒素(ET)和D-乳酸(DLA)含量均呈先降后升趋势, 均在D2组出现最小值(P<0.05), 较D0组分别降低了49.25%、66.32%和49.55%(表7)。

表7 紫苏叶对大鲵肠黏膜通透性的影响Tab. 7 Effects of perilla leaf on intestinal mucosal permeability of Andrias davidianus
2.7 紫苏叶对大鲵免疫和肝功能的影响
随着饲料中紫苏叶添加量的增加, 大鲵血浆免疫球蛋白M(IgM)含量呈先升后降趋势, 在D2组出现最大值(P<0.05), 较D0组提高了69.35%; 血浆一氧化氮(NO)含量先略微下降后上升, 在D3组出现最大值(P<0.05), 较D0组上升68.02%; 碱性磷酸酶(AKP)、谷草转氨酶(AST)和谷丙转氨酶(ALT)活性均呈先降后升趋势, AST和ALT在D2组出现最小值(P<0.05), 较D0组分别下降25.68%和17.43%,AKP在D1组出现最小值(P<0.05), 较D0组下降41.23%(表8)。

表8 紫苏叶对大鲵免疫和肝功能的影响Tab. 8 Effects of folium perillae leaf on immune and liver function of Andrias davidianus
2.8 紫苏叶对大鲵脂质代谢的影响
随着饲料中紫苏叶添加量的增加, 血浆中总胆固醇(TC)含量呈下降趋势, 在D3组出现最小值(P<0.05), 较D0组降低37.45%; 甘油三酯(TG)含量各组间差异不显著(P>0.05); 高密度脂蛋白胆固醇(HDL-C)含量呈先升后降的趋势, 在D2组出现最大值(P<0.05), 较D0组提高了40.91%; 低密度脂蛋白胆固醇(LDL-C)含量呈先降后升的趋势, 在D2组出现最小值(P<0.05), 较D0组降低了46.79%(表9)。
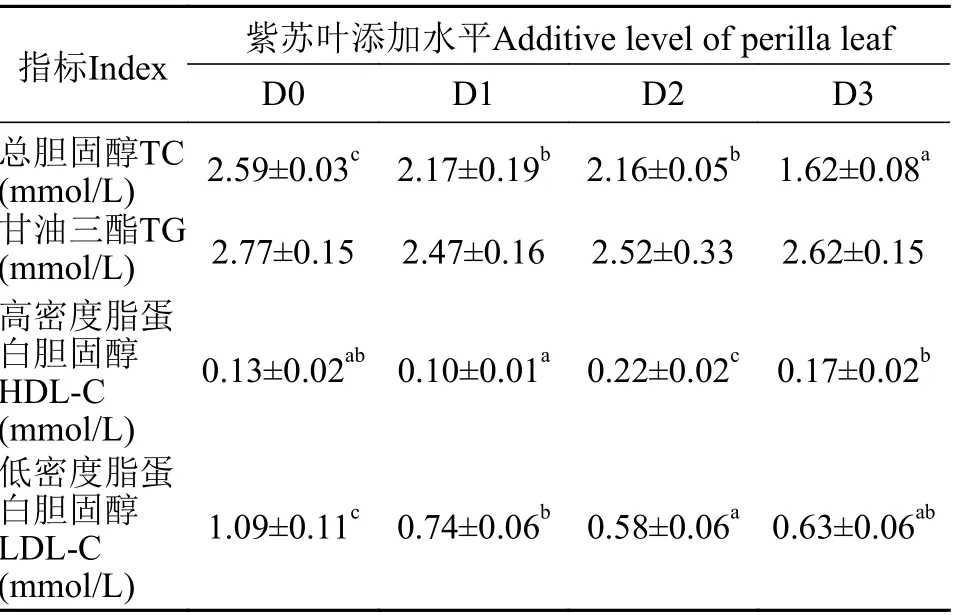
表9 紫苏叶对大鲵脂质代谢能力的影响Tab. 9 Effects of perilla leaf on fat metabolism of Andrias davidianus
3 讨论
3.1 紫苏叶提高了大鲵生长性能与饲料效率
水产养殖使用配合饲料的目标是生产出高品质的水产品, 实现最优的生长率。赵红梅等[8]发现以紫苏等为原料的添加剂有促进仔猪采食、提高日增重与降低料重比的作用。本实验单独添加紫苏叶也取得了类似的结果。在日粮中添加适量紫苏叶, 可明显改善大鲵的终末尾均重、增重率和特定生长率, 降低饲料系数。并且随着养殖实验的进行, 不同组间的摄食量差异逐步显现出来。
动物肌肉营养组成受饲料成分影响。罗庆华等[9]、冷向军等[10]和汤菊芬等[11]研究者发现在鱼类饲料中添加杜仲提取物和大蒜素等中草药或其复合物, 可显著降低肌肉粗脂肪含量, 改善品质。在本实验中, 紫苏叶的添加也改善了大鲵肌肉粗蛋白和粗脂肪的含量。这说明包含紫苏叶在内的部分天然植物原料对养殖产品的肉质改良有一定作用,其具体机理有待进一步研究。
3.2 紫苏叶提高了大鲵抗氧化能力
紫苏叶的抗氧化作用已在医药领域得到证实。总抗氧化能力(T-AOC)是组织内酶促与非酶促抗氧化能力的总和, SOD是水产动物体内抗氧化酶系中的重要成员, 丙二醛是脂质过氧化反应的最终产物。这3个指标可较全面地反映机体的抗氧化能力。本实验将紫苏叶应用于大鲵饲料中, 显著提高了大鲵肝脏与肠道的抗氧化能力。这可能与紫苏叶中含有多种抗氧化物质有关, 如黄酮类、多酚类和迷迭香酸等[6], 对清除自由基都有明显作用。
3.3 紫苏叶改善了大鲵胃肠功能
在饲料中营养物质主要在养殖动物的胃肠中消化吸收, 提高胃肠消化吸收功能是保证养殖动物快速生长的前提。岳崟等[12]在小鼠的研究中发现紫苏叶提取物有促进胃肠消化吸收的作用。本实验测定的H+-K+-ATP酶是胃酸分泌的关键酶, Na+-K+-ATP酶活性与肠道的主动吸收能力呈正相关,其余消化酶对蛋白、脂肪和淀粉的消化起到重要作用。结果显示, 在饲料添加紫苏叶后, 大鲵胃肠中重要消化酶活性、胃酸分泌能力和肠道吸收能力均显著提高。这与多种天然植物或其混合物在多个养殖品种上的添加效果相类似, 这可能与天然植物中富含活性物质与天然植物纤维, 可增强胃肠道功能有关。
血浆中的二胺氧化酶(DAO)主要来源于肠黏膜上皮细胞, 其含量可间接反映肠道黏膜机械屏障的完整性[13]。D-乳酸与内毒素主要是胃肠道内多种细菌的相关产物, 是了解肠道黏膜通透性的重要指标[14]。根据实验中这些指标的变化情况可知,2%紫苏叶添加对增强肠道黏膜的屏障作用效果显著。人工配合饲料中蛋白、脂肪等营养素的氧化变质产物、原料中的抗营养因子等积累到一定程度都会导致养殖动物肠道健康受损。根据本实验的结果可以推断, 在饲料中添加适量紫苏叶可预防并修复肠道损伤, 促进大鲵健康生长。
3.4 紫苏叶改善了大鲵肝脏和免疫功能
张硕等[15]研究发现, 黄酮类化合物具有抗四氯化碳致小鼠肝纤维化的作用, 能够显著降低小鼠血液中AST和ALT活性。紫苏叶中也含有较多的黄酮类化合物。本实验结果也证实适量紫苏叶的添加, 有维持大鲵肝细胞正常结构和功能的作用。目前, 肉食性的水产养殖品种使用人工配合饲料后容易出现肝脏健康问题, 根据紫苏叶保肝的药理作用,及其添加在大鲵饲料中取得的保肝效果, 我们可以推断, 在饲料中添加适量的紫苏叶是一条解决部分养殖品种肝脏健康问题的有效途径。
血浆中IgM的含量可直接反映机体免疫能力,NO含量则与动物机体免疫力呈正相关[16,17]。许友卿等[18]发现在饲料中添加适量杜仲叶粉能提高青鱼(Mylopharyngodon piceus)免疫能力。本实验也得到了类似的结果, 适量的紫苏叶添加可激活大鲵的免疫系统, 改善大鲵的免疫防御能力。
3.5 紫苏叶改善了大鲵脂质代谢
动物脂质代谢异常会引起代谢性疾病, 影响动物生长性能[19]。在本实验中, 与脂质代谢相关的TC、HDL-C和LDL-C指标均有明显改善。但紫苏叶对TG含量影响不大, 可能与甘油三酯的主要功能是为细胞代谢提供能量, 在血浆中含量保持动态平衡有关。本实验结果说明在大鲵饲料中添加适量紫苏叶, 可减少胆固醇在肝脏及血管中的积累,提高鲵体健康水平。
4 小结
在本实验条件下, 大鲵日粮中紫苏叶的适宜添加量为2%。该添加水平对改善大鲵生长性能和胃肠肝功能等方面的综合效果最佳。
