薯蓣粥对T2DM大鼠肠道微生物、血糖、胰岛素的影响
2021-07-17洪雪珮庞书勤罗宗婷张佳惠
洪雪珮,庞书勤,周 建,陈 芳,罗宗婷,张佳惠
(福建中医药大学护理学院,福建福州 350122)
2 型糖尿病(type 2 diabetes mellitus,T2DM)是一种以高血糖为特征的内分泌代谢性疾病,近年来,T2DM 的发病率呈迅速上升趋势,已成为世界范围内的公众健康问题[1−2]。肠道菌群作为“人体的隐藏器官”,是连接环境、基因、免疫系统的重要纽带,在机体代谢、免疫等方面发挥重要作用[3]。肠道菌群能够通过炎性反应、氧化应激等多种途径参与胰岛素信号传导和糖脂代谢,在T2DM 的发生、发展中起到重要作用[4−6]。研究显示,T2DM 改变肠道菌群的多样性,主要表现为减少益生菌、增加有害菌,导致肠道微生态紊乱[5−6]。而补充益生菌、调节肠道微生物群平衡,能够有效改善胰岛素抵抗、降低血糖,延缓T2DM 的病情进展[7],常见的干预手段有直接口服补充益生菌、调整饮食和粪便移植,相比之下,饮食干预更加方便、经济实惠。
薯蓣粥出自近代医家张锡纯的《医学衷中参西录》,仅由一味生怀山药组成[8],山药中含有多种活性成分如山药多糖、抗性淀粉、薯蓣皂苷等,具有抗氧化、调节肠道菌群、降低血脂等作用[9]。课题组前期将薯蓣粥应用于T2DM 患者,连续食用12 周后发现薯蓣粥能够改善T2DM 患者的氧化应激,增加肠道内双歧杆菌的含量,降低血糖[10−11];课题组前期动物实验发现薯蓣粥能够改善T2DM 大鼠胰岛β细胞形态,减少结肠组织的TNF-α、IL-6 含量,提高IL-10、STAT3 表达,即薯蓣粥可能通过改变肠道菌群,减轻炎症水平、改善胰岛细胞功能,达到降低血糖的效果;为进一步明确薯蓣粥具体的降糖机制,现借助动物实验,采用16S-rDNA 测序技术,详细评估薯蓣粥对T2DM 大鼠肠道菌群构成的影响,探讨薯蓣粥是否能够通过改善T2DM 大鼠肠道微生物,增加短链脂肪酸的分泌,达到缓解胰岛素抵抗、降低血糖的效果,为治疗T2DM、探索薯蓣粥的降糖机制提供参考依据。
1 材料与方法
1.1 材料与仪器
SPF 级雄性Wistar 大鼠 60 只,8 周龄,体重(180±10)g,上海斯莱克实验动物有限责任公司,动物许可证号:SCXK(沪)2012-0011,饲养于福建中医药大学动物中心清洁级动物房,实验全程严格遵循《实验动物保护条例》,经福建中医药大学动物实验伦理委员会批准(2019-023);高脂饲料 闽侯实验动物贸易有限公司(中国福州),配方为:10%猪油、15%蔗糖、4%胆固醇、10%蛋黄粉、0.3%胆酸盐、60.7%标准饲料;生怀山药(生铁棍山药) 福州市闽侯县上街致诚医药商店;二甲双胍片 格华止,0.85 g/片,国药准字:H20023371;链脲佐菌素(STZ) Sigma公司;乙酸、丙酸、丁酸、2-乙基丁酸标准品 上海aladdin 生化科技有限公司;DNA 提取试剂盒 福州沃森生物技术有限公司;血糖试纸 福州贝尔曼生物科技有限公司;大鼠胰岛素(INS)酶联免疫分析试剂盒 酶联生物科技有限公司。
罗氏血糖仪 德国拜耳公司;精密电子秤 上海精天电子仪器有限公司;ELX808 型酶联免疫检测仪 美国BIO-TEK 公司;气相色谱-质谱联用仪美国安捷伦公司。
1.2 实验方法
1.2.1 灌胃溶液的制备 薯蓣粥的制备:实验所需山药由同一人员在固定商家分两次购买,放在冰箱内冷藏保存,每日取125 g 已去皮的山药,切片后加水50 mL 放入料理机打成糊状,取出后加250 mL 凉水,中火煮沸,30 s 后再文火煮沸,后再间隔30 s,连煮3 次,过程中轻轻搅拌,最后成粥状,其浓度为0.5 g/mL,冷却至37 ℃灌胃。二甲双胍溶液制备:依据徐叔云《药理实验方法学》[12]的人鼠体表面积等效剂量换算(成人以60 kg 计算),每只大鼠灌胃100 mg/kg·d 二甲双胍,根据大鼠体重计算出每日所需的二甲双胍药量,将所需二甲双胍药物研磨成粉,用5 mL 生理盐水配制成二甲双胍药液,现配现用。联合组灌胃溶液:将每只大鼠所需的二甲双胍溶于5 mL 薯蓣粥内灌胃。
1.2.2 造模 将60 只雄性Wistar 大鼠称重、编号,按数字表法随机选取10 只作为空白组使用普通饲料喂养;剩余50 只大鼠为造模组,使用高脂高糖饲料喂养6 周后造模:腹部注射1% STZ 溶液(避光,现配现用,pH4.2~4.5),计量:25 mg/kg。空白组大鼠腹腔注射等容积的柠檬酸钠缓冲液。注射后72 h 尾静脉采血测量空腹血糖,并观察大鼠饮食、尿量、体重的变化,以空腹血糖>11.1 mmol/L 判断是否造模成功[13]。本次50 只大鼠进行造模,成功37 只,成模率为74%。
1.2.3 分组与给药 将造模成功的37 只大鼠按照随机数字表法分为模型组10 只,薯蓣粥组9 只,二甲双胍组9 只,联合组9 只。给药方法:空白组和模型组每日使用生理盐水灌胃5 mL,薯蓣粥组大鼠每日使用薯蓣粥灌胃5 mL,二甲双胍组每日使用二甲双胍溶液灌胃5 mL,联合组大鼠每日计算所需的二甲双胍药量,溶于5 mL 薯蓣粥内灌胃。所有大鼠均以空白饲料喂养,正常饮水,共干预6 周。
根据前期临床试验中人体食用薯蓣粥的体积,结合人鼠体表面积计算得出大鼠的薯蓣粥灌胃量为5 mL,每5 mL 薯蓣粥中的山药含量为5 mL×0.5 g/mL=2.5 g。
1.2.4 指标检测 灌胃期间每周检测空腹血糖。干预结束后,所有大鼠禁食12 h 后,检测空腹血糖,之后使用2%戊巴比妥钠腹腔麻醉注射,抽取腹主动脉血2 mL,结肠内粪便约5 g(分装成两份)。
1.2.4.1 肠道菌群相关指标 取材后,用干冰密封保存粪便样本送至人和未来生物科技(长沙)有限公司检验部门进行16S-rDNA 测序。检测合格的样本使用Illumina Miseq/Hiseq 2500 双端PE250 对V3-V4区域进行测序,测序得到的下机数据(Raw Data)将用于后期信息分析。
1.2.4.2 短链脂肪酸(乙酸、丙酸、丁酸) 取材后立即将分装好的粪便标本用干冰密封保存送至福州市沃森生物科技有限公司,使用气相色谱法检测粪便内短链脂肪酸含量。
1.2.4.3 胰岛素水平 取材后立即将抽取的血样本送至武汉市塞维尔生物科技有限公司,使用ELISA法监测血清内胰岛素含量。使用公式计算胰岛素抵抗水平:胰岛素抵抗指数(HOMA-IR)的计算公式为:胰岛素抵抗指数=(空腹血糖×空腹胰岛素)/22.5。
1.3 数据处理
采用SPSS20.0 软件进行统计分析,描述性数据使用均数±标准差表示,计量资料符合正态分布时采用单因素方差分析,否则用秩和检验,以P<0.05 为差异有统计学意义。使用Fastp 软件对16S-rDNA测序得到微生物样本的Raw reads 数据进行质量过滤,得到更准确可靠的Clean Reads,再对Clean Reads基于Overlap 进行拼接得到Clean Tags。然后基于有效数据进行OTUs(Operational Taxonomic Units)聚类和物种组成分析。
2 结果与分析
2.1 大鼠一般情况
实验第一周,模型组死亡1 只,联合组死亡2 只。最后纳入统计分析的各组大鼠数量为:空白组10 只、模型组9 只、薯蓣粥组9 只、二甲双胍组9 只,联合组7 只。实验过程中,模型组大鼠精神萎靡,毛发脏乱,摄食量、饮水量与尿量增加。
2.2 各组大鼠血糖水平比较
由表1可知,干预期间空白组大鼠的空腹血糖维持在正常范围,模型组大鼠始终高于11.1 mmol/L,极显著高于空白组(P<0.01)。从干预第4 周起直至干预结束,薯蓣粥组大鼠的空腹血糖极显著低于模型组(P<0.01);干预结束后,薯蓣粥组大鼠的空腹血糖和二甲双胍组相比无统计学差异(P>0.05),薯蓣粥组大鼠的空腹血糖显著高于联合组(P<0.05)。
表1 各组大鼠干预期间FBG 比较(±s,mmol/L)Table 1 Comparison of FBG of rats in each group during intervention (±s,mmol/L)
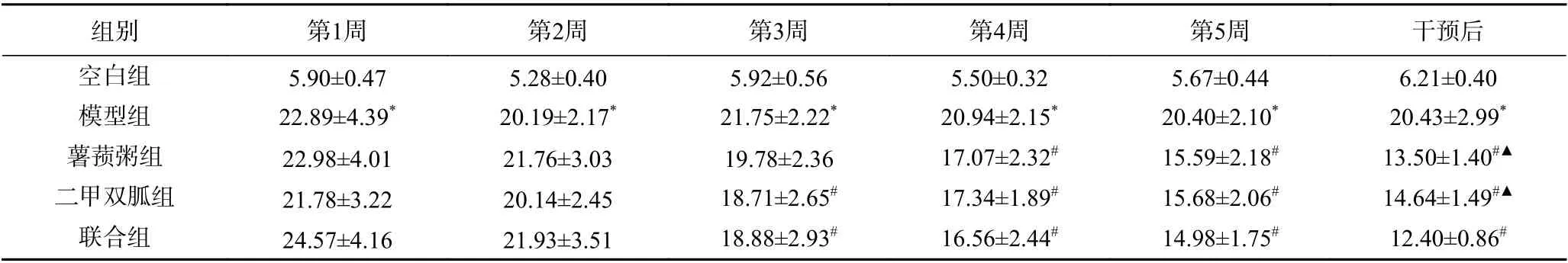
表1 各组大鼠干预期间FBG 比较(±s,mmol/L)Table 1 Comparison of FBG of rats in each group during intervention (±s,mmol/L)
注:*:与空白组相比,P<0.01;#:与模型组相比,P<0.01;▲:与联合组相比,P<0.05。
组别 第1周 第2周 第3周 第4周 第5周 干预后空白组 5.90±0.47 5.28±0.40 5.92±0.56 5.50±0.32 5.67±0.44 6.21±0.40模型组 22.89±4.39* 20.19±2.17* 21.75±2.22* 20.94±2.15* 20.40±2.10* 20.43±2.99*薯蓣粥组 22.98±4.01 21.76±3.03 19.78±2.36 17.07±2.32# 15.59±2.18# 13.50±1.40#▲二甲双胍组 21.78±3.22 20.14±2.45 18.71±2.65# 17.34±1.89# 15.68±2.06# 14.64±1.49#▲联合组 24.57±4.16 21.93±3.51 18.88±2.93# 16.56±2.44# 14.98±1.75# 12.40±0.86#
2.3 各组大鼠血清胰岛素、胰岛素抵抗指数比较
由表2可知,模型组大鼠的血清空腹胰岛素水平、胰岛素指数均显著高于空白组(P<0.05);薯蓣粥组与模型组相比,血清空腹胰岛素、胰岛素抵抗指数显著下降(P<0.05),与二甲双胍组、联合组相比没有统计学差异(P>0.05)。
表2 各组大鼠干预后胰岛素、胰岛素抵抗指数比较(±s)Table 2 Comparison of FINS and HOMA-IR of rats in each group after intervention
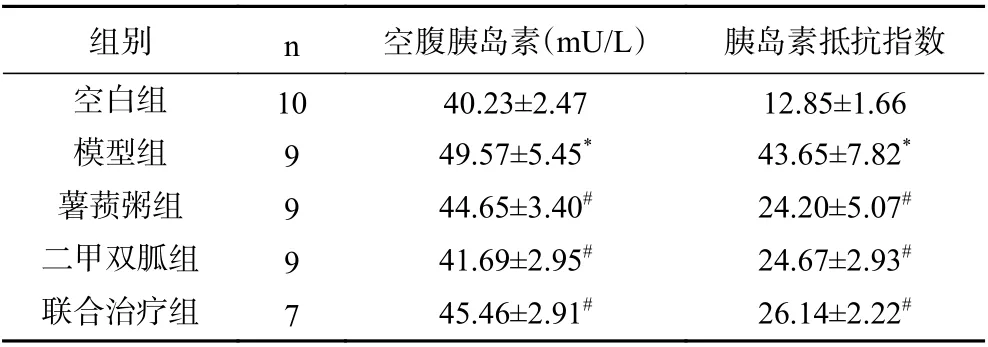
表2 各组大鼠干预后胰岛素、胰岛素抵抗指数比较(±s)Table 2 Comparison of FINS and HOMA-IR of rats in each group after intervention
注:*:与空白组相比,P<0.05;#:与模型组相比,P<0.05;表3同。
组别 n 空腹胰岛素(mU/L) 胰岛素抵抗指数空白组 10 40.23±2.47 12.85±1.66模型组 9 49.57±5.45* 43.65±7.82*薯蓣粥组 9 44.65±3.40# 24.20±5.07#二甲双胍组 9 41.69±2.95# 24.67±2.93#联合治疗组 7 45.46±2.91# 26.14±2.22#
2.4 高通量测序结果
2.4.1 测序数据 fastp 软件分析得出所有样本中Q20 值最小为96.32%,Q30 值最小为94.64%,表示测序的准确度较高。使用usesrch10.0 软件进行相似度97%的OTU 聚类分析。分析共得到OTU 1511个,其中999(86.01%)个OTU 注释到门。以样本的OTUs 的排序编号为横坐标,OTUs 中的相对丰度为纵坐标,绘制得到Rank Abundance 曲线(见图1),Rank Abundance 曲线逐渐趋于平缓,说明测序数据量渐进合理,能够进行后续分析。
图1 Rank Abundance 曲线Fig.1 Rank Abundance curve
2.4.2 各组大鼠肠道菌群多样性分析
2.4.2.1 Alpha 多样性结果分析 由表3可知,模型组大鼠的OTUs、Chao1 指数(反应菌群丰富度)、Shannon 指数(反应菌群多样性)均低于空白组(P<0.05);薯蓣粥大鼠OTUs 指数高于模型组(P<0.05),与二甲双胍组、联合组相比没有统计学差异(P>0.05)。
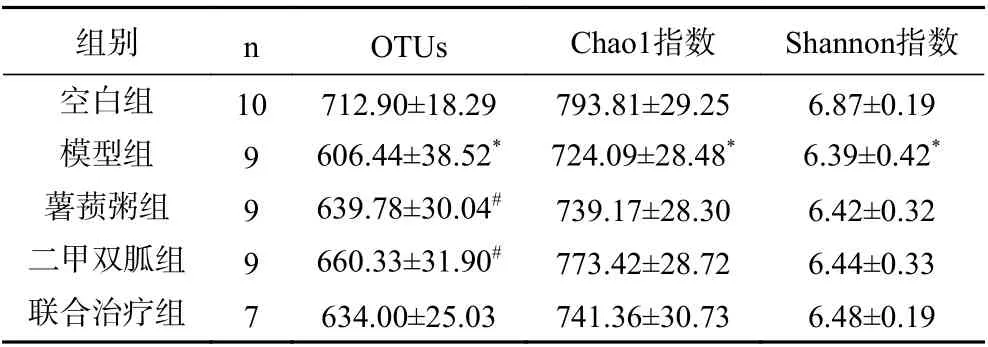
表3 各组大鼠干预后肠道菌群物种的多样性比较Table 3 Comparison of species diversity of gut microflora of rats in each group after intervention
2.4.2.2 Beta 多样性分析 bray-curtis 值反应不同样本间的生物构成差异,越接近1 代表样本间差异越大。进行同组之间样本的对比见表4:模型组大鼠的bray-curtis 值极显著高于空白组(F=32.595,P<0.01),表示模型组大鼠组内的菌群构成差异性大于空白组,具有统计学意义;不同组样本之间的对比显示:模型组和空白组样本之间的bray-curtis 值均大于模型组与其他组样本的bray-curtis 值(F=25.443,P<0.001),说明模型组与空白组之间的菌群构成差异较大。
表4 各组大鼠干预后bray-curtis 值比较(±s)Table 4 Comparison of bray-curti index of rats in each group after intervention
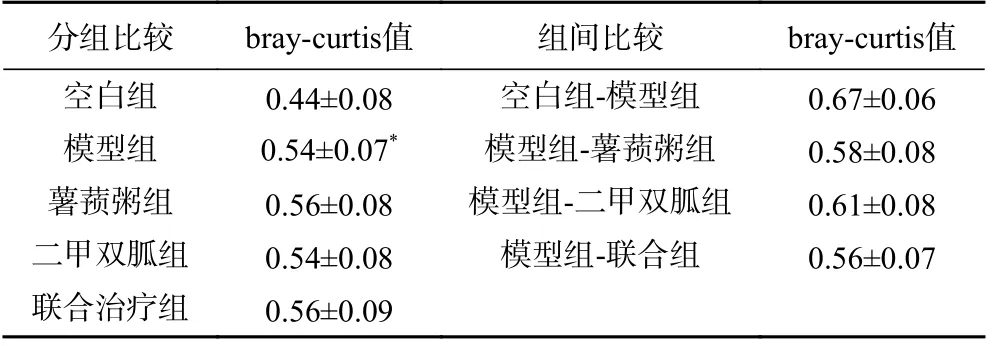
表4 各组大鼠干预后bray-curtis 值比较(±s)Table 4 Comparison of bray-curti index of rats in each group after intervention
注:*:与空白组相比,P<0.05;
?
2.4.3 各组大鼠菌群物种组成分析
2.4.3.1 细菌门分类水平比较 厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)是五组大鼠在门水平上的主要细菌,占90%以上,见图2。模型组中厚壁菌门的相对丰度(75.67%±8.22%)低于薯蓣粥组(88.37%±2.33%)和空白组(86.99%±2.76%)(F=5.432,P<0.001)。模型组中疣微菌门(Verrucomicrobia)的相对丰度(0.41%±0.34%)低于空白组(2.12%±0.47%)、薯蓣粥组(1.59%±0.53%,F=3.735,P=0.039)。模型组中变形菌门(Proteobacteria)的相对丰度(7.16%±3.05%)高于空白组(2.06%±1.54%),薯蓣粥组(1.99%±1.51%),二甲双胍组(2.48%±1.02%),联合组(2.32%±1.43%)(P<0.001)(F=10.618,P<0.001)。
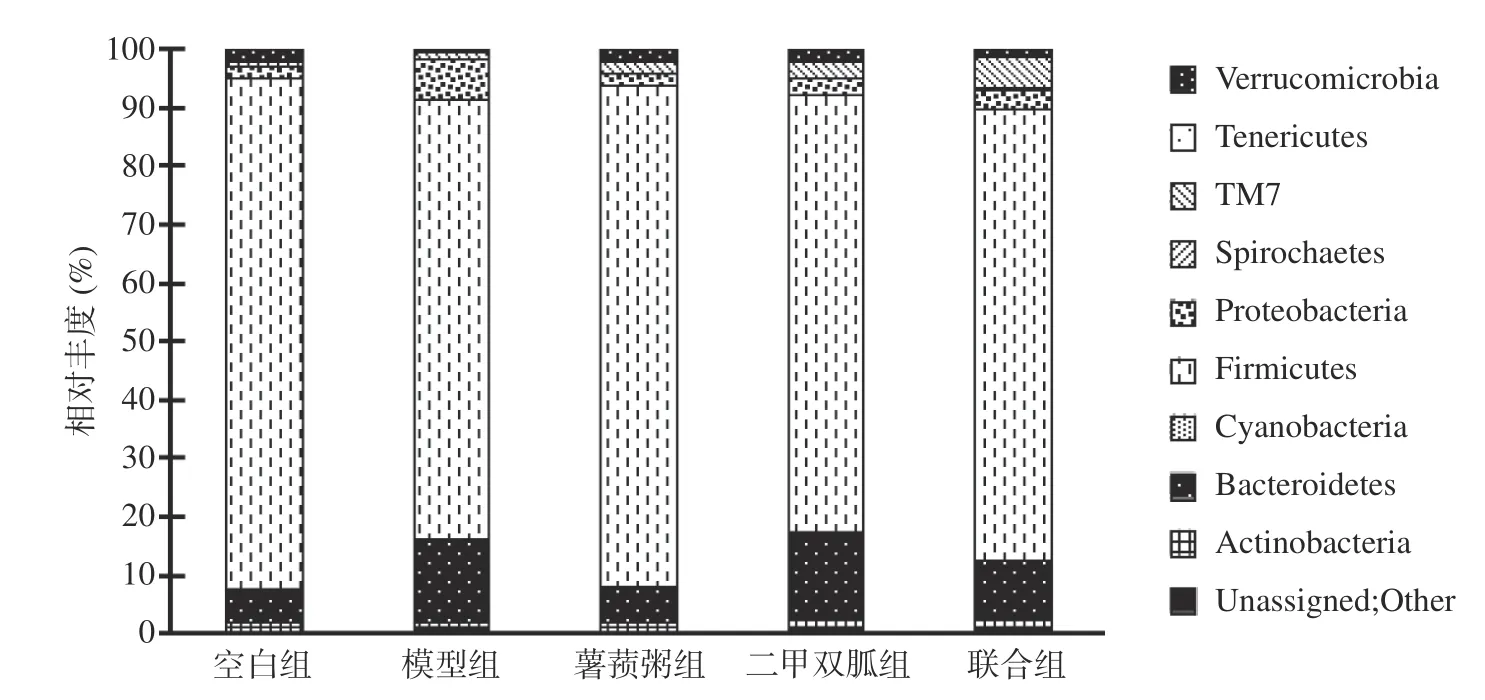
图2 各组大鼠门水平的细菌结构Fig.2 Bacterial structure at the level of phylum in each group
2.4.3.2 细菌属水平分类比较 乳酸杆菌(p__Firmicutes,Lactobacillus)、颤螺菌(p__Firmicutes,Oscillospira)、胃瘤球菌(p__Firmicutes,Ruminococcus)、阿克曼氏菌(p__Verrucomicrobia,Akkermansia)是五组大鼠在属水平上的主要细菌,见图3。模型组的梭菌含量(1.05%±0.30%)低于空白组(2.97%±0.58%)、二甲双胍组(2.78%±0.61%)、薯蓣粥组(2.66%±0.40%)、联合组(2.39%±0.35%)(F=23.579,P<0.005);模型组的颤螺菌(3.33%±1.52%)含量低于空白组(11.33%±5.33%,F=5.675,P=0.01)。模型组中阿克曼氏菌的相对丰度(0.41%±0.34%)低于空白组(2.12%±0.47%)、薯蓣粥组(1.59%±0.53%)(F=3.735,P=0.039)。
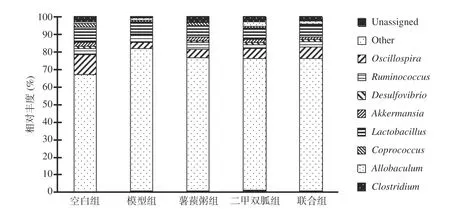
图3 各组大鼠属水平的细菌结构Fig.3 Bacterial structure at the genus level in each group
2.5 各组大鼠粪便内短链脂肪酸水平比较
由表5可知,模型组大鼠粪便中乙酸、丙酸、丁酸的含量均显著低于空白组(P<0.05);薯蓣粥组、二甲双胍组、联合组大鼠粪便中乙酸、丙酸、丁酸的含量均极显著高于模型组(P<0.01);联合组大鼠粪便中丁酸的含量显著高于薯蓣粥组、二甲双胍组(P<0.05)。
表5 各组大鼠粪便中SCFAs 比较(±s,mg/L)Table 5 Comparison of SCFAs in feces of rats in each group (±s,mg/L)
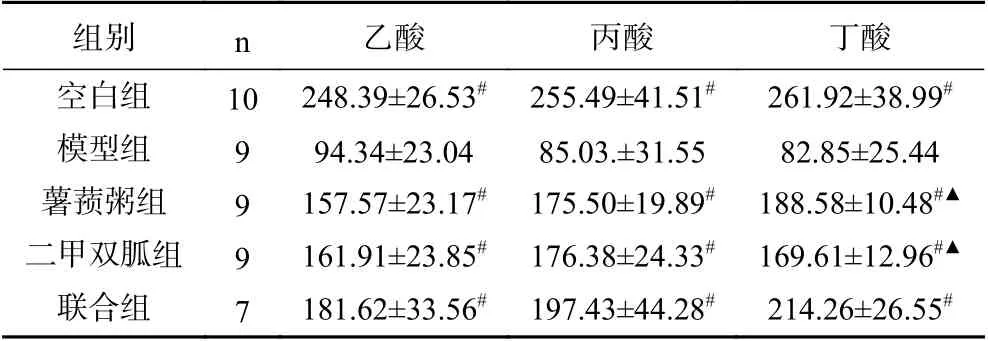
表5 各组大鼠粪便中SCFAs 比较(±s,mg/L)Table 5 Comparison of SCFAs in feces of rats in each group (±s,mg/L)
注:# :与模型组相比,P<0.01;▲:与联合组相比,P<0.05。
组别 n 乙酸 丙酸 丁酸空白组 10 248.39±26.53# 255.49±41.51# 261.92±38.99#模型组 9 94.34±23.04 85.03.±31.55 82.85±25.44薯蓣粥组 9 157.57±23.17# 175.50±19.89# 188.58±10.48#▲二甲双胍组 9 161.91±23.85# 176.38±24.33# 169.61±12.96#▲联合组 7 181.62±33.56# 197.43±44.28# 214.26±26.55#
2.6 相关性分析
将肠道内主要细菌、胰岛素抵抗指数、空腹血糖与SCFAs 进行相关性分析,如表6所示,结果发现:厚壁菌与乙酸、丙酸、丁酸的含量都呈正相关关系(P<0.01);梭菌与丁酸的含量呈正相关(P=0.01);胰岛素抵抗指数与乙酸、丙酸、丁酸皆呈强负相关关系(P<0.001);FBG与乙酸、丙酸、丁酸皆呈强负相关关系(P<0.001)。

表6 相关性分析Table 6 Correlation analysis
3 讨论与结论
3.1 T2DM 大鼠肠道微生物变化
本研究发现,与正常大鼠相比,T2DM 大鼠肠道菌群的多样性、丰富度降低,与其他研究结果一致[14−15]。分析大鼠菌群构成的差异性可知,模型组和空白组之间存在较为明显的菌群构成差异,并且模型组组内的菌群构成差异也大于空白组,说明T2DM改变了大鼠的肠道菌群构成,与王瑾等[16]研究一致。具体分析菌群物种组成变化:在门水平上,T2DM增加了大鼠肠道内厚壁菌门的相对丰度,减少了变形菌门的相对丰度;在属水平上,T2DM 减少了了大鼠肠道内颤螺菌、梭菌、阿克曼氏菌的相对丰度。有研究发现,T2DM 患者的梭菌(能促进丁酸产生)丰度下降,芽孢杆菌和变形杆菌丰度增加,而大部分芽孢杆菌和变形杆菌为机会致病菌[17−19],由此可见,T2DM改变肠道菌群的多样性和丰富性,增加机会致病菌,导致肠道微生态紊乱[20−21]。
3.2 薯蓣粥对T2DM 大鼠肠道微生物的影响
本研究发现,薯蓣粥、二甲双胍、联合治疗均能降低变形菌的相对丰度,在此基础上薯蓣粥还能够上调厚壁菌、梭菌、阿克曼氏菌的相对丰度,增加OTUs。薯蓣粥与二甲双胍、联合治疗相比,能够调整更多的肠道菌群,改善肠道环境,由此可见,薯蓣粥在调节T2DM 肠道微生物上比单独使用二甲双胍、二甲双胍与薯蓣粥联用更具有优势。厚壁菌能够促进丙酸、丁酸生长,梭菌能够促进乙酸、丁酸生长,二者皆有利于SCFAs 产生,继而改善T2DM[21]。阿克曼氏菌是疣微菌的一种,能够影响机体的能量代谢,在肠道中的含量与肥胖、糖尿病等代谢性疾病呈负相关[22−24]。研究显示,阿克曼氏菌在T2DM 中能够发挥出色作用,补充灭活的阿克曼氏菌可显著改善超重/肥胖的胰岛素抵抗者的多项代谢指标,缓解胰岛素抵抗,降低体重、血糖[25];动物实验中还发现,阿克曼氏菌能够改善炎症反应,减轻氧化应激、使宿主动物肠道菌群正常化,从而改善T2DM[26]。
3.3 薯蓣粥对T2DM 大鼠SCFAs 的影响
表2可知,薯蓣粥能够增加T2DM 大鼠肠道内乙酸、丁酸、丙酸的含量。SCFAs 由厌氧菌分解碳水化合物产生,包括乙酸、丙酸和丁酸,在控制体重,平衡葡萄糖稳态、胰岛素敏感性等方面发挥重要作用,对T2DM 的健康至关重要[27−28]。本研究显示,薯蓣粥能增加厚壁菌、梭菌的相对丰度,厚壁菌与乙酸、丙酸、丁酸的含量都呈正相关,梭菌与丁酸的含量呈正相关,说明薯蓣粥通过增加梭菌、厚壁菌,促进SCFAs 产生,其他研究也认为,厚壁菌、梭菌能够促进SCFAs 产生,与本研究结果一致[20,23]。推测薯蓣粥对肠道菌群、SCFAs 的作用与其富含山药多糖有关,山药多糖是山药中的主要活性成分,具有调节胃肠道的功能,能够缓解肠道微生态失调,以及通过调节免疫系统和炎症反应维护肠道的屏障功能[9]。动物实验显示,山药多糖能够缓解抗生素诱导的菌群失调,增加梭菌含量,减少有害菌,调整肠道菌群的丰富性和多样性,促进SCFAs 含量上升[29−30]。
3.4 薯蓣粥对T2DM 大鼠胰岛素、血糖的影响
本研究中,T2DM 大鼠的空腹胰岛素含量、胰岛素抵抗指数较空白组均有明显上升,经薯蓣粥干预后,空腹胰岛素含量、胰岛素抵抗指数均显著下降(P<0.05),说明薯蓣粥能够明显降低T2DM 大鼠的胰岛素水平,缓解高脂饮食所诱导的胰岛素抵抗。李亚娟等[31]的研究也显示,糖尿病患者服用含山药的食疗方后胰岛素功能得到明显改善,与本研究结果一致。在血糖方面,薯蓣粥组大鼠从第4 周起出现明显的血糖下降;比较干预后的空腹血糖,联合组的降糖效果优于薯蓣粥组,二甲双胍组、薯蓣粥组相比没有统计学差异,表明薯蓣粥联合二甲双胍的降糖效果最优,薯蓣粥的降糖作用虽比二甲双胍起效迟,但降糖效果上差异不明显。此外,本研究还发现:胰岛素抵抗指数和FBG 皆与乙酸、丙酸、丁酸呈强负相关关系,推测薯蓣粥通过增加SCFAs,可发挥缓解胰岛素抵抗、降低血糖的作用。SCFAs 中的乙酸和丙酸都是糖脂代谢过程中的重要底物,能够影响机体的物质、能量代谢,是维持葡萄糖、脂肪代谢的重要调节剂[4,22]。动物实验显示,通过调节肠道菌群,增加SCFAs 含量,能够减轻机体炎症反应,改善胰岛素抵抗,降低T2DM 大鼠的血糖[32−33]。课题组前期研究证实,薯蓣粥能够在一定程度上缓解T2DM 大鼠的炎症反应,改善胰岛细胞功能(尚未公开发表);结合本研究的发现,推测薯蓣粥可能通过改善T2DM 大鼠肠道微生物失调,增加SCFAs 来发挥减轻炎症反应、缓解胰岛β 细胞损伤的作用,进而达到缓解胰岛素抵抗、降低血糖的效果。本实验发现SCFAs 与T2DM 大鼠的血糖密切相关,将在后续实验中探讨薯蓣粥对T2DM 大鼠肠道炎症的影响,进一步明确SCFAs 的具体降糖机制。
3.5 局限性
山药的生长环境、生长季节对山药的品质存在一定影响,本研究进行灌胃干预的时间为6 周,所需要的铁棍山药无法一次性买齐使用,需要分多次购买。本研究虽无法保证所使用山药的品质绝对一致,但尽量控制山药的产地,品质统一;研究人员在同一商家购买6 周之内产自河南省焦作市温县的铁棍山药,使用标准:采用表皮光滑,断层雪白,无斑点和霉点,含黏液较多的山药做粥。后续实验中也可比对不同季节、产地的山药对T2DM 的治疗效果。
3.6 结论
通过对T2DM 大鼠6 周的干预发现,使用薯蓣粥灌胃能缓解肠道微生物失调,增加短链脂肪酸含量,缓解胰岛素抵抗,降低T2DM 大鼠血糖。本次研究未深入研究短链脂肪酸的降糖通路,未来将进一步探讨薯蓣粥对T2DM 的降糖机制,为薯蓣粥的推广和应用提供依据。
